血管紧张素1-7对高脂诱导小鼠肝脏损伤的保护作用*
2018-02-28黄文瀚任飞凤潘珠玛重庆医科大学附属第二医院风湿免疫科重庆40000重庆市第七人民医院内分泌肾病科400054重庆医科大学病毒性肝炎研究所重庆40006
黄文瀚,任飞凤,罗 蕾,周 俊,潘珠玛,郭 晖,唐 琳△(.重庆医科大学附属第二医院风湿免疫科,重庆40000;.重庆市第七人民医院内分泌、肾病科400054;.重庆医科大学病毒性肝炎研究所,重庆40006)
高脂血症是导致肝脏疾病的独立危险因素[1-2],脂质沉积与肝脏损伤密切相关[3-4]。人体对于低密度脂蛋白(LDL)的吸收主要受到低密度脂蛋白受体(LDLr)、固醇调节元件结合蛋白2(SREBP2)和SREBP分解活性蛋白(SCAP)的调控[5],因此,三者组成负反馈系统,起到调节体内脂质的作用。
血管紧张素转化酶2(ACE2)-血管紧张素1-7[Ang-(1-7)]-Mas受体轴是肾素-血管紧张素-醛固酮系统的一个新的分支,有大量研究报道了该轴参与脂质代谢的调节[6-7],但是,其机制目前尚未明确。作者推测,Ang-(1-7)能够调节肝脏中LDLr-SREBP2-SREBP分解活性蛋白系统,进而减轻肝脏对脂质的吸收,起到保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康6周龄SPF级C57BL/6小鼠40只,购于重庆医科大学动物实验中心。
1.1.2 动物模型制备 将40只健康C57BL/6小鼠随机平均分为正常组、高脂组、高脂+Ang-(1-7)组、Ang-(1-7)组。正常组进食普通饲料;高脂组进食高脂饲料(热量组成:脂肪60%,蛋白质20%,碳水化合物20%);高脂+Ang-(1-7)组小鼠在高脂饮食的基础上给予Ang-(1-7),以浓度144 μg/(kg·d)连续渗透泵(型号2002,Alzet)皮下泵入;Ang-(1-7)组小鼠在给予普通饲料饮食基础上,以同样Ang-(1-7)浓度连续皮下泵入。实验小鼠按上述实验方法饲养12周,环境温度控制在(20±2)℃,正常光照。
1.2 方法
1.2.1 采样方法 所有实验小鼠于采样前一晚20:00禁食不禁饮,12 h后采眼眶血,剖取肝脏。
1.2.2 检测方法
1.2.2.1 小鼠血脂水平检测 采集小鼠眼眶血后以2 000 r/min、离心15 min分离血清,并送检生化检测总胆固醇(TC)、三酰甘油(TG)、LDL水平。
1.2.2.2 小鼠肝脏油红O染色 小鼠肝脏行冰冻切片后用10%甲醛盐溶液固定30 min,用双蒸水洗2次,向切片加1,2-丙二醇孵育2 min后,加油红O工作液对切片进行染色30 min,清洗后用Carazzi′s苏木素对切片染色2 min,清洗后使玻片充分干燥,用甘油乙烯醇(GVA)水溶性封片剂固定,在显微镜下对细胞进行观察并照相保存。
1.2.2.3 小鼠肝脏SREBP2蛋白测定 取小鼠肝脏按试剂盒说明提取总蛋白,并行蛋白浓度测定,等量取各组蛋白30 μg予以上样、电泳、转膜、封闭后,分别加SREBP2和磷酸甘油醛脱氢酶(GAPDH)一抗孵育过夜,Tris碱吐温缓冲液冲洗后放入羊抗兔二抗中孵育1 h。洗膜后行电化学发光曝光采集图像,分析蛋白条带灰度值。
1.3 统计学处理 应用SPSS17.0统计软件进行数据分析,试验结果采用单因素方差分析(one-wayANOVA),多重检验校正采用Bonferroni校正。P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠血清血脂水平检测结果 高脂组小鼠血清TC、TG、LDL水平均明显高于正常组和高脂+Ang-(1-7)组,差异均有统计学意义(P<0.05);Ang-(1-7)组单独处理C57BL/6小鼠,其血清TC、TG、LDL水平与正常组比较,差异均无统计学意义(P>0.05)。见表1。
表1 各组小鼠血清血脂水平检测结果比较(±s,mmol/L)

表1 各组小鼠血清血脂水平检测结果比较(±s,mmol/L)
注:与高脂组比较,aP<0.05
指标TC TG LDL正常组2.31±0.28a 0.44±0.04a 0.28±0.03a高脂组4.17±0.34 0.78±0.09 0.61±0.07高脂+Ang-(1-7)组3.11±0.21a 0.61±0.11a 0.47±0.05a Ang-(1-7)组2.26±0.32 0.47±0.06 0.31±0.05
2.2 小鼠肝脏组织油红O染色结果 正常组小鼠肝脏中脂质分布均匀(图1A);而高脂组小鼠肝脏组织中可见大量红染脂质沉积(图1B);Ang-(1-7)能显著抑制小鼠肝脏对脂质的吸收(图 1C)。Ang-(1-7)单独处理C57BL/6小鼠,其肝脏脂质分布与正常组无差异(图1D)。
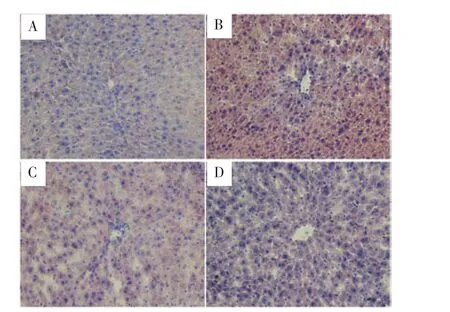
图1 C57BL/6小鼠肝脏组织油红O染色(200×)
2.3 小鼠肝脏SREBP2蛋白表达水平 Western blotting检测结果显示,高脂组小鼠肝脏中SREBP2蛋白表达水平较正常组降低,高脂+Ang-(1-7)组小鼠肝脏中SREBP2蛋白表达水平较高脂组更为抑制,而Ang-(1-7)组小鼠肝脏中SREBP2蛋白表达水平与正常组无明显差异。见图2。
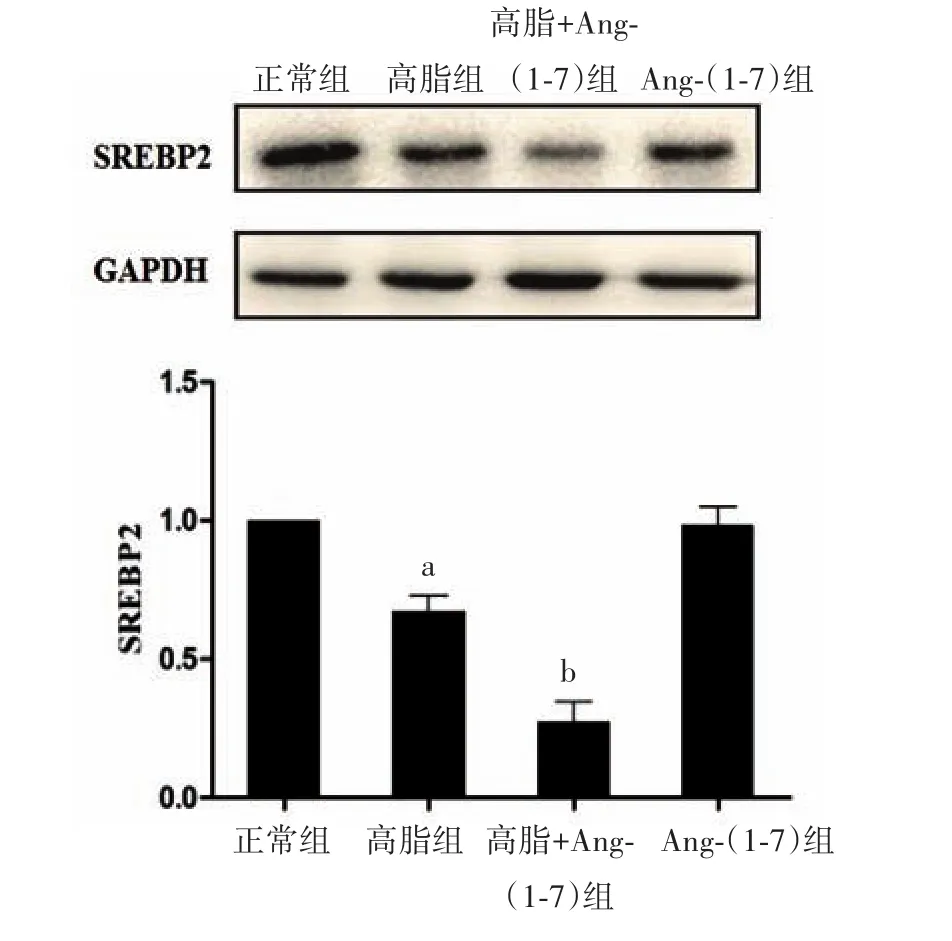
图2 C57BL/6小鼠肝脏SREBP2蛋白表达水平
3 讨 论
ACE2-Ang-(1-7)-Mas轴的发现使得该轴成为一项新的研究热点。SANTOS等[8]发现,在高脂诱导的大鼠模型中,Ang-(1-7)能够明显减轻大鼠的体重和皮下脂肪的含量,并且降低血浆TC和TG水平。此外,SINGH等[9]研究小组报道,在糖尿病大鼠研究模型中,Ang-(1-7)能够显著缓解大鼠血脂异常,进一步证实Ang-(1-7)对血脂的调节作用。
然而,ACE2-Ang-(1-7)-Mas轴的脂质调节机制仍然不清。OH 等[10]认为,Ang-(1-7)在大鼠体内通过增加甘油的释放起到分解脂肪的作用,而这一作用能够被磷脂酰肌醇3激酶(PI3K)抑制剂削弱,提示Ang-(1-7)是通过PI3K信号通路发挥作用。SANTOS等[11]则认为,脂肪脂质结合蛋白参与了脂肪酸的酯化过程,而Ang-(1-7)可增加体内该蛋白的表达,从而起到调节脂质代谢的作用。
本动物研究结果表明了另一种脂质调节过程,发现在高脂饲养的C57BL/6小鼠中,Ang-(1-7)能够显著降低小鼠血清TC、TG、LDL水平,抑制肝脏对脂质的吸收,并且证实ACE2-Ang-(1-7)-Mas轴参与脂质代谢调控是通过调节C57BL/6小鼠肝脏中LDLr-SREBP2-SCAP负反馈轴而实现。首先,本研究发现,高脂饮食可引起小鼠肝脏LDLr-SREBP2-SCAP轴正常的负反馈效应,使 SREBP2 蛋白的表达降低;其次,Ang-(1-7)在小鼠皮下微量泵入能够使这一负反馈效应放大,导致小鼠肝脏SREBP2蛋白表达进一步下降,而SREBP2的低表达可抑制LDLr基因转录,因此,LDLr的合成相应减少,从而阻止C57BL/6小鼠肝脏细胞对脂质的吸收,起到对肝脏的保护作用。
本研究进一步从机制层面阐明了ACE2-Ang-(1-7)-Mas轴对脂质代谢的调节,丰富了对Ang-(1-7)的认识,同时也为后续的研究打下了理论基础。
[1]倪曼曼,张颖秋,陈岳祥,等.非酒精性脂肪性肝病患者发病和预后的影响因素分析[J].临床肝胆病杂志,2016,32(3):453-458.
[2]赵嫦颖,王凤荣.高脂血症与肝脏功能失调相关性探析[J].实用中医内科杂志,2009,23(11):37-38.
[3]庄振杰,刘静,柳银兰,等.鱼油对高果糖高脂高胆固醇饮食诱导的小鼠非酒精性脂肪性肝炎的影响[J].中华实验和临床病毒学杂志,2015,29(1):12-15.
[4]范建高,钟岚,王国良,等.肥胖、高脂血症性脂肪性肝炎细胞凋亡的实验研究[J].中华消化杂志,2000,20(6):421-422.
[5]叶强,雷寒,范忠才,等.SCAP/SREBP2/LDLr通路在LPS诱导人血管平滑肌细胞泡沫化中的作用[J].泸州医学院学报,2014,37(4):361-366.
[6]HUANG W,TANG L,CAIY,etal.Effectand mechanism ofthe Ang-(1-7)on human mesangial cells injury induced by low density lipoprotein[J].Biochem Biophys Res Commun,2014,450(2):1051-1057.
[7]ZHENG Y,TANG L,HUANG W,et al.Anti-Inflammatory Effects of Ang-(1-7)in Ameliorating HFD-Induced Renal Injury through LDLr-SREBP2-SCAP Pathway[J].PLoS One,2015,10(8):e0136187.
[8]SANTOS SH,ANDRADE JM,FERNANDES LR,et al.Oral Angiotensin-(1-7)prevented obesity and hepatic inflammation by inhibition of resistin/TLR4/MAPK/NF-κB in rats fed with high-fat diet[J].Peptides,2013,46:47-52.
[9]SINGH T,SSINGH K,SHARMA PL.Ameliorative potential of angiotensin1-7/Mas receptor axis in streptozotocin-induced diabetic nephropathy in rats[J].Methods Find Exp Clin Pharmacol,2010,32(1):19-25.
[10]OH YB,KIM JH,PARK BM,et al.Captopril intake decreases body weight gain via angiotensin-(1-7)[J].Peptides,2012,37(1):79-85.
[11]SANTOS SH,BRAGA JF,MARIO EG,et al.Improved lipid and glucose metabolism in transgenic rats with increased circulating angiotensin-(1-7)[J].Arterioscler Thromb Vasc Biol,2010,30(5):953-961.
