基于基因组学探讨糖尿病肾病的发病原因 及其与心血管疾病的关系
2018-02-27任晓梅杨景锋刘启玲张荣强
任晓梅,杨景锋,刘启玲,辛 宝,张荣强
(陕西中医药大学公共卫生学院,陕西咸阳 712046)
随着经济的发展,糖尿病患者数量在全球范围内快速增长。2013年国际糖尿病联盟统计数据显示,我国20~79岁糖尿病患者为0.98亿,预计到2035年将增至1.43亿[1]。糖尿病对人体的危害主要体现在其引发的多种并发症上,如糖尿病眼病、糖尿病神经病变、糖尿病肾病(diabetes kidney disease, DKD)等,而DKD是导致终末期肾病发生的主要原因[2]。之前单个的基因研究尚未阐释DKD的发病原因,需要更进一步的探索。本研究对基因芯片公共数据库(Gene Expression Omnibus, GEO)收录的一组DKD患者肾小球组织差异表达的基因芯片数据资料进行生物信息学分析,探讨DKD患者肾脏分子网络改变情况及其可能涉及的分子生物学功能,为DKD的早期诊断及治疗提供临床依据,对患者预后的影响具有重要的意义。
1 材料与方法
1.1 差异表达的基因数据 本研究所采用的基因表达谱数据是从Pubmed下载所得,在GEO数据库中以“diabetic kidney disease”为检索词进行检索,获得PARK AS, MOHTAT D等提交的芯片数据GSE30528,此数据集于2011年7月提交并于2017年1月更新。GSE30528所用实验平台为Affymetrix公司提供的人类Human Genome U133A 2.0基因表达芯片平台GPL571。总共22个样本,其中DKD患者肾小球RNA标本9例,健康对照组13例。GSE30528数据集共包含了22 277个基因的表达资料,本研究重点分析其生物信息学特征。
1.2 两组人群基因表达谱系分析 Qlucore Omics Explorer(QOE)可用于基因芯片、蛋白芯片等的分析,功能完善,操作简便。本研究利用QOE 3.1和R语言对芯片数据进行分析,首先对数据集GSE30528中的基因芯片数据进行(均数=0,标准差=1)标准化处理;通过(P<0.01,q<0.01)过滤后行两独立样本t检验,筛选出DKD患者与健康对照组的差异表达基因,然后对数据集GSE30528中的基因芯片数据行主成分分析及分层聚类分析。
1.3 差异表达基因的蛋白-蛋白相互作用图谱分析 将DKD患者与健康对照组差异表达的前20个基因相应的蛋白名称上传至蛋白-蛋白相互作用在线分析软件STRING 10.0,根据具体的分析结果适当调节可信度和附加节点参数,绘制两组差异表达基因的蛋白-蛋白相互作用图谱。
1.4 差异表达基因的GO功能富集分析 将筛选出的前20个差异表达基因上传至GenCliP 2.0,选择GO功能富集状况分析,根据需要调节各类分析的主要参数后进行分析。
1.5 差异表达基因及信号通路共表达网络分析 将两组Top 250差异基因导入GCBI,分析并绘制差异表达基因及信号通路共表达网络,以探寻在DKD发生和发展过程中的关键基因相互作用网络。
2 结 果
2.1 芯片数据预处理 数据集GSE30528 DKD患者及健康对照组肾小球组织中基因表达数据经标准化之后,各样本的芯片表达数据均以0为中心波动,提示数据的稳定性好,可以进一步展开分析。
2.2 两组人群基因表达模式的比较 根据人群基因表达主成分分析结果,两组人群的基因表达模式可见明显差异,X轴、Y轴、Z轴的数据方差贡献率分别为9%、6%、50%,在Z轴方向上DKD患者与健康对照组表达差异最明显,提示DKD会影响患者肾小球组织的基因表达模式。
2.3 DKD患者与健康对照组肾小球差异表达基因分析 DKD患者与健康对照组肾小球组织中共有844个差异表达基因(P<0.05,q<0.05, Fold change≥2),其中DKD下调的有606个(71.80%),上调的有238个(28.20%),两组基因转录谱火山图见图1。两组人群肾小球组织差异表达前20位基因列表见表1。

图1 DKD患者与健康对照组肾小球组织表达谱的比较
Fig.1 Gene expression profile in the glomerulus of DKD patients and controls
2.4 差异表达基因的蛋白-蛋白相互作用结果 蛋白-蛋白相互作用网络中包含1个最典型的子网络(图2),主要与肌节收缩蛋白的合成等生物学功能有关。其中,TNNT2与网络中的其他≥7个蛋白存在相互作用关系,删除该节点后,网络结构涣散,可以认为TNNT2是子网络的核心节点,提示TNNT2对于DKD的诊断具有一定的价值。
2.5 TNNT2基因功能及其相关疾病谱分析 采用GCBI基因雷达对TNNT2基因的功能进行验证。TNNT2可直接与TPM1、TPM2、TPM3、TPM4等蛋白相结合(图3A),TPM1、TPM2、TPM3、TPM4在心脏收缩等过程中起关键作用。在发表的与TNNT2有关的文献里,TOP 20的疾病中,有至少11种与心血管疾病有关(图3B),提示:对心血管疾病具有关键调控作用的TNNT2基因在DKD发生和发展过程中也起着重要作用。
表1 两组人群肾小球组织差异表达前20位基因
Tab.1 Top 20 differentially expressed genes in DKD patients and controls
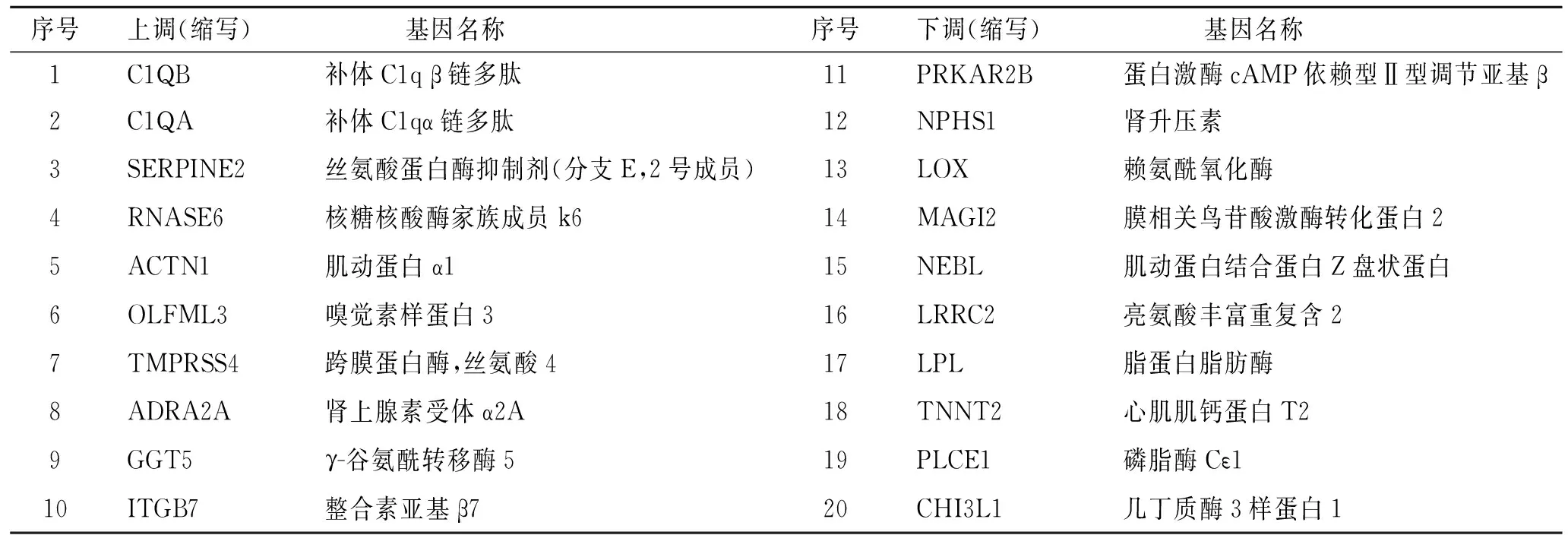
序号上调(缩写)基因名称序号下调(缩写)基因名称1C1QB补体C1qβ链多肽11PRKAR2B蛋白激酶cAMP依赖型Ⅱ型调节亚基β2C1QA补体C1qα链多肽12NPHS1肾升压素3SERPINE2丝氨酸蛋白酶抑制剂(分支E,2号成员)13LOX赖氨酰氧化酶4RNASE6核糖核酸酶家族成员k614MAGI2膜相关鸟苷酸激酶转化蛋白25ACTN1肌动蛋白α115NEBL肌动蛋白结合蛋白Z盘状蛋白6OLFML3嗅觉素样蛋白316LRRC2亮氨酸丰富重复含27TMPRSS4跨膜蛋白酶,丝氨酸417LPL脂蛋白脂肪酶8ADRA2A肾上腺素受体α2A18TNNT2心肌肌钙蛋白T29GGT5γ-谷氨酰转移酶519PLCE1磷脂酶Cε110ITGB7整合素亚基β720CHI3L1几丁质酶3样蛋白1
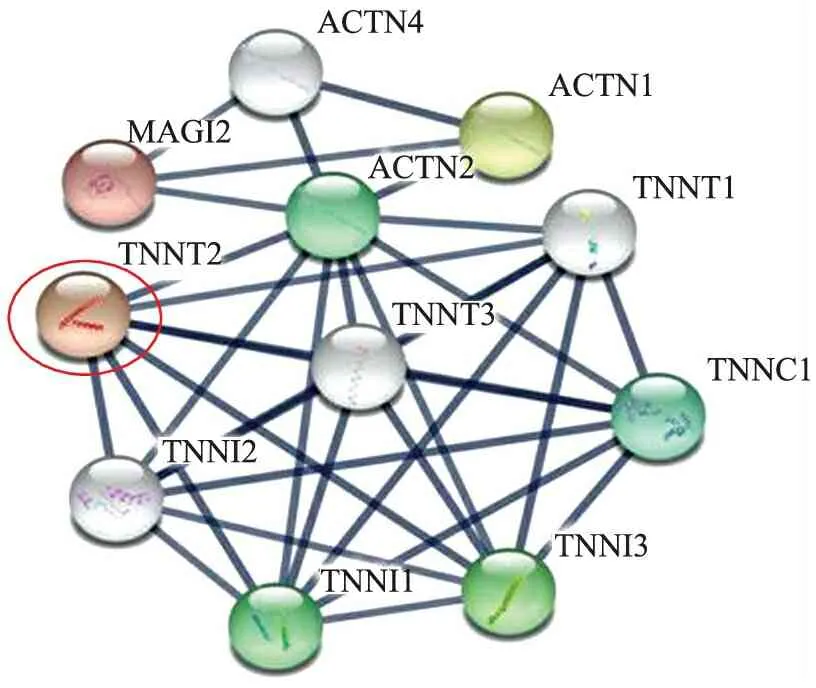
图2 差异表达基因的蛋白-蛋白相互作用网络图
Fig.2 Network of protein-protein interactions for differentially expressed genes
2.6 差异表达基因功能分析 GO功能富集分析结果显示,12个(60%)基因(LOX、OLFML3、NEBL、ITGB7、NPHS1、LPL、PRKAR2B、CHI3L1、SERPINE2、C1QB、C1QA、RNASE6)与胞外囊泡、细胞器的形成有关;3个(15%)基因(LPL、PRKAR2B、SERPINE2)与应激反应有关;2个(10%)基因(MAGI2、RNASE6)与肾小球内脏上皮细胞发育、过滤膜形成、狭缝隔膜形成有关。
2.7 DKD患者与健康对照组差异表达基因信号通路共表达网络 DKD患者与健康对照组差异表达基因共涉及48条信号通路,其中下调的有2条(4.17%),上调的有4条(8.33%),既有上调又有下调的42条(87.50%)。48条信号通路中,共有176个共表达网络关联节点,其中涉及网络关联节点最多的信号通路为MAPK信号通路,共涉及30个节点,共有28条信号通路与其存在共表达网络,该信号通路网络主要与炎症反应调节、细胞凋亡等作用有关(图4)。
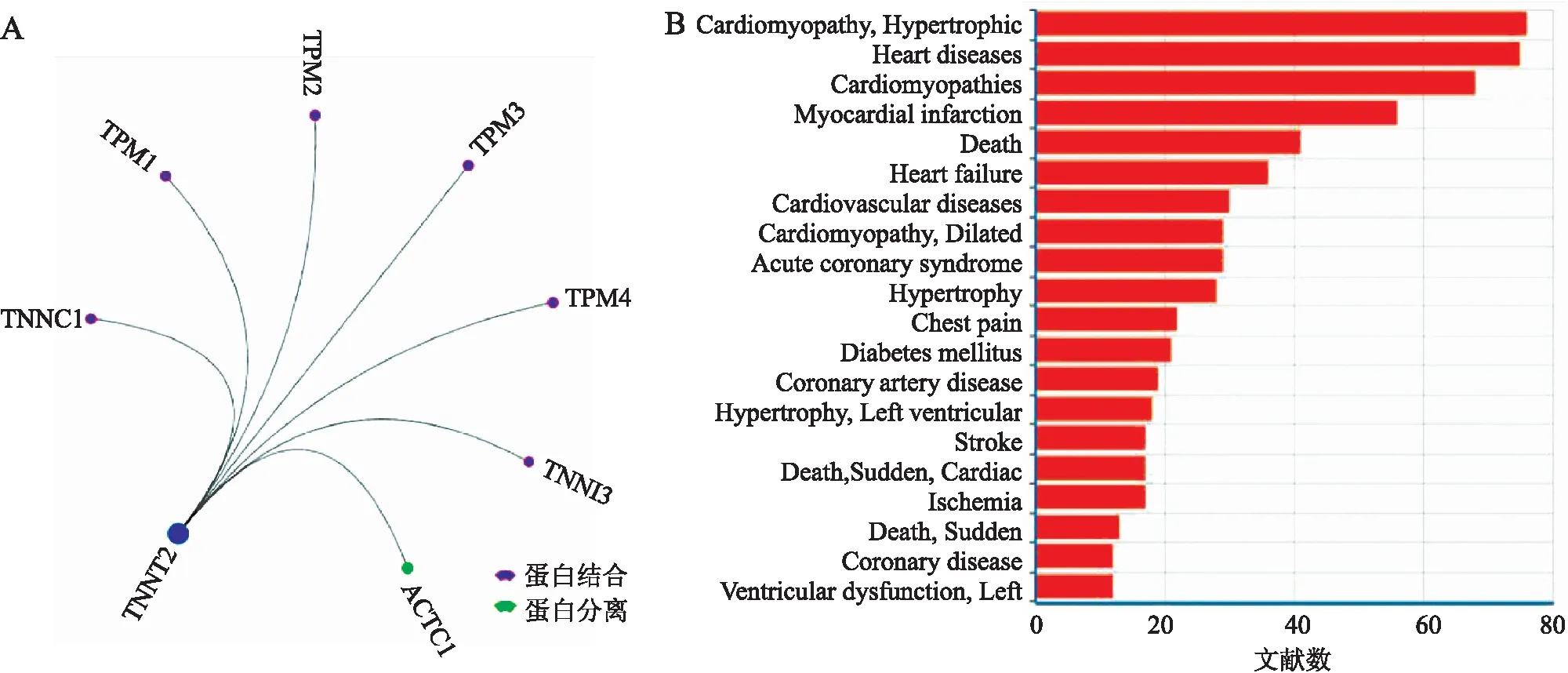
图3 TNNT2基因雷达调控网络(A)及其相关疾病谱(B)
Fig.3 Regulation networks revealed by GCBI gene radar (A) and related diseases (B) of TNNT2

图4 DKD患者与健康对照组肾小球差异表达基因涉及信号通路共表达网络(蓝色为上调,黄色为既有下调又有上调)
Fig.4 The co-expression network of pathways of differentially expressed genes in the glomerulus of DKD patients and controls
2.8 DKD患者与健康对照组差异表达基因共表达网络 在两组研究对象844个差异表达基因中,共有139个基因存在共表达网络,其中90个(64.75%)为下调基因,49个(35.25%)为上调基因。病例组下调最明显的6个差异表达基因为PLCG2、RASGRP3、JAM3、ERBB4、SH3GLB1、KDR,其共表达网络见图5;病例组上调最明显的5个差异表达基因为PDGFRA、CD44、ITGB2、ACTN1、RAC2,其共表达网络见图6。

图5 DKD患者与健康对照组肾小球TOP 6下调差异表达基因共表达网络(红色为下调,蓝色为上调)
Fig.5 The co-expression network of top 6 down-regulated genes in the glomerulus of DKD patients and controls
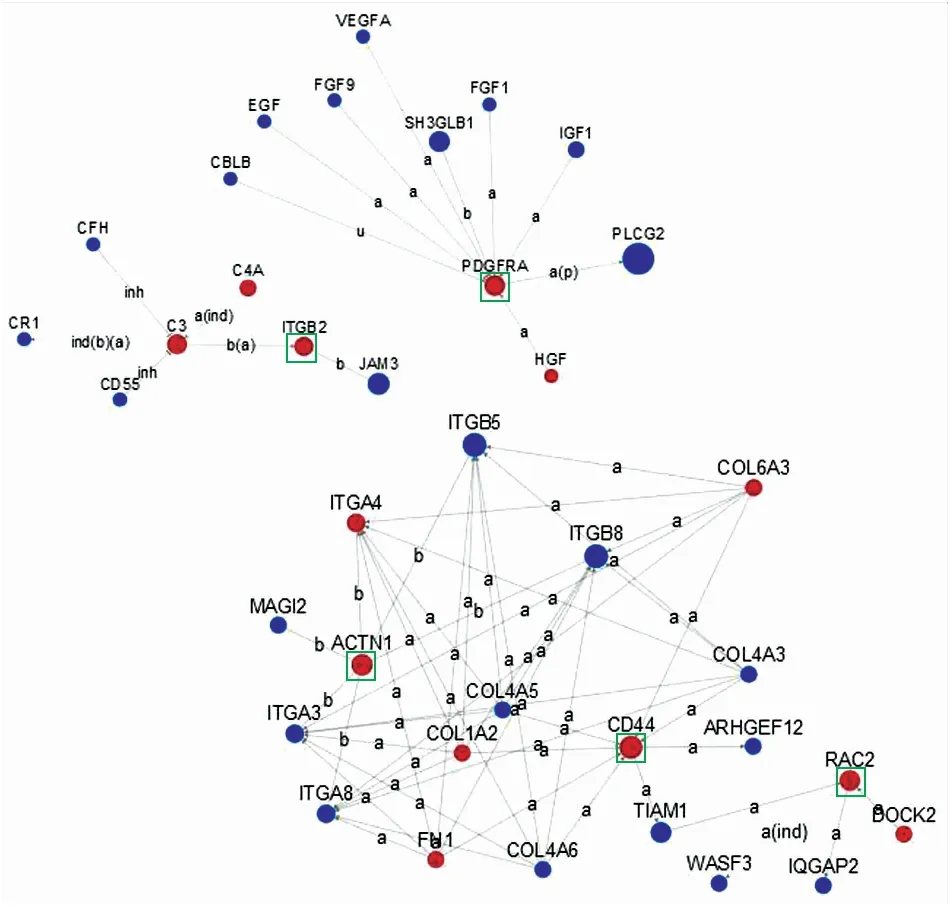
图6 DKD患者与健康对照组肾小球TOP 5上调差异表达基因共表达网络(红色为下调,蓝色为上调)
Fig.6 The co-expression network of top 5 up-regulated genes in the glomerulus of DKD patients and controls
3 讨 论
DKD是指由糖尿病引起的一种严重的肾脏微血管病变,是糖尿病致死的主要原因,其发病率随着糖尿病发病率的升高亦呈现出明显升高趋势[3]。DKD在临床上最初表现为肾小球滤过率的减少,进而出现蛋白尿、动脉血压升高和体液潴留,最终导致肾脏衰竭。
本研究利用基因组学分析技术对DKD患者肾小球组织基因芯片检测数据进行了细致挖掘和分析。基因表达谱提示,与正常人群相比,DKD患者肾小球组织基因表达出现明显改变,共发现844个差异表达基因。两组前20个差异表达基因的蛋白互作网络包含1个典型的子网络,该子网络以TNNT2基因为网络核心。TNNT2基因是肌钙蛋白家族心肌亚型的一种,是调节心脏肌肉收缩的肌钙蛋白复合体组成之一,在心肌细胞收缩和舒张过程中发挥重要作用[4]。以往研究表明,CRP、IL-1、IL-6、IL-18等多种炎症因子和途径都在DKD的发生发展中起重要作用,在DKD患者中表达水平明显升高[5-7];同时,在心肌梗死等心血管疾病患者中,CRP水平也明显升高[8],提示炎症反应是DKD和心血管疾病的共同危险因素。本研究结果表明,在DKD患者中,TNNT2基因表达明显降低,表明DKD患者的心肌细胞收缩和舒张功能有下降趋势。DKD是终末期肾病发生的主要原因,而终末期肾病患者死亡的主要原因是心血管疾病,其比例能占到50%以上[9]。上述分析综合提示,DKD患者通常伴有心脏功能的减弱,TNNT2基因在上述病变过程中可能发挥着关键的调节作用。
GO功能富集分析显示,LPL、PRKAR2B、SERPINE2与应激反应有关。既往研究证实,氧化应激在DKD的发生发展过程中起到关键性的作用,患者机体在高血糖状态下通过多种途径诱导,在肾脏组织中过量生成氧自由基,刺激单核细胞趋化蛋白-1高表达,最终导致肾脏损伤,甚至引起终末期肾衰[10-11]。张志全等[12]的研究结果表明,白藜芦醇可以通过有效改善患者超氧化物歧化酶、谷胱甘肽过氧化物酶等氧化应激指标,起到肾脏修复作用。
差异表达基因信号通路共表达网络发现一个涉及网络关联节点最多的信号通路——MAPK信号通路,此信号通路在基因表达调控过程中发挥关键作用。有研究结果表明,MAPK在DKD患者的肾脏组织中活性明显增强[13-14],这与我们的研究结果完全吻合。
基因共表达网络在病例组筛选出6个明显下调和5个明显上调的差异表达基因。有研究发现,下调基因中的RASGRP3,一种鸟核苷酸交换蛋白,能够有效活化Rap1分子,继而通过ERK信号通路,抑制炎症因子IL-6的产生[15]。这种负向调节IL-6的功能有助于缓解炎症的发生发展,对临床预防和治疗DKD和心血管疾病提供重要参考。
本研究从基因组学的角度,分析了DKD的发生原因及其与心血管疾病发生的关系。结果提示,在高血糖等刺激因素作用下,炎症相关信号通路MAPK等被激活,造成体内氧化应激水平提高和炎症因子的分泌增加。这些因素在导致肾组织损伤的同时,同时引起多种大血管和微血管病变。提示在糖尿病发生的过程中积极控制血糖、控制炎症,可以对DKD和心血管疾病的治疗同时起到积极作用。
[1] GUARIGUTA L, NOLAN T, BEAGLEY J, et al. IDF (International Diabetes Federation) diabetes Atlas, the 6th edition[J]. Int Diabetes Fede, 2013.
[2] SARAN R, LI Y, ROBINSON B, et al. US renal data system 2014 annual data report: Epidemiology of kidney disease in the United States[J]. Am J Kidney Dis, 2015, 66:Svii, S1-305.
[3] PACKHAM DK, ALVES TP, DWYER JP, et al. Relative incidence of ESRD versus cardiovascular mortality in proteinurie type 2 diabetes and nephropathy: Results from the DIAMETRIC (Diabetes Mellitus Treatment for Renal Insufficiency Consortium) database[J]. Am J Kidney Dis, 2012, 59(1):75-83.
[4] TABISH AM, AZZIMATO V, ALEXIADIS A, et al. Genetic epidemiology of titin-truncating variants in the etiology of dilated cardiomyopathy[J]. Biophys Rev, 2017, 9(3):207-223.
[5] DAI YC, YANG SM, WANG X, et al. Antitumor effect and mechanism of action of a tumor-targeting recombinant human tumor necrosis factor-α fusion protein mediated by urokinase[J]. Mol Med Rep, 2015, 11(6):4333-4340.
[6] LIU C, KANAMARU Y, WATANABE T, et al. Targeted IgA Fc receptor I (FcαRI) therapy in the early intervention and treatment of pristane-induced lupus nephritis in mice[J]. Clin Exp Immunol, 2015, 181(3):407-416.
[7] 沈琪,薛冰,丁东新,等. 老年糖尿病肾病与炎性因子的关系[J]. 河北医药, 2014, 5(8):1135-1137.
[8] 江荣,赵胜,李梅,等. 小儿先天性心脏病介入治疗后心肌损伤和炎症反应的研究[J]. 中国当代儿科杂志, 2012, 14(6):422-425.
[9] PANG P, JIN X, PROCTOR BM, et al. RGS4 inhibits angiotensin II signaling and macrophage localization during renal reperfusion injury independent of vasospasm[J]. Kidney Int, 2015, 87(4):771-783.
[10] TURGUT F, BOLTON WK. Potential new therapeutic agents for diabetic kidney disease[J]. Kidney Dis. 2010, 55(5):928-940.
[11] 周兴建,蒋绿芝. MCP-1与胰岛素抵抗和2型糖尿病的关系[J]. 国际内分泌代谢杂志, 2006, 26(2):99-101.
[12] 张志全,高辉,刘莹男,等. 白藜芦醇对糖尿病肾病大鼠氧化应激反应的影响研究[J]. 黑龙江医药科学, 2015, 38(1):88-90.
[13] JHA JC, BANAL C, CHOW BSM, et al. Diabetes and kidney disease: Role of oxidative stress[J]. Antioxid Redox Signal, 2016, 25(12):657-684.
[14] WANG YQ, FAN CC, CHEN BP, et al. Resistin-like molecule beta (RELM-β) regulates proliferation of human diabetic nephropathy mesangial cells via mitogen-activated protein kinases (MAPK) signaling pathway[J]. Med Sci Monit, 2017, 23:3897-3903.
[15] TANG SQ, CHEN TY, YU Z, et al. RasGRP3 limits Toll-like receptor-triggered inflammatory response in macrophages by activating Rap1 small GTPase[J]. Nat Commun, 2014, 5:4567-4581.
