巨噬细胞移动抑制因子在实验性自身免疫性心肌炎大鼠 心肌中的表达及白藜芦醇的治疗作用
2018-02-27刁佳宇
林 琳,闫 蕊,刘 昕,李 青,刁佳宇,张 明,单 虎,魏 瑾
(西安交通大学第二附属医院:1. 心内科;2. 呼吸科,陕西西安 710004)
心肌炎(myocarditis, MC)是一种以心肌间质广泛炎症细胞浸润为主要特点, 导致青壮年心衰、猝死的常见心血管疾病,过度自身免疫反应是重要的病理机制,部分患者最终可进展为扩张型心肌病[1](dilated cardiomyopathy, DCM)。研究表明,大量巨噬细胞浸润及活化促进心肌炎的发生与发展。巨噬细胞移动抑制因子(macrophage migration inhibitory factor, MIF)最初被认为是一种来源于迟发型超敏反应过程中活化的T细胞,进化上相对保守的促炎因子,并证明其具有调节炎症因子分泌、影响巨噬细胞分化、迁移的作用[2]。MIF已被证明参与脑脊髓炎[3],类风湿关节炎[4]、溃疡性结肠炎等多种急慢性炎症性疾病的病理过程[5]。然而,MIF在自身免疫性心肌炎(experimental autoimmune myocarditis, EAM)中的表达及作用鲜有报道。
白藜芦醇( resveratrol)是具有调节免疫、抗炎等多种功效的植物抗毒素,目前仅有少量研究报道其对自身免疫性心肌炎具有一定的治疗作用[6]。本研究检测了白藜芦醇对实验性自身免疫性心肌炎大鼠心肌组织中MIF蛋白的表达变化,并观察了其对心肌病理损伤、巨噬细胞浸润及心脏功能的影响。从而,进一步探讨白藜芦醇是否通过调节MIF表达及相关功能发挥心肌保护作用,以期为治疗心肌炎提供新的理论基础和实验依据。
1 材料与方法
1.1 实验动物及主要试剂 雄性Lewis大鼠24只,6周龄,体质量180~210 g,购自北京维通利华实验动物技术有限公司;室温饲养于SPF级动物房,给予普通饲料喂养,自由饮水。MIF多克隆抗体购自于武汉三鹰生物科技公司;CD68单克隆抗体购自于美国Abcam生物科技公司;β-actin多克隆抗体购自美国CST公司;HRP标记的抗兔二抗购自西安壮志生物科技有限公司;免疫组化试剂盒购自北京中杉金桥生物技术有限公司。
1.2 动物分组及建模 24只实验大鼠采用随机数字法分为对照组(Con组,n=8)、模型组(MC组,n=8)、白藜芦醇干预组(MC+Res组,n=8)。将猪心肌球蛋白和等量弗氏完全佐剂混合,采用注射器对推法制备均一乳浊液。MC组及MC+Res组分别在第0、7天,以0.2 mL猪心肌肌球蛋白免疫乳液于大鼠后肢足垫处注射进行免疫造模;MC+Res组于第0天,免疫后即开始给予白藜芦醇[溶解于羧甲基纤维素钠,sodium carboxymethylcellulose, CMC-Na,50 mg/(kg·d)]灌胃治疗,连续21 d。同时,在Con组大鼠后肢足垫处进行等量完全弗氏佐剂注射,并每日给与等体积CMC-Na灌胃;实验所用大鼠经伦理委员会批准使用,操作过程尽量减少实验动物的痛苦,所有实验过程均遵循西安交通大学实验动物管理与使用条例。
1.3 超声心动图检测 按100 g/L水合氯醛(0.3 mL/100 g)腹腔注射麻醉大鼠,麻醉后应用超声心动图检测仪器(Philips iE33)记录心率(heart rate, HR)、左心室射血分数(left ventricular ejection fraction, LVEF)、左室短轴缩短率(left ventricular short axis reduced rate, LVFS)、左室舒张末期内径(left ventricular end-diastolic diameter, LVEDd)和左室收缩末期内径(left ventricular-systolic diameter, LVEDs)。
1.4 苏木素-伊红染色 快速切取大鼠心脏,称取心脏质量。用于病理组织切片的标本浸泡于100 mL/L中性甲醛溶液,24 h后常规包埋,切片厚约4 μm,常规脱蜡至水,进行苏木素-伊红(haematoxylin and eosin, HE)染色。依据显微镜下观测并进行评分:0分:没有炎症;1分:每个视野下1~5个炎症细胞浸润灶且炎症浸润范围小于整个视野的5%;2分:每个视野多于5个炎症细胞浸润灶或者炎症范围大于5%但小于20%;3分:弥漫性炎症细胞浸润,范围超过20%,但没有坏死;4分:弥漫性炎症细胞浸润伴随心肌细胞坏死。每只心脏至少取3个横切面,每组内选取8只大鼠心肌切片染色进行统计分析。
1.5 Western blot法检测大鼠心肌组织MIF蛋白的表达 将50 mg组织研磨并裂解于1 000 μL RIPA裂解液(碧云天生物科技有限公司)中,按说明书步骤提取心肌匀浆蛋白,保存于-80 ℃冰箱。提取的蛋白用BCA蛋白定量试剂盒进行定量。同质量上样后以60 g/L SDS-PAGE胶进行分离,转膜至0.22 μm PVDF膜上,用50 g/L脱脂奶粉与PBST配制的封闭液封闭1 h,以MIF抗体稀释液(1∶800,ProteinTech Group, USA),或GAPDH(1∶1 000,CST,USA)在4 ℃冰箱孵育过夜,HRP标记的抗兔二抗(1∶2 000,西安壮志生物科技有限公司,西安)室温孵育1.5 h,ECL化学发光后进行曝光、显影。采用Quantity One软件进行分析。
1.6 免疫组化法检测巨噬细胞表面标记分子CD68的表达 按常规ABC法进行免疫组化检测。实验中采用磷酸盐缓冲液(PBS)代替一抗作为空白对照,在切片上滴加CD68(1∶1 000,abcam, USA)一抗稀释液,二抗结合并室温孵育1 h,洗涤后滴加DAB显色液,脱水透明,中性树胶封片,细胞质棕黄色为阳性染色细胞。进行CD68阳性细胞计数:Olympus摄影显微镜技术心肌组织CD68阳性细胞,取其均值进行统计学分析。
2 结 果
2.1 各组大鼠一般状况比较 第21天,MC组大鼠死亡1只,其余各组大鼠均无死亡。Con组大鼠毛发光亮,精神状态及活动无明显异常;MC组大鼠安静状态即出现气短、易激惹,活动减少,伴有精神不振及毛色粗糙暗淡;MC+Res组大鼠一般状况较MC组明显改善。
2.2 各组大鼠心脏超声心动图检查及心脏肉眼观察结果 与Con组相比较,各组大鼠LVEDd之间无显著差异;MC组大鼠心脏体质量比(P=0.003 4)、心率(P=0.004 1)、LVEDs (P=0.003 2)均较Con组显著增加,而LVEF(P=0.005 8)、LVFS(P=0.007 3)明显降低。与MC组比较,MC+Res组大鼠心脏LVEDs(P=0.028)、心率(P=0.031)显著降低,而LVEF(P=0.040)、LVFS(P=0.046)均较MC组显著增加,差异具有统计学意义(图1)。

图1 各组大鼠心脏结构及功能的变化
Fig.1 The cardiac structure and functional changes of rats by echocardiography
A:左室收缩末内径(LVEDs);B:左室舒张末内径(LVEDd);C:心率(heart rate);D:左室短轴缩短率(LVFS);E:左室射血分数(LVEF);F:心脏体质量比(HW/BW)。与对照组比较:**P<0.01;与模型组比较:#P<0.05。
超声心动图检查结束后迅速打开胸腔,肉眼可见Con大鼠心脏均无明显胸腔积液,心脏表面及形态未见明显异常;MC组6/7只出现大量胸腔积液,肉眼可见心脏体积增大,表面灰白、僵硬,局部心肌组织明显水肿,颜色变暗;MC+Res组2/8只出现少量胸腔积液,心脏肉眼病变较MC组大鼠明显减轻。
2.3 各组大鼠心肌组织HE染色结果 与Con组比较,MC组大鼠心肌细胞排列紊乱,肌丝断裂,边界不清,部分心肌细胞溶解,心肌组织可见大面积炎症细胞浸润。病理评分提示,MC+Res组大鼠心肌组织中炎症细胞浸润程度相较于MC组显著减少(P=0.037),心肌损伤明显减轻(图2)。
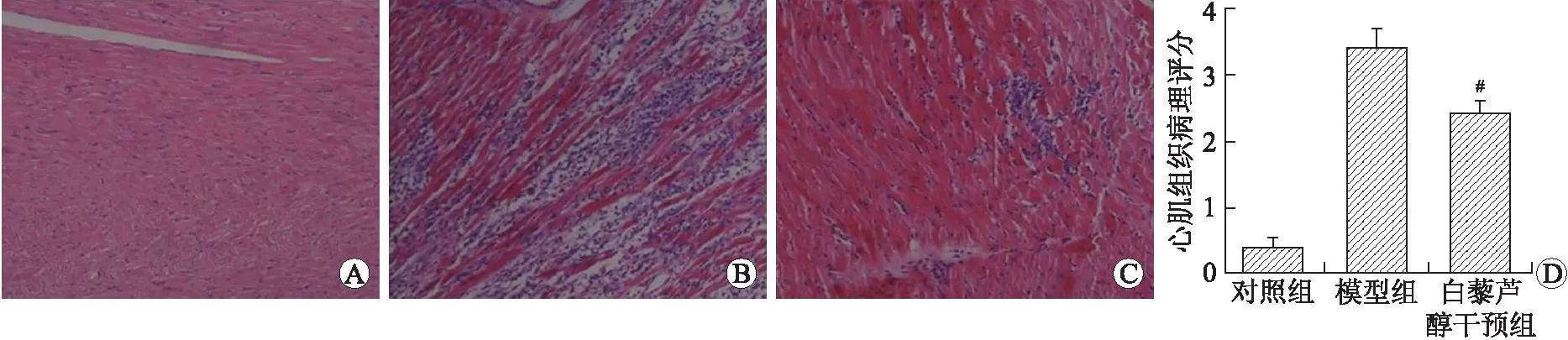
图2 各组大鼠心肌组织病理损伤及炎症细胞浸润程度的变化
Fig.2 Histopathological changes and degree of inflammatory cell infiltration in the myocardium of rats (×100)
A:对照组;B:模型组;C:白藜芦醇干预组;D:心肌组织病理评分统计分析;与模型组比较:#P<0.05。
2.4 各组大鼠心肌组织中CD68免疫组化结果 棕色颗粒主要存在于细胞质部位,CD68阳性者标记为巨噬细胞。Con组大鼠心肌组织中仅有数个CD68阳性细胞[(1.5±0.24)个/视野],MC组大鼠心肌组织中CD68阳性细胞数较Con组显著增加[(34±6.2)个/视野,P=0.000 59];与MC组相比,MC+Res组大鼠心肌组织中CD68阳性细胞浸润程度显著减轻[(14±3.8)个/视野,P=0.028],差异均具有统计学意义(图3)。
2.5 各组大鼠心肌组织MIF蛋白Western blot检测结果 采用Western blot进一步明确MIF在各组心肌组织中的蛋白表达:MC组大鼠心肌组织中MIF蛋白较Con组显著增加(P=0.006 8),MC+Res组中MIF蛋白表达较MC组显著降低(P=0.029),差异具有统计学意义。因此,白藜芦醇可降低EAM大鼠心肌组织中MIF的表达(图4)。

图3 各组大鼠心肌组织巨噬细胞表面标记分子CD68的表达变化
Fig.3 The expression of CD68 in the myocardium of rats (×200)
深棕黄色为CD68表达阳性细胞;A:对照组;B:模型组;C:白藜芦醇干预组;D:CD68阳性细胞数统计分析;与对照组比较:***P<0.001;与模型组比较:#P<0.05。
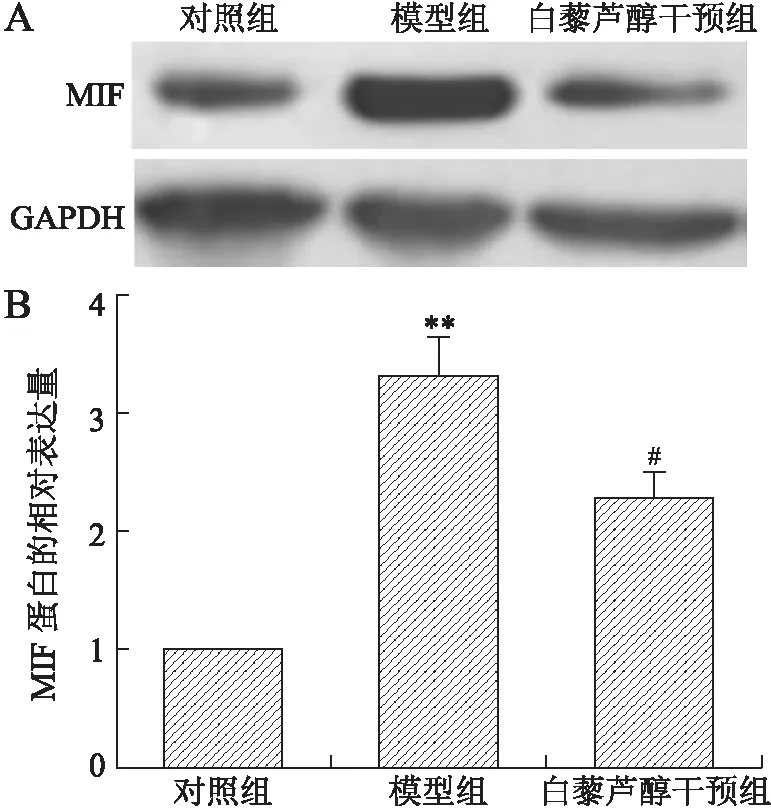
图4 各组大鼠心肌组织中MIF蛋白的表达
Fig.4 Expression of MIF in the myocardium of rats
A:各组大鼠心肌中MIF蛋白条带;B:Western blot条带灰度值统计分析;与对照组比较:**P<0.01;与模型组比较:#P<0.05。
3 讨 论
白藜芦醇作为一种天然植物抗毒素,广泛存在于花生、红葡萄和浆果类等植物果实中,具有抗氧化、抗炎、调节免疫、舒张血管、防止心肌纤维化等多种功效[7];YOSHIDA等[8]以及本课题组前期研究表明,白藜芦醇对EAM有明显的治疗作用。本研究以猪心肌肌球蛋白免疫Lewis大鼠成功建立自身免疫性心肌炎模型,并给予白藜芦醇灌胃治疗。结果初步证明MIF在EAM大鼠心肌组织中高表达,白藜芦醇干预能够明显降低MIF的表达,并且减少与其相关的巨噬细胞在心肌组织中的浸润,并进一步减轻EAM大鼠心肌病理损伤,缓解EAM大鼠心功能障碍。
巨噬细胞因其具有分泌多种免疫调节因子和促炎因子的功能在固有免疫应答中发挥着重要的作用。同时,巨噬细胞的过度激活与败血症、自身免疫性疾病及肉芽肿形成和发生有关[9]。在病毒性心肌炎实验研究中发现,巨噬细胞的浸润及分型、与之相关的不同炎症因子分泌决定了不同性别小鼠心肌组织炎症程度的差异[10];另外,在自身免疫性心肌炎大鼠心肌中,巨噬细胞占到浸润炎症细胞总数的70%以上[11],参与EAM的发病。GÖSER等[12]在自身免疫性心肌炎动物模型的心肌组织中,通过阻断MCP-1及MIP-1α能够明显减少巨噬细胞浸润,有效缓解疾病的严重程度;与上述研究一致,我们以CD68标记巨噬细胞,通过用免疫组化方法检测到在免疫后第21天,EAM大鼠心肌组织中有大量巨噬细胞浸润,并伴有严重心肌损伤和心功能障碍。MIF作为巨噬细胞分泌的主要炎症因子,不仅可以调节T细胞活化与增殖,而且具有抑制巨噬细胞自由迁移的作用。MIF可以通过抑制P53表达减少凋亡,维持巨噬细胞活力以及促炎功能[13]。相反,BERNHAGEN等[14]用中和抗体阻断MIF的受体CXCR2能减少T细胞和巨噬细胞的浸润,并减缓动脉粥样硬化的进展;同样地,MATSUI等[15]证明抑制MIF可减少VCAM-1、TNF-α、IL-1β的产生,并且减少了活化T细胞与巨噬细胞的迁移。同时,巨噬细胞分泌的TNF-α、IL-1β等炎症因子,能进一步造成心肌细胞损伤、坏死、心肌纤维化等,与大鼠发生心衰甚至进展为DCM密切相关[16]。因此,我们推测,白藜芦醇可能通过降低MIF表达及与其相关的巨噬细胞浸润,进而对EAM大鼠心肌发挥治疗作用。
综上所述,白藜芦醇能够在一定程度上缓解EAM,可能与降低MIF的表达,进一步减少心肌组织中巨噬细胞浸润,同时抑制巨噬细胞的促炎功能有关。尽管本研究证实了白藜芦醇能降低MIF的表达,减少巨噬细胞浸润,但MIF调节巨噬细胞以及相关炎症应答的具体机制尚待明确。本研究有助于完善EAM的发病机制,为进一步寻找心肌炎的临床治疗策略提供理论基础。
[1] DINY NL, BALDEVIANO GC, TALOR MV, et al. Eosinophil-derived IL-4 drives progression of myocarditis to inflammatory dilated cardiomyopathy[J]. J Exp Med, 2017, 214(4):943.
[2] TISTAM PV, QI D, LIN L, et al. MIF family cytokines in cardiovascular diseases and prospects for precision-based therapeutics[J]. Exp Opin Ther Tar, 2017, 21(7):671.
[3] MEZAROMERO R, BENEDEK G, YU X, et al. HLA-DRα1 constructs block CD74 expression and MIF effects in experimental autoimmune encephalomyelitis[J]. J Immunol, 2014, 192(9):4164.
[4] BDALLAH AM, Al-MAZROEA AH, AL-HARBI WN, et al. Impact of MIF gene promoter variations on risk of rheumatic heart disease and its age of onset in Saudi Arabian patients[J]. Front Immunol, 2016, 7(15-16).
[5] TRIPATHI, MANISH, ASATI, et al. P-157 YI elevated macrophage migration inhibitory factor sera level in ulcerative colitis patients[J]. Inflamm Bowel Dis, 2016, 22: S57.
[6] HAO E, LANG F, CHEN Y, et al. Resveratrol alleviates endotoxin-induced myocardial toxicity via the Nrf2 transcription factor[J]. PLoS One, 2013, 8(7):e69452.
[7] PARK EJ, PEZZUTO JM. The pharmacology of resveratrol in animals and humans[J]. BBA-Mol Basis Dis, 2015, 1852(6):1071-1113.
[8] YOSHIDA Y, SHIOI T, IZUMI T. Resveratrol ameliorates experimental autoimmune myocarditis[J]. Circ J, 2007, 71(3):397-404.
[9] NAVEGANTES KC, GOMES RS, CZAIKOSKI PG, et al. Immune modulation of some autoimmune diseases: The critical role of macrophages and neutrophils in the innate and adaptive immunity[J]. J Trans Med, 2017, 15(1):36.
[10] KANG L, WEI X, QIANG G, et al. Differential macrophage polarization in male and female BALB/c mice infected with coxsackievirus B3 defines susceptibility to viral myocarditis[J]. Circ Res, 2009, 105(4):353-364.
[11] PUMMERER C, BERGER P, FRUHWIRTH M, et al. Cellular infiltrate, major histocompatibility antigen expression and immunopathogenic mechanisms in cardiac myosin-induced myocarditis[J]. Lab Invest, 1991, 65(5):538-547.
[12] GÖSER S, ÖTTL R, BRODENR A, et al. Critical role for monocyte chemoattractant protein-1 and macrophage inflammatory protein-1α in induction of experimental autoimmune myocarditis and effective anti-monocyte chemoattractant protein-1 gene therapy[J]. Circulation, 2005, 112(22): 3400-3407.
[13] BROCK SE, RENDON BE, XIN D, et al. MIF Family members cooperatively inhibit P53 expression and activity[J]. PLoS One, 2014, 9(6): e99795.
[14] BERNHAGEN J, KROHN R, LUE H, et al. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment[J]. Nat Med, 2007, 13(5):587-596.
[15] MATSUI Y, OKAMOTO H, JIA N, et al. Blockade of macrophage migration inhibitory factor ameliorates experimental autoimmune myocarditis[J]. J Mol Cell Cardio, 2004, 37(2):557-566.
[16] ESKANDARI V, AMIIRZARGAR AA, MAHMOUDI MJ, et al. Gene expression and levels of IL-6 and TNFα in PBMCs correlate with severity and functional class in patients with chronic heart failure[J]. Iri J Med Sci, 2017, (13):1-10.
