子宫内膜癌干细胞分化过程中microRNA表达谱的 鉴定及分析
2018-02-27黄康榕王月玲柏海燕杨新园
王 伟,王 臻,黄康榕,王月玲,柏海燕,杨新园
(1. 西安交通大学第一附属医院麻醉科,陕西西安 710061;2. 陕西省妇幼保健院,陕西西安 710003; 3. 西安交通大学第一附属医院妇产科,陕西西安 710061)
子宫内膜癌(endometrial cancer, EC)是最常见的妇科恶性肿瘤之一。由于肥胖、生活方式改变、女性平均寿命延长及雌激素滥用等因素影响,EC的发病率逐年上升,并呈年轻化趋势[1-2]。目前认为肿瘤组织由3种细胞成分构成:具有无限增殖能力并可形成新的肿瘤克隆的肿瘤干细胞(cancer stem cells, CSC)、可有限增殖但不能形成新的肿瘤克隆的肿瘤细胞及上述两种能力都丧失的肿瘤细胞,其中只有肿瘤干细胞才是肿瘤发生的初始驱动细胞,肿瘤的转移也是肿瘤干细胞选择适宜组织器官“定位”的过程。在EC中也已证实子宫内膜癌干细胞(endometrial cancer stem cells, ECSCs)的存在[3],CD133是最先用于分离ECSCs的标志物[4]。此外,ECSCs高表达Musashi-1和Nanog基因[5],也有学者应用细胞生物学特性(如侧群细胞法)对其进行分离鉴定。ECSCs在EC的发生、发展和转移过程中发挥关键性作用。对EC干细胞的特性研究显示,ECSCs具有明显的耐化疗性和耐放疗性,是导致EC治疗失败及复发的主要因素[6-7]。因而,探索EC干细胞的生物学特性对于从根本上抑制EC的发生、转移及复发,改善患者预后具有重大意义。
microRNAs(miRNAs)是一类大小为20~25个碱基的内源性非编码RNA分子,具有调节基因表达活性的功能。miRNAs与肿瘤干细胞关系密切,可通过调节其蛋白、相关基因及信号转导通路,在肿瘤的发生、发展和转移过程中发挥重要作用。如miR-302抑制细胞周期蛋白E-CDK2、D-CDK4/6通路,加强G1期阻滞通路,导致干细胞致瘤性降低;miRNA-199b-5p作用于Notch信号通路而调控CSC的自我更新能力;let-7负调控下游靶基因H-RAS,抑制CSC的自我更新;miRNA-135a过表达促进CSC自我更新导致肿瘤转移[8-10]。但迄今为止,ECSCs相关miRNAs研究甚少,已有研究报道,micRNA-101通过作用于靶基因EZH2、MCL-1和FOS,抑制EC细胞增殖、侵袭能力及干细胞表型[11];miRNA-134在EC干细胞和癌细胞之间存在显著差异,通过抑制POGLUT1蛋白表达进而抑制EC干细胞的增殖和迁移[12]。但在EC干细胞分化过程中有哪些miRNAs起到关键性作用尚不明确。本研究通过无血清悬浮培养法富集EC干细胞,筛选EC干细胞分化过程中差异表达的miRNAs,为深入探讨EC干细胞的分化机制提供新的线索。
1 材料与方法
1.1 细胞株及试剂 子宫内膜癌HEC-1-B细胞购自上海江林生物有限公司。DMEM-F12培养基(Gibco, USA)、胎牛血清(Hyclone, USA)、表皮细胞生长因子(epidermal growth factor, EGF, Peprotech, Rocky Hill, NJ, USA)、胰岛素转铁蛋白硒(insulin transferrin selenium, ITS, Gibco, NY, USA)、成纤维细胞生长因子(basic fibroblast growth factor, bFGF, Peprotech, Rocky Hill, NJ, USA)、0.5 g/L及2.5 g/L胰蛋白酶/EDTA(Sigma, USA)、Anti-CD133-PE(Miltenyi Bio, Germany)、Trizol Reagent(Invitrogen, USA)、反转录试剂盒及PCR试剂盒(TaKaRa, Japan)。
1.2 细胞培养 富集肿瘤干细胞:取对数生长期的HEC-1-B细胞,以5.0×105/mL的密度接种于100 mm培养皿中,待贴壁后换液为无血清培养基,即DMEM/F12含10 ng/mL EGF、20 ng/mL bFGF和10 g/L ITS,在37 ℃、50 mL/L CO2饱和湿度条件下进行培养。每2~3 d换液1次,当逐渐形成较大的肿瘤球后,经滤网过滤收集细胞球用于后续实验。
肿瘤干细胞的分化:将富集到的细胞球,重悬于含100 mL/L胎牛血清的DMEM/F12培养基中,在37 ℃、50 mL/L CO2饱和湿度条件下进行培养,每2~3 d 换液。
1.3 细胞表型分析 将富集的EC干细胞,用0.5 g/L胰酶-EDTA消化为单细胞悬液后调整细胞密度至1.0×107/mL,300 μL缓冲液重悬细胞,分别加入CD133-PE及FcR Blocking阻断剂,lgG-PE抗体做为阴性对照,4 ℃避光孵育30 min,适量缓冲液重悬后流式细胞仪检测细胞表型。
1.4 Western blot检测 检测ECSCs及其分化第10天的细胞干性相关基因的蛋白表达。提取细胞总蛋白,取40 μg蛋白上样于100 g/L的SDS-PAGE胶,分离之后转膜于PVDF膜,50 g/L脱脂牛奶封闭,分别加入兔抗人Oct 4、Sox2单克隆一抗(1∶1 000),4 ℃ 孵育过夜,TBST洗涤后,加入山羊抗兔lgG-HRP二抗室温孵育1 h。ECL显色,用成像系统扫描并分析。β-actin作为内参照。
1.5 miRNA芯片杂交及数据分析 样品使用Affymetrix公司开发的 GeneChip®miRNA 4.0 Array进行处理分析。比较ECSCs及其分化细胞间差异表达的microRNAs。miRNA芯片的杂交、扫描与数据分析均由上海吉凯基因化学技术有限公司技术服务部完成。
1.6 RT-qPCR检测 用RNA提取试剂盒提取EC干细胞及其分化细胞的总RNA,用逆转录酶试剂盒转录成cDNA,取2 μL为PCR扩增模板。用SYBR Green PCR Master Mix在PCR仪定量分析。用GAPDH进行归一化处理。
1.7 生物信息学分析 依据Fold Change值、P值及ForeGround值选择有显著性差异表达的miRNAs,应用Targetscan、miRTarBase及miRanda数据库进行生物信息学分析,预测差异表达的miRNAs的靶基因。
1.8 检测差异表达的基因 采用Affymetrix基因表达谱芯片寻找ECSCs及其分化细胞间的差异基因,基因芯片的杂交、扫描与数据分析均由上海吉凯基因化学技术有限公司技术服务部完成。

2 结 果
2.1 ECSCs的富集和分化 HEC-1-B细胞传代贴壁后更换为无血清培养液,除少数细胞继续存活生长外,大部分细胞逐渐凋亡。培养48 h后细胞形成由几个到十几个细胞组成的微球,这种细胞球体积小,结构松散,形态不规则(图1A)。此后细胞球缓慢增大,经过10~12 d的培养,形成数百个细胞组成的肿瘤球,细胞间连接紧密,难以区分细胞间的界限,呈圆形或椭圆形(图1B)。
将肿瘤球用含血清的培养基培养,可重新贴壁生长,肿瘤球边缘最先贴壁,细胞呈单层逐渐铺开,细胞大小均匀,扁平规则,细胞边界清楚,折光性好,细胞间连接紧密,排列规则(图1C)。
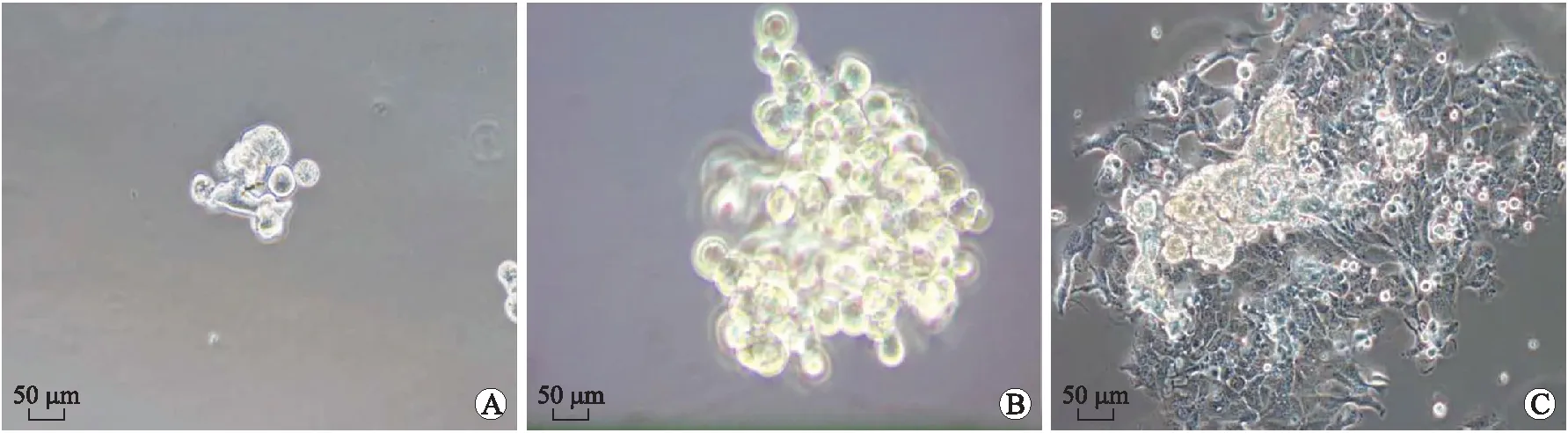
图1 富集子宫内膜癌干细胞及其分化培养
Fig.1 The tumorsphere formation from HEC-1-B cells and ECSCs’ differentiation
A:初期培养的肿瘤球;B:培养10 d的肿瘤球;C:分化3 d的ECSCs。
2.2 ECSCs鉴定 流式细胞仪检测肿瘤球特异性表面分子CD133的表达,结果显示CD133的表达为(97.0±2.5)%(图2A、B)。Western blot检测肿瘤球及其分化第10天的细胞中Sox2和Oct4的表达水平,结果显示肿瘤球中Sox2和Oct4的表达水平明显高于其分化细胞,并随着分化时间的延长逐渐下降(图2C)。
2.3 miRNA芯片检测结果 ECSCs与其分化细胞间有57个miRNAs的表达存在差异,其中差异倍数大于2的miRNAs共有11个,10个在ECSCs中高表达,包括miR-522、miR-139-3p、miR-520c-5p、miR-518d-5p、miR-146b-5p、miR-34a、miR-526a、miR-193a-3p、miR-221、miR-4674;1个miRNA(即miR-760)在ECSCs中低表达(图3)。

图2 子宫内膜癌干细胞的鉴定
Fig.2 Identification of ECSCs
A、B:流式细胞仪检测肿瘤球CD133的表达;C:Western blot检测肿瘤球及其分化细胞Sox2和Oct4的表达水平。
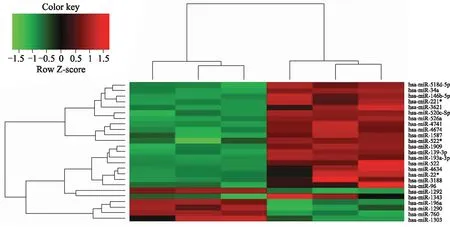
图3 miRNA聚类分析图
Fig.3 Hierachical clustering analysis of miRNA expression profile
绿色代表miRNA表达下调,红色代表miRNA表达上调。
2.4 RT-qPCR验证miRNA芯片结果 对有显著差异的11个miRNAs进行RT-qPCR验证,其中miR-522、miR-139-3p、miR-520c-5p、miR-518d-5p、miR-146b-5p、miR-34a、miR-193a-3p、miR-221、miR-760的表达情况与芯片检测结果一致,miR-526a、miR-4674的表达与芯片检测结果不一致(图4)。
2.5 差异表达的miRNAs生物信息学分析 为提高预测的特异性,采用Targetscan、miRTarBase及miRanda在线数据库对差异表达的miRNAs的靶基因进行预测。 结果显示,3个数据库的交集中差异表达的miRNAs均可预测到靶基因。
2.6 基因芯片结果 基因芯片检测结果显示,在ECSCs与其分化细胞间有1 766个差异表达的基因。共445个基因有显著性差异(差异倍数>2,P<0.05),其中207个在ECSCs中高表达,238个在ECSCs中低表达(图5)。
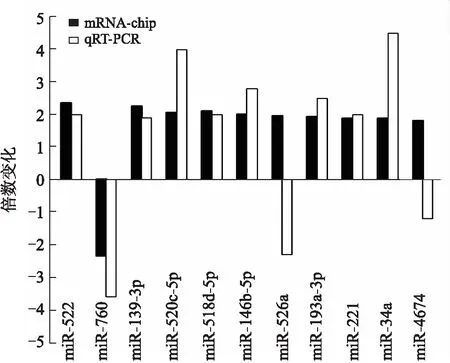
图4 miRNAs在RT-qPCR和miRNA芯片的表达差异倍数
Fig.4 RT-qPCR analyses validated the miRNA microarray results
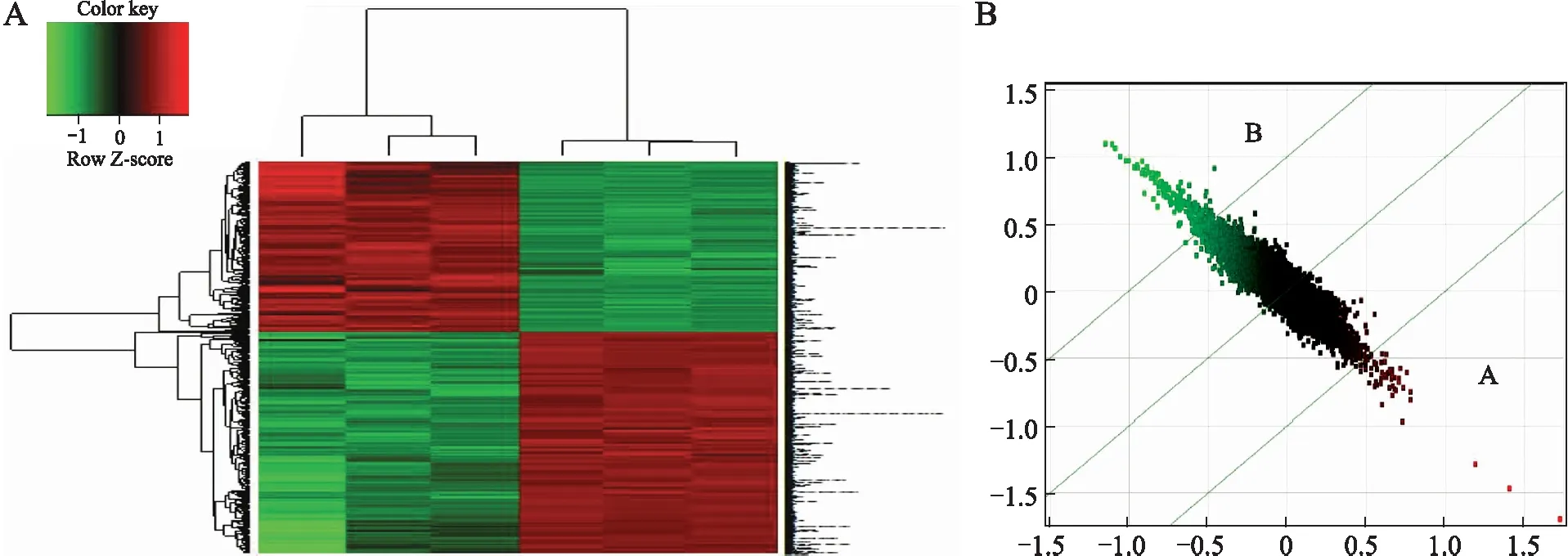
图5 差异基因聚类分析图和散点图
Fig.5 Analysis of differential gene expressions
A:差异基因聚类分析图;B:差异基因散点图。
2.7 数据综合分析 将预测的miRNAs靶基因与差异基因表达谱进行综合分析,结果显示除miR-139-3p外,预测的miRNAs靶基因与差异基因表达谱有交集(表1)。
表1 miRNAs的预测靶基因与差异基因表达谱综合分析
Tab.1 Analysis of the predicted target genes of miRNAs and gene expressions

差异表达miRNAs预测的靶基因与差异基因表达谱有交集的基因miR-522FANCD2,IL1RAP,C10orf118,MLL3,BRCA1,ELAVL1,SLC12A6,SYNC,TBC1D8,ANO1,CLVS1,WDR26,DYRK2,RTKN2,ETV1,MED13LmiR-518d-5pEWSR1,CYLD,ZSWIM6,ZFYVE1,ZFP36L1miR-520c-5pEWSR1,CYLD,ZSWIM6,ZFYVE1,ZFP36L1miR-146b-5pTDRKH,HNRNPD,ESYT2,PCDH1,C4orf3miR-760ZSW,IM6,SHMT2,TNIP1,HOXA2,LEPREL1,LMNB2,EPB41,SHCBP1,AP4E1miR-193a-3pNT5E,SOS2,LAMC2,MCL1,PLAU,STMN1miR-221-5pC8orf58,MEX3B,ASPH,SLC7A6,ARMCX3,PRNP,INSIG2,SLC41A2,SUV39H1,JAK2,SEPSECS,AK2,CEACAM1,B4GALT5,CHD2,PRICKLE1,TMEM201,CDCA5,SDC4,TMEM92,ZKSCAN1,MRPL35,SMG5,RRAGD,BCL2L13,TEP1,IRAK2,UBIAD1miR-34aRGS17,ACSL4,CDKN1C,KIAA1217,NOTCH1,TP53INP2,CPD,CCNE2,COL12A1,PTPRD,FRMD4AmiR-526aEWSR1,CYLD,ZSWIM6,ZFYVE1,ZFP36L1miR-4674NGEF
3 讨 论
EC干细胞具有自我更新的能力和高致瘤性,与肿瘤的发生、侵袭转移等生物学行为有着密切关系,了解ECSCs的生物学特性并设法杀死肿瘤干细胞是目前研究的焦点问题。DONTU等[13]采用无血清悬浮培养的方式富集乳腺癌干细胞,该方法在许多肿瘤细胞系中均可培养出肿瘤干细胞球,本研究采用同样的方法成功富集了EC干细胞。使细胞适应无血清环境有2种方法:一种是将细胞直接从添加血清的培养基转至无血清培养基中直接适应,另一种是梯级降低血清浓度直至无血清培养,后者是较为符合细胞生理条件的方法。但本实验在需要保持肿瘤干细胞干性同时又必须增加肿瘤干细胞数量用于下一步实验,因此,采用直接适应的方法以较高细胞密度接种至细胞培养皿中换液为无血清培养基培养。在富集ECSCs的过程中,如何使细胞适应无血清培养基,同时避免肿瘤干细胞丧失干性并发生分化是本研究关注的重点。本研究使用添加了生长因子的无血清培养基,添加生长因子的质量浓度为10 ng/mL EGF和20 ng/mL bFGF,该浓度对干细胞的促增殖作用最强。ITS包含胰岛素、人转铁蛋白和亚硒酸,10 g/L ITS可促进细胞增殖并减少细胞对血清的需求。应用ECSCs表面标志物CD133,结合干细胞特异性的标志物Sox2和Oct4对富集的肿瘤球进行鉴定,发现肿瘤球中CD133高表达,同时Sox2和Oct4的表达水平随分化时间的延长明显降低,提示富集的肿瘤球没有干细胞表面标志物的丢失,没有发生分化现象,说明无血清悬浮培养法确实可以用于富集ECSCs。
肿瘤干细胞一方面可以自我复制保持“干性”,另一方面也可以分化成肿瘤细胞以促进肿瘤生长。在多种肿瘤中有异常表达的miRNAs,很多miRNAs作为肿瘤标志物或预测因子用于肿瘤诊断和预测肿瘤预后[14-16]。近年的研究多侧重于肿瘤组织中miRNAs的研究[17-19],而肿瘤干细胞分化过程中miRNAs表达谱的研究未见报道。分析肿瘤干细胞分化过程中miRNAs的差异,是深入了解肿瘤干细胞的功能与特性的有效途径。本研究结果显示,ECSCs分化过程中有部分miRNAs发生了显著性变化。有关miRNAs表达谱如何与细胞功能相联系涉及miRNAs表达谱与其靶基因的研究。本研究首先利用Targetscan等数据库对差异表达的miRNAs进行靶基因的预测,但仅通过结合域结构预测的靶基因不一定在细胞内都能常态表达。任何调控因素的变化最终都将反映在调控目标的表达水平的变化上,两方面变化因素缺一不可,即只有miRNAs表达水平的变化而没有目标基因表达水平的变化,无法形成细胞功能的变化;同样,只有目标基因的变化,没有miRNAs的变化,说明可能是miRNAs调控手段以外因素在发挥作用。我们将miRNAs表达谱与基因表达谱结合起来分析研究可去除以上两种情况,将变化有相关性的miRNAs和靶基因筛选出来。在肿瘤干细胞分化过程中异常表达的miRNAs及其靶基因可能在肿瘤干细胞的干性维持及分化中发挥重要作用,但仍需在功能学方面进一步研究,这将为深入了解EC干细胞特性提供新的思路。
[1] SIEGEL R, MA J, ZOU Z, et al. Cancer statistics, 2014, CA[J]. Cancer J Clin, 2014, 64(1):9-29.
[2] SMITH RA, MANASSARAM-BAPTISTE D, BROOKS D, et al. Cancer screening in the United States, 2015: A review of current American cancer society guidelines and current issues in cancer screening[J]. CA Cancer J Clin, 2015, 65(1):30-54.
[4] DING DC, LIU HW, CHANG YH, et al. Expression of CD133 in endometrial cancer cells and its implications[J]. J Cancer, 2017, 8(11):2142-2153.
[5] GÖTTE M, GREVE B, KELSCH R, et al. The adult stem cell marker Musashi-1 modulates endometrial carcinoma cell cycle progression and apoptosis via Notch-1 and p21WAF1/CIP1[J]. Int J Cancer, 2011, 129(8):2042-2049.
[6] MCCONECHY MK, TALHOUK A, LEUNG S. et al. Endometrial carcinomas with POLE exonuclease domain mutations have a favorable prognosis[J]. Clin Cancer Res, 2016, 22(12):2865-2873.
[7] 邹雅婷,陈勍. 肿瘤干细胞与子宫内膜癌的关系研究进展[J]. 国际妇产科学杂志, 2017, 44(1):35-39.
[8] 程文,高建平,张征宇. 微小RNA与肿瘤相关性研究[J]. 医学研究生学报, 2011, 24(2):203-205.
[9] 宓林,于晓峰,邹健. 微小RNA对肿瘤干细胞的调控机制[J]. 国际消化病杂志, 2011, 31(3):163-165.
[10] 潘运宝,杨惠玲. miRNA与肿瘤干细胞的研究进展[J]. 国际内科学杂志, 2009, 36(9):548-550.
[11] KONNO Y, DONG P, XIONG Y. MicroRNA-101 targets EZH2, MCL-1 and FOS to suppress proliferation, invasion and stem cell-like phenotype of aggressive endometrial cancer cells[J]. Oncotarget, 2014, 5(15):6049-6062.
[12] GAO Y, LIU T, HUANG Y. MicroRNA-134 suppresses endometrial cancer stem cells by targeting POGLUT1 and Notch pathway proteins[J]. FEBS Lett, 2015, 589(2):207-214.
[13] DONTU G, Al-HAJJ M, ABDALLAH WM, et al. Stem cells in normal breast development and breast cancer[J]. Cell Prolif, 2003, 36(Suppl 1):59-72.
[14] BRAZA BOILS A, MARI ALEXANDRE J, GILABERT J, et al. MicroRNA expression profile in endometriosis: Its relation to angiogenesis and fibrinolytic factors[J]. Hum Reprod, 2014, 29(5):978-988.
[15] DEVOR EJ, HOVEY AM, GOODHEART MJ, et al. microRNA expression profiling of endometrial endometrioid adenocarcinomas and serous adenocarcinomas reveals profiles containing shared, unique and differentiating groups of micoRNAs[J]. Oncol Rep, 2011, 26(4):995-1002.
[16] TORRES A, TORRES K, PESCI A, et al. Diagnostic and prognostic significance of miRNA signatures in tissues and plasma of endometrioid endometrial carcinoma patients[J]. Int J Caner, 2013, 132(7):1633-1645.
[17] LI Q, YAO Y, EADES G,et al. Downregulation of miR-140 promotes cancer stem cell formation in basal-like early stage breast cancer[J]. Oncogene, 2014, 33(20):2589-600.
[18] LIU J, RUAN B, YOU N, et al. Downregulation of miR-200a induces EMT phenotypes and CSC-like signatures through targeting the β-catenin pathway in hepatic oval cells[J]. PLoS One, 2013, 8(11):e79409.
[19] FAN X, CHEN X, DENG W, et al. Up-regulated microRNA-143 in cancer stem cells differentiation promotes prostate cancer cells metastasis by modulating FNDC3B expression[J]. BMC Cancer, 2013, 13:61.
