姜黄素拮抗LPS活化巨噬细胞对胰岛β细胞的损伤
2018-02-27史立言孟繁平
史立言,刘 岩,陈 为,孟繁平,李 妍*
(1.吉林医药学院检验学院,吉林 吉林132013;2.延边大学医学院,吉林 延吉133002)
糖尿病(diabetes mellitus,DM)是由于胰岛素分泌和(或)作用缺陷所引起慢性血糖水平增高为特征的代谢性疾病,虽然糖尿病的病因和发病机制尚未完全阐明,但越来越多的证据表明,免疫损伤因素参与胰腺的损伤[1]。胰岛主要是由4类内分泌细胞组成,分泌胰岛素的 β细胞组成胰岛核心,而α、δ及 PP细胞组成胰岛外壳。胰腺是血管密集、血供丰富的器官,当巨噬细胞(macrophage,Mφ)被趋化而浸润入胰岛微环境,可分泌细胞因子及释放NO等,参与β细胞损伤。感染、代谢和损伤因素刺激下,Mφ的极化将导致其分泌细胞因子和功能的改变[2]。细菌脂多糖(lipopolysaccharides,LPS)结合Toll样受体4(Toll like receptor 4,TLR-4)而活化Mφ,姜黄素(curcumin)具有抗炎效应[3]。本研究将探讨其是否可通过调节Mφ极化而减轻活化巨噬细胞对胰岛β细胞的损伤。
1 材料与方法
1.1材料小鼠细胞巨噬细胞RAW264.7和小鼠胰岛β细胞Min-6保存于液氮中。1640培养液、胎牛血清(fetal calf serum,FCS)购自Gibco公司。PE荧光素标记抗小鼠CD40、CD86和CD206的抗体购自天津三箭生物技术有限公司;LPS和活性氧(ROS)荧光探针双氯荧光黄乙酸乙酯(Dichlorofluorescin diacetate,DCFH-DA)溶液购自上海碧云天生物科技有限公司;双染凋亡检测试剂盒和酶联免疫吸附技术(ELISA)检测小鼠TNF-α试剂盒购eBioscience公司。姜黄素购自Sigma Aldrich公司。
1.2细胞培养和处理复苏液氮冻存RAW 264.7细胞,在含10% 小牛血清1640培养液、5% CO2、饱和湿度37 ℃培养;用含0.25% 胰蛋白酶和0.2% 乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 的消化液消化细胞,每周传代2-3 次,取对数生长期细胞用于实验。按1×106/孔接种细胞于6孔培养板,按如下分组加入LPS和姜黄素:对照组(control),脂多糖(LPS)组(2 μg /mL),姜黄素(curcumin)组(7.5 μmol/L ) 和联合处理组(2 μg /mL LPS+ 7.5 μmol/L curcumin) 。继续培养细胞24 h,收集培养物上清液于-20℃冻存,消化并收集细胞,完成后续实验。复苏并培养Min-6细胞,按1×106/孔接种于6孔培养板,细胞恢复贴壁生长后,按25%比例加入不同实验分组处理后的RAW 264.7细胞上清液,不添加RAW 264.7细胞上清液组为对照组;继续培养24 h后,消化收集Min-6细胞,完成后续实验。
1.3免疫荧光染色和流式细胞术取不同处理因素作用后的RAW264.7细胞,每组 5×105个细胞,悬于100 μl PBS,加入1 μg FITC 标记抗CD 40抗体或阴性对照抗体,4 ℃下避光反应30 min。PBS洗2次后用400 μl的PBS重悬细胞,流式细胞仪检测阳性表达细胞百分率。相同的方法检测CD86和CD206表达。
1.4ROS检测取不同处理因素作用后的RAW264.7细胞,每组 5×105个细胞,悬100 μl PBS ,加入DCFH-DA 储存液,至其终浓度为 5 μmol/L,混匀后在 37 ℃避光反应 30 min,PBS洗2次,400 μl PBS 重悬细胞,流式细胞仪分析细胞内荧光,以荧光强度均值代表细胞内ROS含量。
1.5ELISA取不同处理因素作用的RAW 264.7 细胞上清液,按照 ELISA 试剂盒操作说明测定 检测TNF-α含量,每个处理因素设3个复孔。
1.6细胞凋亡检测取不同处理因素作用后Min-6细胞,每组 5×105个细胞,用195 μl结合缓冲液重悬细胞,加入 5 μl Annexin-V-FITC 工作液,室温下避光反应 30 min;结合缓冲液洗涤细胞2次,400 μl结合缓冲液重悬细胞,加入PI 溶液5μl,立即上机用流式细胞仪分析。
2 结果
2.1LPS和姜黄素对RAW264.7细胞膜分子表达的影响
实验结果表明,LPS和姜黄素对RAW264.7细胞膜分子CD40、CD86和CD206的表达均有影响(表1)。与对照组比较,脂多糖组CD40和CD86表达增加,而CD206表达减少;姜黄素组CD206表达明显增加,CD40和CD86略下降。与脂多糖组比较,联合处理组CD206表达略增加,CD40和CD86下降。
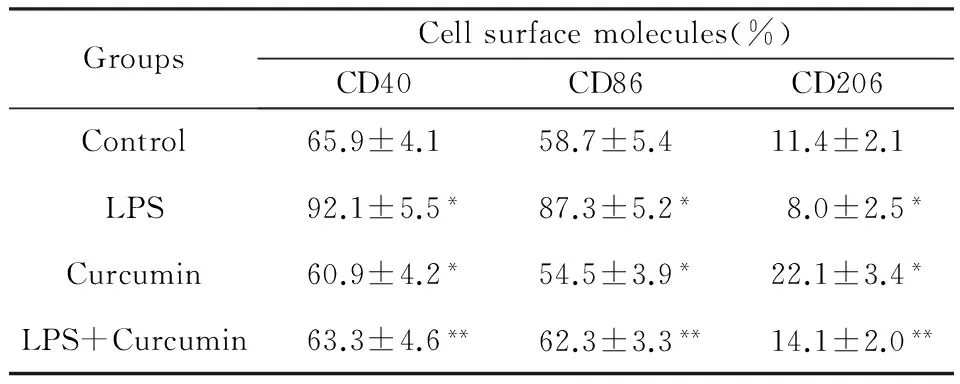
表1 LPS和姜黄素对RAW264.7细胞膜分子表达的影响
*与对照组(control)比较,P<0.05**与脂多糖组(LPS)比较,P<0.05
2.2LPS和姜黄素对RAW264.7细胞分泌TNF-α的影响
通过检测发现,LPS可促进RAW264.7释放TNF-α入细胞培养上清液,而姜黄素处理后,细胞分泌TNF-α较脂多糖组明显减少(表2)。
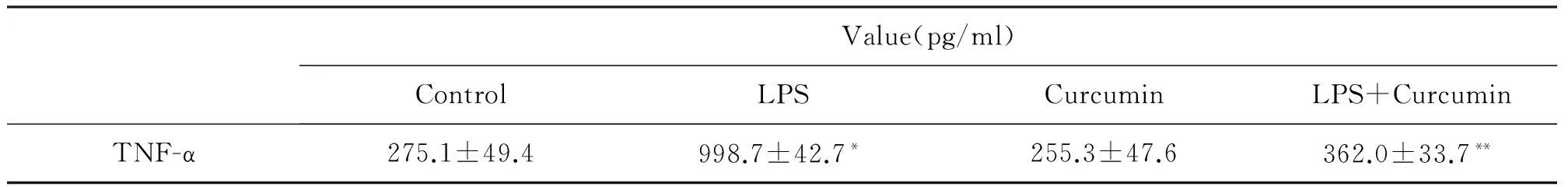
表2 LPS和姜黄素对RAW264.7分泌TNF-α的影响
*与对照组(control)比较,P<0.05**与脂多糖组(LPS)比较,P<0.05
2.3LPS和姜黄素对RAW264.7细胞活性氧的影响
ROS主要由细胞内线粒体产生,巨噬细胞在活化、吞噬和杀伤病原体的过程中伴随ROS增加[4]。通过荧光探针法检测细胞活性氧,对照组(control),脂多糖(LPS)组(2 μg /mL),姜黄素(curcumin)组(7.5 μmol/L ) 和联合处理组代表ROS含量的荧光强度值分别为12.4±1.3,25.7±2.8,9.7±0.9和11.6±1.0(图1)。分析表明,LPS导致细胞内ROS显著增加,而低浓度的姜黄素对细胞内ROS仅有弱的减少效应(与对照组比较P<0.05);但姜黄素能能显著减少LPS激发的活性氧(与脂多糖组比较P<0.05)。
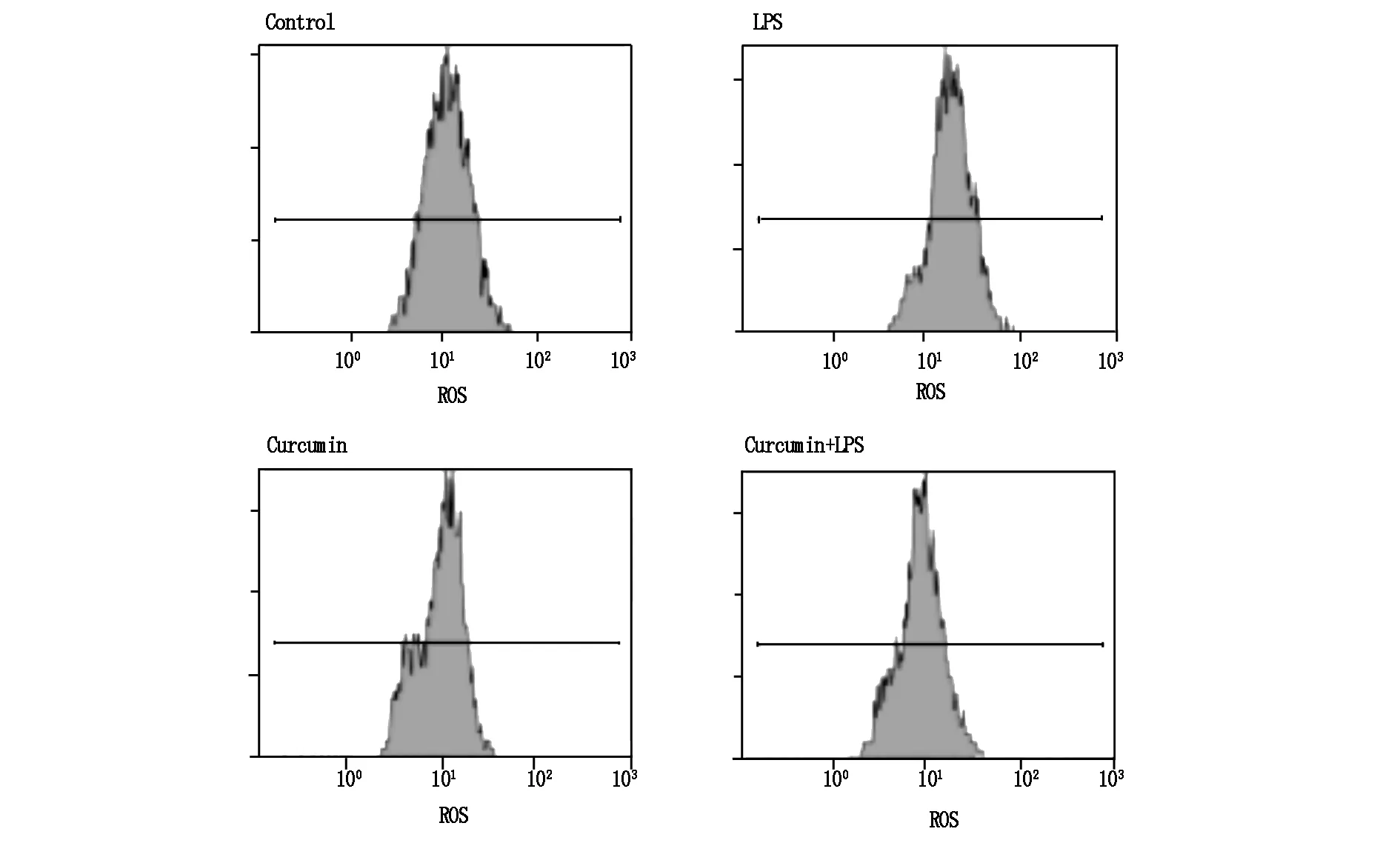
图1 LPS和姜黄素对RAW264.7细胞活性氧的影响
2.4姜黄素拮抗LPS活化巨噬细胞对Min-6细胞的损伤
采用双染法检测Min-6细胞凋亡情况,用新鲜培养液培养组作为空白组(blank),而添加不同条件培养液组对应命名,即对照组(control),脂多糖(LPS)组(2 μg/mL),姜黄素(curcumin)组(7.5 μmol/L ) 和联合处理组(LPS +curcumin)。
3 讨论
糖尿病发生发展的核心是胰岛β细胞的功能障碍[5]。多项研究显示,多种炎症因子可对胰岛β细胞造成损伤,包括TNF-α、IFN-γ和IL-1β等[6],损伤的胰岛β细胞刺激巨噬细胞活化,致使其分泌更多的炎性因子,进一步加重胰岛细胞的损伤[7]。因此,抑制巨噬细胞活化,使其向调节性分化,可能成为糖尿病的治疗手段之一。姜黄素是一种从姜科、天南星科植物的根茎中提取出的一种成分,是传统中药姜黄的主要成分,其具有抗炎、抗氧化、抗肿瘤及降血脂等作用[8]。研究表明,它不仅能够抑制巨噬细胞活化,而且具有使已活化的巨噬细胞向调节型转变的功能[9]。LPS是细菌细胞壁的主要成分,可刺激巨噬细胞活化,产生炎症[10]。本研究中,利用LPS诱导小鼠巨噬细胞Raw264.7,使其发生M1型极化,并以其产生的含有炎症因子的培养液上清作用于小鼠胰岛Min-6细胞,模拟体外炎症损伤模型。结果显示,LPS使Raw264.7细胞膜分子CD40和CD86表达均有增加,而CD206表达减少,且TNF-α分泌增加,细胞内ROS增加,表明成功建立炎症模型;而加入姜黄素后,以上指标的变化明显减弱甚至被逆转。将M1极化后的Raw264.7培养上清加入Min-6细胞后,以姜黄素干预后的炎症模型与之对比,双染凋亡结果显示,Min-6细胞受到M1极化的巨噬细胞炎症因子刺激,凋亡比例明显增加,而姜黄素可显著抑制其损伤作用,提示姜黄素可能拮抗巨噬细胞的活化,保护炎性因子对胰岛细胞的损伤。
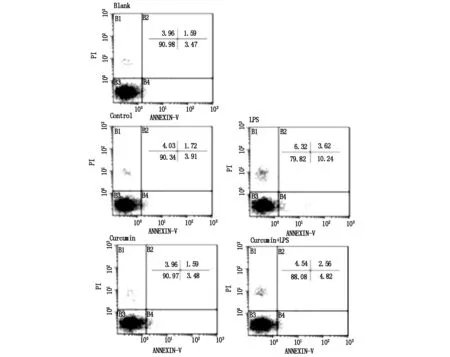
图2 姜黄素拮抗LPS活化巨噬细胞对Min-6细胞的损伤
[1]Itariu BK,Stulnig TM.Autoimmune aspects of type 2 diabetes mellitus-a mini-review[J].Gerontology,2014,60(3):189.
[2]Garzetti L,Menon R,Finardi A,et al.Activated macrophages release microvesicles containing polarized M1 or M2 mRNAs[J].Journal of Leukocyte Biology,2014,95(5):817.
[3]Nahar PP,Slitt AL,Seeram NP.Anti-Inflammatory Effects of Novel Standardized Solid Lipid Curcumin Formulations[J].Journal of Medicinal Food,2015,18(7):786.
[4]Y,Li,H,Zhu,P,Kuppusamy,JL,Zweier,MA,Trush.Mitochondrial Electron Transport Chain-Derived Superoxide Exits Macrophages:Implications for Mononuclear Cell-Mediated Pathophysiological Processes[J].React Oxyg Species (Apex),2016,1(1):89.
[5]Ludwig B,Barthel A,Reichel A,et al.Modulation of the pancreatic islet-stress axis as a novel potential therapeutic target in diabetes mellitus[J].Vitamins & Hormones,2014,95:195.
[6]吴 红,梁尚栋.巨噬细胞对2型糖尿病免疫炎性反应作用的研究进展[J].重庆医学,2015(27):3861.
[7]Morris DL.Minireview:Emerging Concepts in Islet Macrophage Biology in Type 2 Diabetes[J].Molecular Endocrinology,2015,29(7):946.
[8]Nabavi SF,Thiagarajan R,Rastrelli L,et al.Curcumin:a natural product for diabetes and its complications[J].Current Topics in Medicinal Chemistry,2015,15(23):2445.
[9]陈方圆,袁祖贻,周 娟,等.姜黄素促进 RAW264.7源性 M1巨噬细胞向替代激活 M2表型极化[J].西安交通大学学报(医学版),2015(2):257.
[10]丛贾囡,宋占晨,曲 忻.脂多糖促进人结膜上皮细胞IL-6的表达[J].中国实验诊断学,2017,21(9).
