妊娠及体检妇女宫颈感染人乳头瘤病毒基因分型检测特征分析
2018-02-27张丽敏陈柯霖刘淑静王俊平张国军康熙雄
张丽敏,方 芳,陈柯霖,刘淑静,周 金,吕 虹,王俊平,张国军*,康熙雄*
(1.首都医科大学附属北京天坛医院,北京100050;2.北京市免疫试剂临床工程技术研究中心,北京100050;3.河北省固城县医院)
人乳头瘤病毒(HPV)是一种小双链闭合环状DNA 病毒,可特异性感染人皮肤黏膜的鳞状上皮细胞,不同型的HPV可引起不同部位的乳头瘤[1]。HPV主要通过接触感染部位或污染的物品传播,生殖器感染主要由性交传播,新生儿可在产道感染。妊娠期妇女因体内激素水平变化、免疫功能状态等因素较非妊娠期更易感染HPV[2]。妊娠期HPV可通过母婴传播导致婴儿感染,影响母婴健康。本文对2014年1月至2016年6月北京地区来北京天坛医院就诊的妊娠期妇女HPV感染情况作一回顾性分析,以了解妊娠妇女HPV感染现状及型别分布特点,并以同期来院进行体检的妇女HPV感染情况为对照,为今后促进母婴健康的相关研究提供流行病学数据。
1 材料与方法
1.1研究对象2014年1月-2016年6月于北京天坛医院产科门诊就诊的妊娠期妇女共3265例,年龄18-58岁,平均年龄29岁。同期于北京天坛医院体检科进行体检的女性7378例,年龄21-86岁,平均年龄48岁。
1.2标本采集采用HPV采样刷采集宫颈脱落细胞标本,将毛刷放入加有专用细胞保存液的收集管中,4℃冰箱保存,3天内检测。
1.3仪器与试剂采用潮州凯普生物化学有限公司提供的HPV基因分型检测试剂盒,HPV基因分型检测采用凯普导流杂交技术,对21种常见的HPV基因型进行分型检测,包括13种高危型HPV(16、18、31、33、35、39、45、51、52、56、58、59、68),8种低危型HPV(6、11、42、43、44、53、66和CP8304)。
1.4实验过程样本DNA提取;PCR 扩增;导流杂交;酶标显色;结果判断,根据芯片显色位点判断HPV基因型。
1.5统计方法用SPSS 17.0统计学软件;计数资料以百分比表示,率的比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1妊娠妇女宫颈感染HPV检出情况
2.1.1HPV感染率及各基因型分布 3265例妊娠妇女HPV-DNA阳性例数为340例,总阳性检出率为10.41%(340/3265)。21种基因型共检出20种,有1种基因型未检出,为低危型HPV-42。其中HPV-52检出率最高,共70例,阳性率为2.14%(70/3265),其次为HPV-16、58、51、53,阳性率分别为1.75%(57/3265)、1.62%(53/3265)、1.01%(33/3265)和1.01%(33/3265)。(多重感染重复计数)
2.1.2单一及多重感染分布 在340例检出阳性标本中,单一感染271例,占总阳性标本的79.71%,二重感染54例,占总阳性标本的15.88%,三重及以上感染15例。
2.1.3高危及低危型别感染分布 在340例检出阳性标本中,高危型感染检出率为74.12%(252/340),低危型感染检出率为18.82%(64/340),高低危型别混合感染检出率为7.06%(24/340)。其中,高危型感染组以单一感染为主,共214例,占阳性标本的84.92%(214/252),主要型别为HPV-52、16、58、51、39。低危型感染组单一感染58例,占阳性标本的90.63%(58/64),主要型别为HPV-53、CP8304、66,二重感染6例。高低危混合感染组二重感染16例,占阳性标本的66.67%(16/24),主要型别为HPV-53、CP8304。
2.1.4妊娠妇女感染HPV年龄分布情况 妊娠妇女中,年龄<23岁患者HPV感染率为20.24%,高于其他组别。>36岁患者感染率最低为8.26%,如表1所示。
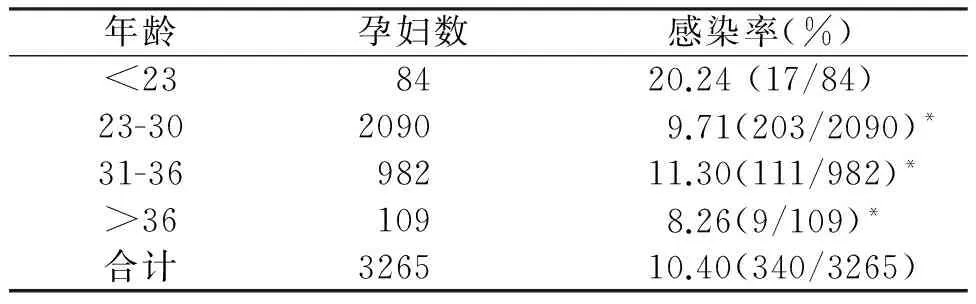
表1 孕妇感染HPV年龄分布情况
*与<23岁比较,P<0.05
2.2体检妇女宫颈感染HPV检出情况
2.2.1HPV感染率及各基因型分布 7378例体检妇女HPV-DNA阳性例数为947例,总阳性检出率为12.84%(947/7378)。21种基因型均检出。其中HPV-52和HPV-CP8304检出率最高,均为158例,阳性率为2.14%(158/7378),其次为HPV-58、53、16、39,阳性率分别为2.13%(157/7378)、1.48%(109/7378)、1.45%(107/7378)和1.26%(93/7378)。(多重感染重复计数)
2.2.2单一及多重感染分布 在947例检出阳性标本中,单一感染722例,占总阳性标本的76.24%,二重感染172例,占总阳性标本的18.16%,三重及以上感染53例。
2.2.3高危及低危型别感染分布 在947例检出阳性标本中,高危型感染检出率为64.10%(607/947),低危型感染检出率为24.08%(228/947),高低危型别混合感染检出率为11.83%(112/947)。其中,高危型感染组以单一感染为主,共515例,占阳性标本的84.84%(515/607),主要型别为HPV-52、58、16、39、18。低危型感染组单一感染207例,占阳性标本的90.79%(207/228),主要型别为HPV-53、66、6,二重感染19例。高低危混合感染组二重感染74例,占阳性标本的66.07%(74/112),主要型别为HPV-CP8304和HPV-58。
2.2.4体检妇女感染HPV年龄分布情况 体检妇女年龄范围较大,因此分为6个年龄段。<26岁患者感染率最高,为23.08%,其次为26-30岁。感染率随年龄增加总体呈下降趋势,>60岁患者感染率最低,如表2所示。
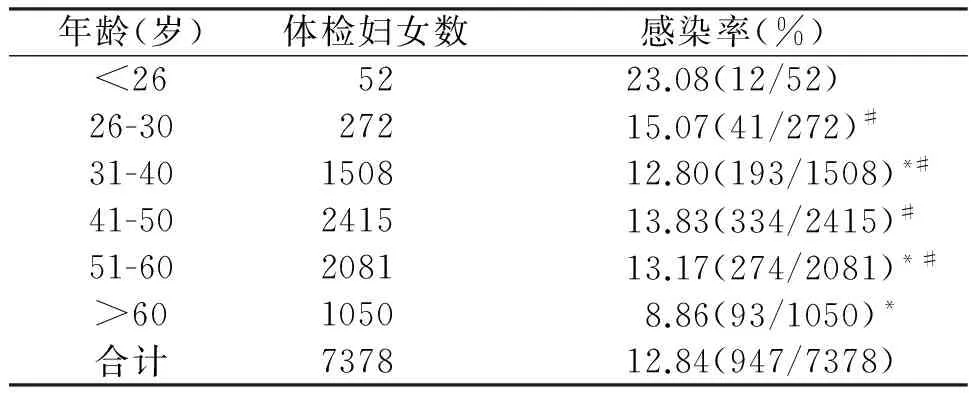
表2 体检妇女感染HPV年龄分布情况
*与<26岁比较,P<0.05#与>60岁比较,P<0.05
2.3妊娠妇女和体检妇女宫颈感染HPV结果比较
2.3.1HPV感染率比较 3265例妊娠妇女中HPV阳性感染者340例,HPV感染率10.41%,检测到20 种HPV 基因型;7378 例体检妇女中HPV阳性感染者947例,HPV感染率12.84%,检测到21种HPV基因型;体检妇女感染率高于妊娠妇女,差异有统计学意义(P<0.05)。妊娠妇女中单一型别HPV感染271例,感染率8.30%;体检妇女中单一型别HPV感染722例,感染率9.79%;体检妇女单一型别感染率高于妊娠妇女,差异有统计学意义(P<0.05)。妊娠妇女中混合型别HPV感染69例,感染率2.11%;体检妇女中混合型别HPV感染225例,感染率3.05%,体检妇女感染率高于妊娠妇女(P<0.05)。两组妇女中,高危型感染组与高低危型感染组合计为高危感染进行统计学分析,低危型感染组与高低危型感染组合计为低危感染进行统计学分析,见表3。体检妇女高危感染率及低危感染率均高于妊娠妇女(P<0.05)。
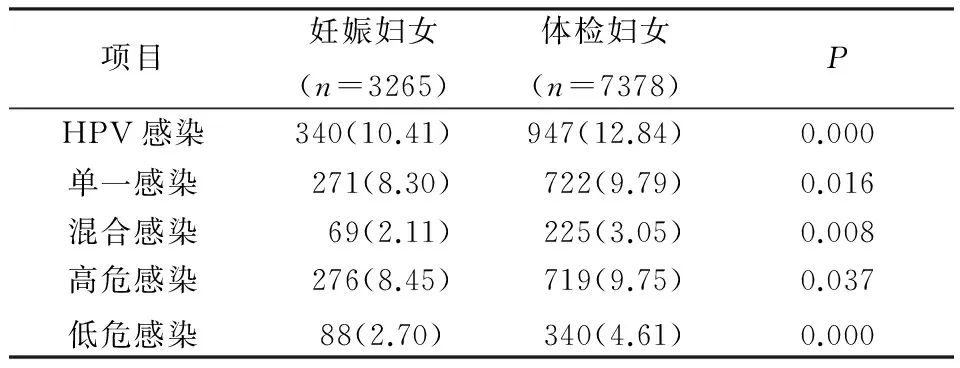
表3 妊娠及体检妇女HPV感染状况比较(n,%)
2.3.2HPV感染基因型别比较 两组患者HPV 感染前7 位型别中有6种型别相同,分别为HPV-52、16、58、53、39和CP8304,且首位感染型别相同,为HPV-52,感染率均为2.14%,见表4。HPV-16、58、53、39在两组间感染率差异无统计学意义(P>0.05),HPV- CP8304感染率体检妇女高于妊娠妇女,差异有显著统计学意义(P<0.05)。
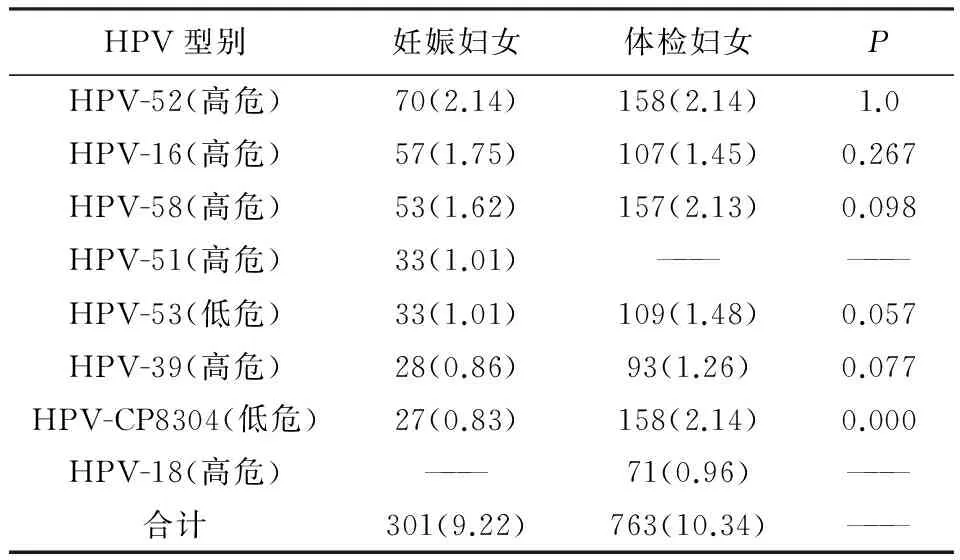
表4 妊娠及体检妇女主要HPV型别及感染率比较(n,%)
3 讨论
目前HPV已发现200多种亚型,得到鉴定的有100余种[3]。HPV有高危型和低危型之分,一般认为,高危型HPV与宫颈癌发病有关,低危型HPV与生殖道良性病变有关。70%-80%的女性在其一生中都曾感染过HPV,绝大多数通过自身的免疫力,在感染后的1-2年内自行清除。只有持续的感染高危型HPV才会有发生宫颈癌的风险。因此,定期检测HPV尤其是检测HPV的型别非常重要。妊娠期妇女感染HPV,由于体内激素水平变化,更利于HPV的复制,另外阴道分泌物增加,局部的潮湿环境有利于HPV病毒的生长和繁殖。国内有研究数据显示,20%-30%孕妇伴随HPV 或持续感染[4]。此外,妊娠期HPV 感染可以垂直传播,造成新生儿先天性尖锐湿疣或喉乳头瘤等疾病,成为临床上严重影响母婴的身心健康的妊娠期合并症[5]。因此对妊娠期妇女进行HPV筛查有必要在临床广泛开展。
本研究对3265例妊娠妇女及7378例体检妇女进行宫颈HPV感染检测,结果显示妊娠妇女感染率为10.41%,低于体检妇女12.84%。这与妊娠妇女易感染HPV的观点不符[6]。分析原因我们认为入组的体检妇女年龄分布范围较宽,而妊娠妇女年龄较为集中,如能将妊娠妇女与同年龄段的非妊娠妇女作比,则能减少偏倚。另外,目前关于妊娠期妇女HPV感染率的报道结论并不一致。Aydin等[7]对土耳其妇女的研究发现,妊娠期妇女HPV感染率为29.2%,明显高于非妊娠期妇女(19.6%)。而Biernat等[8]检测了145例妊娠期妇女与相同样本量的非妊娠期妇女,结果显示两组妇女HPV感染率无统计学差异。分析各研究结果不一致的原因,可能与样本量、实验室检测方法、所测HPV型别不同有关。孕周不同也可影响HPV感染的检出率[9]。
两组妇女HPV感染均以单一感染为主,且高危感染比例高于低危感染,这与此前的报道一致[10]。妊娠妇女单一混合感染阳性率及高危低危感染阳性率均低于体检妇女。有研究显示宫颈病变级别随着HPV 感染亚型的增多而升高[11,12],且高危多重感染宫颈癌变发生风险较单一感染更高[13],因此HPV多重感染亦不容忽视。在感染型别上,本研究显示两组高危型均以HPV-52检出率最高,其次为HPV16/58,低危型以HPV-CP8304最高。这与Jing Ye[14]对浙江地区妇女HPV感染流行病学数据一致。而另有报道显示,HPV感染高危型以HPV-1618检出率最高[1,15-17],低危型以HPV-6检出率最高[1,17]。一方面这可能与地域、民族差异有关,另一方面在感染型别上妊娠妇女与非妊娠妇女可能存在一定差异。
从年龄分布上来看,<23岁妊娠妇女感染率最高,为20.24%,高于其他年龄段,其他三个年龄段之间差异无统计学意义,但>36岁感染率呈下降趋势。<26岁体检妇女感染率最高,随年龄增长感染率呈下降趋势,>60岁年龄段感染率最低。也就是说高感染率呈现年轻化趋势。而此前有研究报道HPV感染率在妊娠及非妊娠妇女随年龄增长均呈上升趋势[18]。另有一项研究数据显示HPV感染率在50-60岁非妊娠妇女最高,为43.7%[17]。差异存在及本研究高感染率趋于年轻化的原因可能为:(1)研究对象不同,本研究为妊娠妇女及健康体检者,而其他研究对象为于妇科门诊就诊的女性患者,伴身体不适的症状和体征而前来就诊;(2)年轻患者性生活开始早并且活跃,生育年龄较小,又处于宫颈鳞柱上皮转化期,易受HPV感染;(3)部分年轻妇女有多个性伴侣,性生活混乱易患生殖系统疾病,而HPV感染为性传播疾病;(4)另外年轻患者免疫系统尚不够成熟,不易清除以16亚型为主的高危HPV感染,使HPV病毒很快整合到宿主细胞DNA并大量复制,这可能是年轻宫颈癌患者HPV16型的总感染率高于年长宫颈癌患者的主要原因。而一项纳入13640名妊娠妇女的流行病学Meta分析数据显示<25岁年轻妊娠妇女更易感染HPV,与本研究结论一致[15]。
综上所述,我院妊娠妇女HPV感染率较体检妇女低,两组均以单一感染和高危感染为主,主要型别为HPV-52、16、58、53、39和CP8304,高感染率呈现年轻化趋势。HPV分型检测是妊娠妇女宫颈病变最基本的筛查手段,对新生儿健康也有着积极意义,可以通过预测及早期治疗HPV 感染而减少或控制孕妇宫颈癌的发生及降低新生儿并发症和死亡率。
[1]Zhong TY,Zhou JC,Hu R,et al.Prevalence of human papillomavirus infection among 71,435 women in Jiangxi Province,China[J].J Infect Public Health,2017 Feb 14.pii:S1876-0341(17)30011-4.doi:10.1016/j.jiph.2017.01.011.[Epub ahead of print]
[2]周蓓蓓,张丽娜,范燕燕,等.孕期人乳头瘤病毒感染类型与母婴垂直传播的前瞻性研究[J].现代妇产科进展,2012,21(3):208.
[3]范文生,李亚里,杨怡卓,等.基因芯片技术检测宫颈病变中HPV 感染的临床研究[J].中华医院感染杂志,2009,19(7):745.
[4]何 玥,吴玉梅,王 彤,等.妊娠合并子宫颈上皮内瘤变患者高危型HPV 感染的临床研究[J].中华妇产科杂志,2012,47(8):598.
[5]许 颖,马毓梅,张杰英,等.人乳头瘤病毒的研究进展[J].河北医药.2013,35(12):1884.
[6]Salcedo MM,Damin AP,Agnes G,et al.Prevalence of human papillomavirus infection in pregnant versus non-pregnant women in Brazil[J].Arch Gynecol Obstet,2015,292(6):1273.
[7]Aydin Y,Atis A,Tutuman T,et al.Prevalence of human papilloma virus infection in pregnant Turkish women compared with non-pregnant women[J].European Joumal of Gynaecologieal Oncology,2010,31(1):72.
[8]Biernat I,Szczudrawa A,Tomaszezyk J,et al.HPV infection in pregnant women [J].Ginekologia Polska,2003,74(10):1066.
[9]吴 倩,林 竞,赵丽华,等.基因芯片检测妊娠期HPV感染情况及分型的研究[J].现代中西医结合杂志.2013,22(29),3196.
[10]杜 宏,索兰草,刘红贤,等.甘肃地区女性宫颈HPV感染的现状研究[J].暨南大学学报(自然科学与医学版),2015,36(1).40.
[11]李 霓,代 敏.中国城市妇女人乳头状瘤病毒多重感染情况及其与子宫颈病变的关系[J].中华预防医学杂志,2010,44(5):423.
[12]杨燕芬,邱 毅,佟 雁,等.HPV多重感染与宫颈病变的关系研究[J].2016,31(2).
[13]赵红霞,董艳双,蔡友治,等.人乳头状瘤病毒多重感染对高度鳞状上皮内病变和宫颈癌发生的影响[J].实用医学杂志,2016,32(8):1268.
[14]Jing Ye,Xiaodong Cheng,Xiaojing Chen,et al.Prevalence and risk profile of cervical human papillomavirus infection in Zhejiang Province,southeast China:a population-based study[J].Virology Journal,2010,7:66.
[15]Liu P,Xu L,Sun Y,et al.The prevalence and risk of human papillomavirus infection in pregnant women[J].Epidemiol Infect,2014,142(8):1567.
[16]李 青,金红梅.孕期人乳头状瘤病毒感染的结局分析[J].中国临床医学.2014,21(3):293.
[17]王小利,常永超,刘海花,等.洛阳地区女性HPV感染及病毒亚型分布特征研究[J].检验医学与临床,2016,13(14):1905.
[18]王新忠,赵俊红.妊娠及非妊娠妇女宫颈感染人乳头瘤病毒的基因亚型检测及分析[J].中国临床医学,2014,21(3):288.
