TGF-β1对Aβ1-42诱导海马神经元-小胶质细胞共培养体系中细胞因子表达和分泌的影响*
2018-02-21方小霞孙高林邱一华彭聿平
方小霞, 周 易, 孙高林, 邱一华, 彭聿平△
(1. 南通大学医学院生理学系, 2. 机能学实验室, 江苏 南通 226001)
阿尔茨海默病(Alzheimer disease,AD)是一种进行性的中枢神经系统( central nervous system,CNS)退行性疾病。其主要的病理组织学改变为:神经元外淀粉样蛋白(β-amyloid peptide, Aβ) 集聚形成的老年斑(senile plaques,SP),皮层和海马胆碱能神经元及其突触的大量丢失,神经元内tau蛋白的异常集聚形成的神经纤维缠结(neurofibrillary tangles,NFTs)[1]。近年来对AD发病机制的研究发现脑内的慢性神经炎症反应可能是其重要的病理特征之一。小胶质细胞是CNS固有的免疫细胞,在健康的脑中小胶质细胞表现为静止的表型,但在脑损伤后会变得高度活跃,产生活性氧,NO和促炎细胞因子,因此,小胶质细胞在病理性损伤的监测和反应中起着重要作用[2]。现有证据表明,小胶质细胞活化导致促炎细胞因子的过度产生,这可能有助于神经退行性疾病的发生和进展[3]。例如,激活的小胶质细胞及其分泌的因子,如TNF-α,是炎症反应的主要介质,这已被证明与神经退行性疾病如AD相关[4, 5]。聚集的Aβ具有十分强大的毒性作用,能够引起小胶质细胞与星形胶质细胞的激活和增殖并产生致炎因子, 引发神经炎症。而炎症反应又能促进Aβ的沉积,加重炎性斑的形成, 形成恶性循环,最后导致 AD 的发生[6]。因此, 小胶质细胞及其相关的炎症反应在 AD 的形成过程中发挥着重要的作用。
转化生长因子-β1(transforming growth factor-β1,TGF-β1) 是一种免疫抑制因子,是细胞生长、分化和损伤后组织修复的重要调节因子。TGF-β1的分布较为广泛,遍及全身各大组织系统,在正常状态下,CNS 中TGF-β1的含量较少,但在一些病理情况下,如炎症、肿瘤、脑积水等CNS疾病中,TGF-β1的含量会明显增加,说明TGF-β1与CNS中的某些疾病关系密切。多种类型的损伤均可激活小胶质细胞,活化后的小胶质细胞能分泌TGF-β1,然而TGF-β1也能够阻止小胶质细胞增殖,并且可选择性的诱导其凋亡,表现出TGF-β1的抗炎作用[7]。在CNS炎症反应的急性期,促炎因子诱导巨噬细胞侵袭和胶质细胞增生,然而在炎症反应的慢性期,TGF-β1可能具有抑制这些细胞功能的作用[8]。
本实验室先前研究[9]发现,Aβ1-42对海马神经元-小胶质细胞共培养体系中的损伤作用比单独神经元培养体系更明显,提示小胶质细胞来源的神经炎症对神经元损伤的促进作用,因此本研究选用海马神经元与小胶质细胞共培养体系,探讨TGF-β1对 Aβ1-42诱导的小胶质细胞激活释放细胞因子的影响,为TGF-β1抑制Aβ毒性的具体作用机制做进一步的探究。
1 材料与方法
1.1 Aβ1-42寡聚体的制备
Aβ1-421 mg溶于220 μl冷却的六氟异丙醇 (HFIP) 中,制成 1 mmol/L溶液,室温孵育 60 min,将 Aβ 肽-HFIP放置在冰上 5 min,移至通风橱风干后形成Aβ 肽膜,将其溶解于 44 μl二甲基亚矾 (DMSO),制成 5 mmol /L Aβ1-42合成肽,再用无酚红的 F12 培养液将其稀释成100 μmol /L,4℃ 孵育 24 h 后,4℃、15 000 r/min 离心10 min,上清液即为Aβ1-42寡聚体,分装后置于 - 20 °C 冰箱保存。
1.2 大鼠海马神经元和小胶质细胞共培养
取孕18 d SD大鼠(由南通大学实验动物中心提供),麻醉后剖腹取胚胎置D-hanks液中。分离海马组织,0.125%胰酶37℃水浴消化15 min。含10% FBS的DMEM/F12完全培养基终止消化,计数、按1×106/cm2细胞接种至多聚赖氨酸预先包被的培养板中,37℃、5% CO2培养箱中培养,5 h后换Neurobasal/B27培养基,培养4 d后加入纯化的小胶质细胞,海马神经元小胶质细胞共同培养8 d。取出生0~1 d的SD大鼠全脑,经消化、终止消化后,将细胞按5×105/cm2细胞接种于培养瓶中,37℃、5% CO2培养箱中培养。培养11 d后运用摇床振摇法分离纯化小胶质细胞[10],即37℃恒温摇床上以240 r/min摇2 h后, 收集悬浮的细胞即小胶质细胞,此法获得小胶质细胞经CD11b染色鉴定纯度可达95%以上。将纯化后的小胶质细胞种于已培养4 d的海马神经元中,此为神经元小胶质细胞共同培养的第0日,神经元和小胶质细胞共同培养8 d。
1.3 药物处理
在海马神经元与小胶质细胞共同培养的第5日,加入TGF-β1(5 or 20 ng/ml), 1 h 后加入Aβ1-42(5 μmol/L),细胞继续培养72 h,于第8日后用于后续实验。
1.4 Real time PCR
Trizol法提取细胞总RNA,按照试剂盒说明书加入逆转录反应体系,逆转录成cDNA。以逆转录产物cDNA为模板进行PCR扩增。PCR 反应总体积为20 μl,含cDNA 模板2 μl,上、下游引物各0.3 μl,Taq 酶0.1 μl、dNTPmix 10 μl、SYBR Green 0.4 μl,双蒸水补齐(表1)。PCR 反应条件为初始程序95℃,5 min;40个循环。PCR 反应在ABI 7500 real Time PCR仪上进行,采用β-actin作为内参。以Rotor-Gene 6.0软件进行数据分析。软件分析其Ct值及相对值(relative quantity, RQ),RQ=2-ΔΔCt,计算各细胞因子mRNA的相对表达水平。
1.5 Western blot

Tab. 1 Sequences of PCR primers
用细胞裂解液提取细胞总蛋白,SDS-PAGE凝胶电泳进行分离,Bio-Rad湿转系统转膜200 mA、60 min-2 h,用5%脱脂奶粉封闭2 h,加入兔抗iNOS多克隆抗体(1∶1 000,Abcam)小鼠抗β-actin单克隆抗体(1∶1 000,Sigma), 4℃过夜。TBST洗涤后分别加入荧光二抗室温孵育2 h。Odyssey双红外激光扫描系统扫描并分析条带平均灰度值,各目的蛋白与内参β-actin的比值表示各目的蛋白的相对表达量。
1.6 ELISA法测定细胞培养液中细胞因子的含量变化
取预先保留好的细胞培养液,通过ELISA试剂盒分别检测其中的IL-1β、IGF-1与TNF-α的浓度,详细步骤参照相应试剂盒的使用说明(eBroscience公司)。
1.7 统计学处理
2 结果
2.1 TGF-β1对Aβ1-42诱导海马神经元与小胶质细胞共培养中iNOS表达的影响
在海马神经元与小胶质细胞共培养体系中,Aβ1-42(5 μmol/L) 明显上调iNOS的蛋白表达量(P<0.01),TGF-β1(5 or 20 ng/ml)在Aβ1-42加药前1 h预处理组与单独Aβ1-42组相比, iNOS蛋白表达量明显降低(P<0.01),且TGF-β1(20 ng/ml)预处理组作用更明显(P<0.01),说明TGF-β1能够抑制Aβ1-42诱导的iNOS表达增高(图1)。


Aβ: Aβ1-42(5 μmol/L); TGF(5): TGF-β1(5 ng/ml); TGF(20): TGF-β1(20 ng/ml)
**P<0.01vscontrol;##P<0.01vsAβ1-42;△△P<0.01vsTGF-β1(5) +Aβ1-42
2.2 TGF-β1对Aβ1-42诱导海马神经元-小胶质细胞体系中炎性介质表达和分泌的影响
为了说明TGF-β1对Aβ1-42诱导的海马神经元与小胶质细胞共培养体系中炎症因子的影响,我们利用real-time PCR和ELISA法分别检测TNF-α和IL-1β的基因表达及分泌(表2,3)。与正常对照组相比,Aβ1-42处理组TNF-α和IL-1β的mRNA表达水平显著升高(P<0.01);TGF-β1(5 or 20 ng/ml)预处理组与单独Aβ1-42组相比,TNF-α和IL-1β的mRNA表达水平明显降低(P<0.01,P<0.05),TGF-β1(20 ng/ml)预处理组降低TNF-α表达的作用更明显(P<0.01,表2)。同样的,Aβ1-42处理组TNF-α和IL-1β的分泌量显著升高(P<0.01);TGF-β1(5 or 20 ng/ml)预处理组TNF-α和IL-1β的分泌量明显下调(P<0.01),TGF-β1(20 ng/ml)预处理组降低TNF-α分泌的作用更显著(P<0.05,表3)。

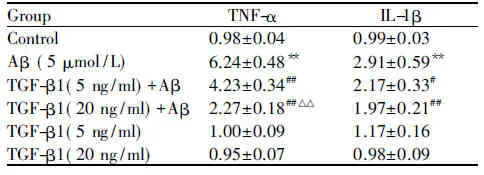
GroupTNF-αIL-1βControl0.98±0.04 0.99±0.03Aβ (5 μmol/L)6.24±0.48∗∗2.91±0.59∗∗TGF-β1(5 ng/ml)+Aβ4.23±0.34##2.17±0.33#TGF-β1(20 ng/ml)+Aβ2.27±0.18##△△1.97±0.21##TGF-β1(5 ng/ml)1.00±0.091.17±0.16TGF-β1(20 ng/ml)0.95±0.070.98±0.09
Aβ:Aβ1-42; TGF-β1: Transforming growth factor beta 1; TNF-α: Tumor necrosis factor-α; IL-1β: Interleukin-1β
**P<0.01vscontrol;#P<0.05,##P<0.01vsAβ1-42;△△P<0.01vsTGF-β1(5 ng/ml) +Aβ1-42


GroupTNF-αIL-1βControl46.43±10.1214.53±4.89Aβ(5 μmol/L)94.16±7.87∗∗31.78±9.13∗∗TGF-β1(5 ng/ml)+Aβ72.97±6.89##20.54±5.59##TGF-β1(20 ng/ml)+Aβ60.13±7.70##△16.39±4.82##TGF-β1(5 ng/ml)45.30±10.6212.66±4.87TGF-β1(20 ng/ml)40.22±8.3911.10±3.88
Aβ: Aβ1-42; TGF-β1: Transforming growth factor beta 1; TNF-α: Tumor necrosis factor-α; IL-1β: Interleukin-1β
**P<0.01vscontrol;##P<0.01vsAβ1-42;△P<0.05vsTGF-β1(5 ng/ml) +Aβ1-42
2.3 TGF-β1对Aβ1-42诱导海马神经元-小胶质细胞体系中神经营养因子IGF-1的表达和分泌的影响
神经营养因子IGF-1的mRNA表达及分泌结果可见,与正常对照组相比,Aβ1-42处理组IGF-1的mRNA表达水平显著降低(P<0.01);TGF-β1(5 or 20 ng/ml)预处理组与单独Aβ1-42处理组相比,IGF-1的mRNA表达水平明显升高(P<0.01),TGF-β1(20 ng/ml)预处理上调IGF-1 mRNA表达的作用更明显(P<0.05)。同样的,与正常对照组相比,Aβ1-42处理组IGF-1的分泌量明显降低(P<0.01)。TGF-β1(5 or 20 ng/ml)预处理组较单独Aβ1-42处理组IGF-1的分泌上调(P<0.05,P<0.01),说明TGF-β1可以抑制Aβ1-42诱导的IGF-1 mRNA表达和分泌减少(表4)。


GroupIGF-1 mRNAIGF-1 secretion (pg/ml)Control1.01±0.05282.08±54.51Aβ (5 μmol/L)0.31±0.06∗∗184.21±23.92∗∗TGF-β1(5 ng/ml)+Aβ0.67±0.08##245.10±62.12#TGF-β1(20 ng/ml)+Aβ0.92±0.14##△265.32±56.53##TGF-β1(5 ng/ml)1.05±0.05319.72±39.09TGF-β1(20 ng/ml)1.12±0.13338.41±44.18
Aβ: Aβ1-42; TGF-β1: Transforming growth factor beta 1; IGF-1: Insulin-like growth factor-1
**P<0.01vscontrol;#P<0.05,##P<0.01vsAβ1-42;△P<0.05vsTGF-β1(5 ng/ml) +Aβ1-42
3 讨论
近年来研究发现,神经炎症参与多种神经退行性疾病。神经炎症成为AD的重要发病机制之一。在过度表达APP的转基因动物中,其脑内可见大量的老年斑,主要集中在皮质和海马, 同时在这些区域也观察到许多激活的小胶质细胞[11, 12]。越来越多的证据表明,小胶质细胞是一个重要的致病因素,在病理情况下,活化的小胶质细胞可诱导神经毒性作用,产生大量细胞因子,如IL-1β,NO,活性氧(reactive oxygen species, ROS)和TNF-α等[13]。IGF-1是小胶质细胞激活的调节因子,在老年脑中减少。通常IGF-1是一种增加神经保护作用的生长因子[14]。除此之外,IGF-1还具有免疫调节功能,可以减少脑中炎症细胞因子反应,减轻LPS诱导的主要由小胶质细胞产生IL-1β和 TNF-α驱动的疾病行为[15, 16]。本实验室先前研究[9]发现相对于单独神经元培养体系,Aβ1-42对海马神经元-小胶质细胞共培养体系中的损伤作用更显著,提示小胶质细胞来源的神经炎症对神经元损伤的促进作用,所以本实验检测一些具有代表性的小胶质细胞表达和分泌的炎症因子和神经营养因子IGF-1的表达和分泌变化,结果表明TNF-α、IL-1β、iNOS的表达和分泌增加,IGF-1表达和分泌下降。本实验室另一研究发现,在未作任何处理的神经元中,TNF-α表达量较低,而在炎症刺激后的神经元TNF-α表达增加,而无论有无炎症刺激,IL-1β、iNOS和IGF-1在神经元中均未检测出[17]。因此,Aβ1-42诱导小胶质细胞激活可能是通过上调炎症因子TNF-α、IL-1β、iNOS的表达和分泌,下调神经营养因子IGF-1的表达和分泌。
TGF-β1是一种主要来源于调节性T细胞(Treg细胞)的多效应细胞因子,具有神经保护和免疫抑制的作用[18]。TGF-β1能够促进胶质细胞介导的Aβ的降解,进而发挥TGF-β1对Aβ损伤的神经元的保护作用[19]。本研究发现,在海马神经元和小胶质细胞的共同培养体系中,TGF-β1可下调Aβ1-42诱导促炎因子的表达增加,上调Aβ1-42诱导神经营养因子IGF-1的表达减少,表明TGF-β1可能通过抑制小胶质细胞释放炎性因子,上调神经营养因子IGF-1的表达分泌,对海马神经元发挥神经保护作用。
综上,Aβ1-42可以诱导神经炎症的发生和发展,刺激小胶质细胞的活化,释放促炎因子iNOS、TNF-α和IL-1β增加,神经营养因子IGF-1减少,进而引起抗炎和致炎反应的失衡, TGF-β1可通过抑制小胶质细胞的活化减少促炎因子释放,增加神经营养因子释放来更有效的拮抗Aβ1-42对神经元的毒性作用。
