抗犬VEGF单克隆抗体及夹心ELISA试剂盒的制备及应用
2018-02-18赵冰冰常宏建任晓丽
肖 敏,赵冰冰,常宏建,任晓丽,刘 云
(东北农业大学动物医学学院 黑龙江省实验动物与比较医学重点实验室,黑龙江 哈尔滨 150030)
在兽医临床上,肿瘤为犬常发疾病之一。据报道[1],发病率排名前五位的肿瘤依次为乳腺肿瘤、皮肤肿瘤、肛周瘤、睾丸肿瘤、阴道肿瘤。犬作为与人类关系最密切的伴侣动物,无论从临床症状,细胞和组织病理学分类以及诊断上,犬肿瘤都与人类肿瘤具有较高的相似性,犬可以作为人类肿瘤研究的完美模型[2-3]。反之,人类肿瘤的研究成果也可适当借鉴到犬肿瘤的研究领域,为犬肿瘤的治疗提供新的方向和靶点[4]。
血管生成是指在现有的脉管系统中形成新的血管,是肿瘤发生发展过程中的一个重要特征[5-6]。在促进肿瘤血管生成的多种细胞因子中,血管内皮生长因子(VEGF)是最主要因子,具有促进内皮细胞分裂、增生和趋化的作用[7-8],并能增强血管通透性及促进肿瘤的生长、侵袭和转移[9],在肿瘤的生长和转移中是必不可少的[10]。VEGF,通常被称为血管内皮生长因子,在大多数肿瘤中均有表达,其表达与肿瘤进展有关[11]。因此,VEGF的过度表达可作为肿瘤疾病诊断标志物之一[12]。
1 材料与方法
1.1 材料 6~8周龄 BALB/c雌性小鼠,体重18~25 g,购自黑龙江省品臣科技有限公司;BL21,购自北京全式金生物技术有限公司;EcoRI,SalI,购自宝生物工程(大连)有限公司;胎牛血清,购自浙江天杭生物科技股份有限公司;RPM1640培养基,购自GIBCO公司;卡那霉素、HAT干粉(50)、HT干粉(50)、弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)、聚乙二醇(PEG4000)、单克隆抗体亚型鉴定试剂盒,均购自Sigma公司;兔抗犬VEGF单克隆抗体,购自上海优维宁生物科技股份有限公司;辣根过氧化物酶(HRP)标记山羊抗鼠/兔IgG,购自北京中杉金桥生物技术有限公司;其他化学试剂均为国产分析纯试剂。
1.2 试验方法
1.2.1 犬VEGF引物的设计与蛋白的表达 进入GenBank数据库,查找犬VEGF基因序列。设计引物,基因扩增后,构建原核表达载体,诱导犬VEGF蛋白。
1.2.2 小鼠免疫 以重组表达的VEGF蛋白为抗原免疫小鼠,共3次。最后1次免疫3 d后,采血,检测血清效价,取效价最高的小鼠脾细胞与骨髓瘤细胞SP2/0进行融合。
1.2.3 杂交瘤细胞株建立 要融合时,提前3 d对效价高的小鼠进行加强免疫,取小鼠的脾细胞,与骨髓瘤细胞融合。利用ELISA法,筛选阳性克隆。
1.2.4 单克隆抗体的大量制备 取10周龄左右小鼠腹腔注射液体石蜡。7 d后用PBS重悬阳性单克隆杂交瘤细胞株,对细胞进行计数,注入小鼠腹腔内。7~10 d后收集腹水,离心,取上清分装,-80℃保存。采用饱和硫酸铵沉淀法纯化腹水。
1.2.5 单克隆抗体的特异性检测 采用免疫印迹技术(Western Blot)和免疫荧光共聚焦技术检测单克隆抗体特异性。
1.2.6 ELISA检测方法的建立 (1)单抗最佳包被浓度和多抗最佳稀释度的确定。使用十字交叉法,对单抗和多抗进行稀释。按照标准双抗夹心ELISA法进行检测,每个稀释度作3个平行复孔,确定最佳浓度;(2)ELISA试剂盒阴阳性临界值的确定。
用本研究制备的诊断试剂盒检测64份阴性血清样品,计算出血清样品的平均OD450nm值和标准差SD,且每份阴性样品OD值是通过3次双抗夹心ELISA求的平均值。根据统计学分析,临界值=样品的平均OD值+3SD,当临界值>样品的平均OD值+3SD为阳性,临界值≦样品的平均OD值+2SD时为阴性,当样品的平均OD值+2SD<临界值≦样品的平均OD值+3SD为可疑,需重新检测样品。
1.2.7 对临床收集的犬血清样本中的VEGF水平进行ELISA检测分析 使用已建立的双抗夹心ELISA方法学体系,对临床收集的96例犬血清样本作ELISA检测,其中包括16份犬乳腺肿瘤,25份结石,9份子宫蓄脓,20份正常犬,26份皮肤肿块。
2 结果
2.1 免疫后小鼠血清效价检测结果 从图1中可以看出,第3次免疫后小鼠血清效价在1∶64 000~1∶128 000,证明小鼠免疫成功,可以进行下一步细胞融合试验。将此血清按1∶4 000稀释后用作筛选试验的阳性对照。

图1 VEGF免疫小鼠血清效价检测
2.2 单克隆杂交瘤细胞株的建立 融合成功后,通过间接ELISA法筛选阳性孔,阳性孔的杂交瘤细胞再经过3次亚克隆,确保每个孔中细胞均是由1个细胞分裂而来。最终所有克隆孔的阳性克隆率达100%时,将该细胞株建系,如此方法得到1株杂交瘤细胞,命名为3B4。对该杂交瘤细胞株进行冻存,以用于后续试验。
2.3 抗体亚类鉴定及腹水产生 通过小鼠单克隆抗体亚类鉴定试剂盒进行检测,结果显示,杂交瘤细胞株3B4所分泌的抗体类型为Ig2a型。腹水纯化后,采用间接ELISA法对其进行效价测定。结果效价为1∶6 400,证明杂交瘤细胞在小鼠腹腔中成功分泌抗体,且纯化成功。
2.4 单克隆抗体的特异性检测
2.4.1 Western Blot检测结果 由图2可以看出3类肿瘤细胞在蛋白为27 kD大小位置均出现相应条带,与预期VEGF蛋白大小一致。因此初步判定纯化后的腹水抗体能识别并结合此3种肿瘤细胞中的VEGF蛋白。确定了所制备单克隆抗体的特异性。
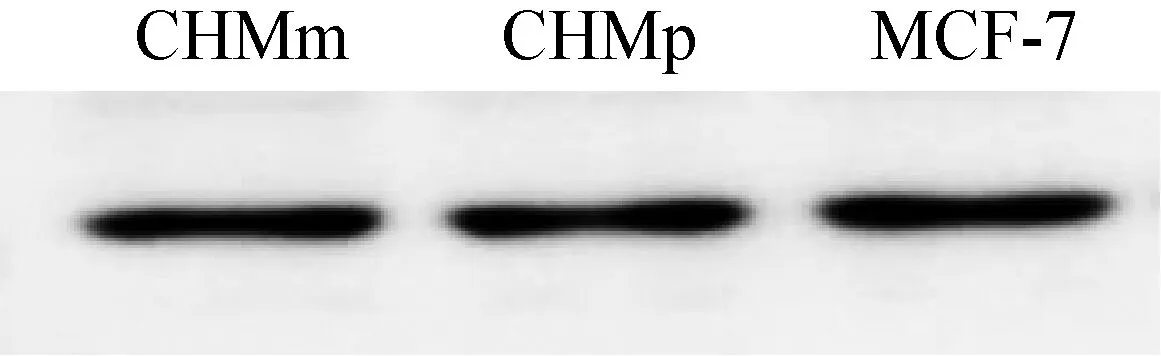
图2 Western Blot检测3B4所分泌抗体特异性
2.4.2 免疫荧光检测结果 如封二彩版图3所示,左图为FITC检测通道的细胞浆荧光信号,中图为FITC检测通道的细胞核荧光信号,右图为上述两图的合成。由封二彩版图3可知,3B4所分泌的抗体能在免疫荧光实验中检测到VEGF蛋白的表达,并且对于VEGF在细胞中所处的位置能起到指示作用。
2.5 ELISA检测方法的建立
2.5.1 单抗最佳包被浓度和多抗最佳稀释度的确定由表1我们可以得知当多抗以1∶1 400包被,单抗以1∶8 000稀释为ELISA双抗夹心的最佳工作浓度。
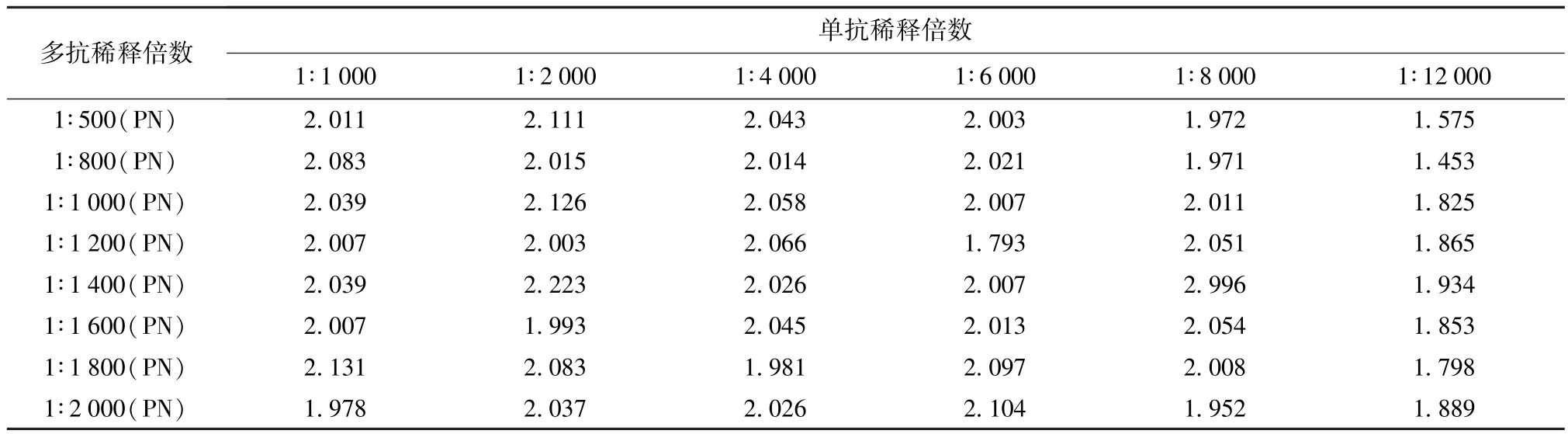
表1 单抗最佳包被浓度和多抗最佳稀释浓度
2.5.2 ELISA试剂盒阴阳性临界值的确定 由表2结果我们计算出:平均值为0.298,标准差为0.149,临界值为0.745,大于0.745为阳性,小于等于0.596为阴性,大于0.596且小于等于0.745为可疑,需重新检测样品,其中出现了一个可疑和2个假阳性样品,进一步验证后发现为阴性。
2.6 对临床收集的犬血清样本进行ELISA检测分析 用本研究制备的试剂盒对临床收集的96份样本进行验证。结果显示,阳性样本14份,阴性样本82份,而实际阳性样本为16份。其阳性符合率为87.5%,阴性符合率为97.56%。说明本研究制备的试剂盒具有较高的符合率。

表2 ELISA试剂盒阴阳性临界值的确定
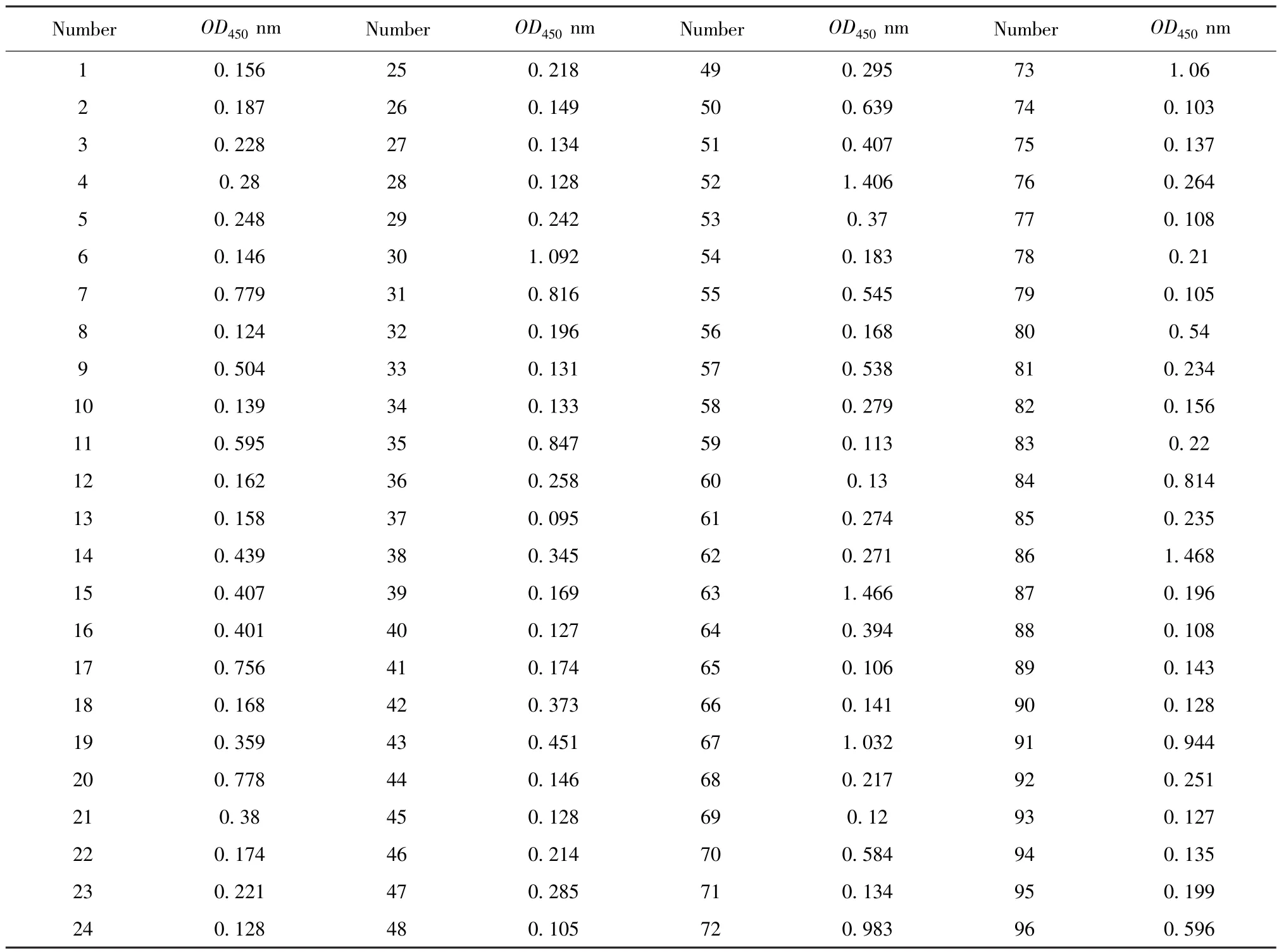
表3 犬血清ELISA检测分析
3 讨论
血管内皮生长因子作为血管生成开关的关键介质,通过参与多种血管生成过程,在肿瘤血管生成中起着核心作用,包括内皮细胞的存活、增殖、迁移和高通透性[13]。VEGF对肿瘤还有其他作用,包括抑制肿瘤细胞凋亡,刺激肿瘤转移,抑制抗肿瘤免疫反应和增加肿瘤血管的通透性,减少化疗药物对肿瘤的影响等[14]。
相关研究证实,血清VEGF在人类乳腺癌患者中呈现高表达,并且与乳腺癌的进展、转移和预后有关,血清VEGF可为乳腺癌的早期诊断、靶向治疗和预后评估提供理论依据[15]。了解在发展过程中血管内皮生长因子的调节作用也可以观察肿瘤的血管化,因为肿瘤在发展过程中利用器官或组织特异性的VEGF监管机制是非常有可能的。肿瘤血管化、生长和转移之间的明显联系导致了抗血管生成药物的发展。VEGF作为血管生成调节因子的核心,使它成为治疗的主要目标。且已经制备出抗人VEGF的单克隆抗体,此单抗在人医临床发挥着重要的作用。
一些研究表明,犬肿瘤分泌的VEGF能促进肿瘤细胞的存活[16-17]。犬乳腺肿瘤中,VEGF在mRNA和蛋白水平上的表达都有增加。VEGF高表达与不良的临床结果有关,包括降低生存率,还与化疗或放疗缺乏反应之间也有关联。因此临床上乳腺肿瘤患犬VEGF水平的检测,会对患犬的预后及治疗有指导性意义。但是犬VEGF的临床检测需要针对犬属VEGF的特异性抗体,目前在市面上销售的这种抗体价格比较昂贵且只适用于实验室检验,因此大量制备抗犬VEGF的单克隆抗体有应用价值,可为双抗夹心试剂盒的制备提供材料。在本研究中,将VEGF作为诊断标志物利用夹心酶联免疫吸附法检测其在肿瘤患犬中的表达,可为兽医临床犬肿瘤的早期诊断提供良好的诊断方法。
4 结论
综上所述,本研究成功制备了一种新的具有良好生物活性的鼠抗犬VEGF单克隆抗体3B4,该抗体能够特异性识别VEGF蛋白,并成功的制备了以该抗体为捕获抗体的双抗夹心ELISA检测试剂盒,此试剂盒具有良好的敏感性、特异性和重复性,且利用本试剂盒对临床样本进行验证时,阳性符合率为87.5%,阴性符合率为97.56%,具有较高的临床应用价值,有望应用于临床犬早期乳腺肿瘤的诊断和筛查以及治疗预后评价。
