阿德福韦混膦酯衍生物体外代谢及稳定性研究
2018-02-15傅晓钟
杨 洋,李 静,肖 涛,李 韬,傅晓钟
(贵州医科大学 1贵州省药物制剂重点实验室;2药学院;3国家苗药工程技术研究中心;4民族药与中药开发应用教育部工程研究中心,贵阳 550004)
阿德福韦酯(adefovir dipivoxil)为 FDA批准上市的由 Gilead Science 公司研制的第一个非环核苷膦酸酯类抗 HBV药物。但阿德福韦酯在临床使用中发现其具有剂量依赖性肾毒性及口服生物利用度低缺点,同时由于其分解产生的原药肝细胞摄取率低,使该药仅具有中等抗HBV活性[1],这些不足限制了阿德福韦酯在临床上的应用,为此,本课题组以前期设计的具有较低细胞毒性与较高抗病毒活性的阿德福韦双L-氨基酸酯为先导化合物,在其膦酸基团上引入具有肝靶向性转运特征的胆汁酸片段[2-3],合成阿德福韦单L-氨基酸酯、单胆酸酯衍生物[4]。前期研究表明,该类化合物不仅保留了抗HBV活性,还表现出较好的原代肝细胞摄取特性与肝组织靶向性分布能力[5]。目前国内外无此类衍生物的体内外代谢研究报道。为了预测该药物在人体内的稳定性,为该类药物合理用药提供理论依据,根据药物口服后涉及的器官及组织,依次选用人工胃液、人工肠液、大鼠空白血浆及肝微粒体等孵育体系来模拟药物在体内各个环境中的稳定性,同时初步考察药物在肝微粒体中的生物转化。本研究通过UPLC-MS/MS检测方法考察阿德福韦单L-硫代异亮氨酸乙酯、单去氧胆酸丙酯(Q3-I2)的化学及体外代谢稳定性,为其后续体内实验方案制定提供理论参考,通过UPLC-QTOF-MS检测化合物在肝微粒体中的代谢产物,为其体内代谢机制研究及药动学研究奠定基础。
1 材 料
1.1 药品与试剂
阿德福韦单L-硫代异亮氨酸乙酯、单去氧胆酸丙酯(Q3-I2)(纯度≥98%,结构式见图1)由贵州医科大学傅晓钟教授课题组自主合成。阿德福韦酯(纯度≥98%,中国食品药品检定研究院);葛根素(纯度≥98%,四川省维克奇生物科技有限公司);β-NADPH(批号1113N021,北京索莱宝科技有限公司);磷酸二氢钾、磷酸氢二钾、氯化钾、甘油、BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司);胃蛋白酶、胰蛋白酶、大鼠肝微粒体(自提);甲醇、乙腈(德国默克公司),其他试剂均为分析纯级试剂。
1.2 仪 器
超高效液相色谱-串联质谱(Acugity-TQD,美国沃特世公司公司);电喷雾四极杆串联飞行时间质谱仪(UPLC-QTOF-Xevo-G2-XS,Waters);Allegra 64R台式冷冻离心机、Optimxpn-100超高速离心机(美国贝克曼库尔特公司);AE240电子天平(梅特勒-托利多仪器上海有限公司)。
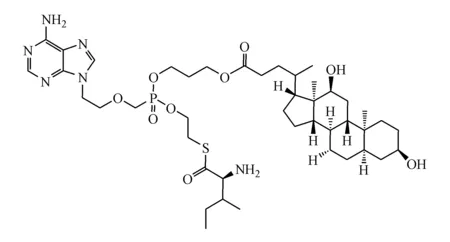
Figure1 Chemical structures of the adefovir mixed phosphonate derivative,Q3-I2
2 方 法
2.1 色谱条件
UPLC-MS/MS色谱条件:采用Acquity UPLC BEH C18柱(2.1 mm×50 mm,1.7 μm);流动相为:A:0.1%甲酸乙腈,B:0.1%甲酸水。流速为0.25 mL/min,梯度洗脱:(0~1 min,5% A;1~4 min,5%~95% A;4~5 min,95%,5~6 min,95%~5% A),柱温40 ℃,进样体积3 μL。
UPLC-Q-TOF-MS色谱条件:Acquity Eclipse Plus C18RRHD柱(2.1 mm×100 mm,1.7 μm);流动相为:A:0.1%甲酸乙腈,B:0.1%甲酸水。流速为0.25 mL/min,梯度洗脱:(0~1 min,5% A;1~16 min,5%~95% A;16~18 min,95% A,18~20 min,95%~5% A),柱温40℃,进样体积1 μL。
2.2 质谱条件
UPLC-MS/MS质谱条件:采用多反应离子监测(MRM),正离子模式(ESI+),碰撞气流量:0.16 mL/min;毛细管电压:3 kV,离子源温度:120 ℃;喷雾气与反吹气:氮气,去溶剂气流速:650 L/h,去溶剂气温度:350 ℃,反吹气流速为50 L/h。定量离子对:m/z879.46→433.33(Q3-I2);m/z502.2→256.1(阿德福韦酯);m/z417.0→267.0(内标)。质谱数据采集及处理软件为MassLynx V4.1工作站。
UPLC-Q-TOF-MS质谱条件:电喷雾离子源,扫描方式为正负离子扫描(ESI+/-,m/z50~1 500),毛细管电压:ESI+(5 kV)、ESI-(4 kV)、离子源温度:200 ℃,雾化气(N2)压力:1.2 bar(1 bar=0.1 MPa),干燥气温度:200 ℃,气体体积流量:6 L/min。数据分析:Data Analysis软件、Metabolite Tools®、质量亏损过滤(MDF)。
2.3 方法学考察
2.3.1 标准曲线和定量限实验 精密称取Q3-I2、阿德福韦酯适量,置于10 mL量瓶中,甲醇溶解后定容,作为储备液,分别稀释成质量浓度为10 000,5 000,2 500,1 250,312.5,78.1 ng/mL的工作液。另精密称取内标适量,置于50 mL量瓶中,甲醇溶解配制成10 ng/mL的内标溶液。按“2.4”项下各孵育体系处理每个样品重复测定3次,计算标准曲线方程。
2.3.2 精密度和准确度实验 按标准曲线配制方法配制Q3-I2、阿德福韦酯质量浓度分别为10 000、1 250、78.1 ng/mL的质控样品,每个质量浓度平行配制5份。按各孵育体系要求加入一定量空白血浆、大鼠肝微粒体、人工肠液、人工胃液,按“2.4”项下操作,连续测定3 d,计算化合物峰面积与内标峰面积比值,带入随行标曲求得实测质量浓度和实测质量浓度准确度,计算日内、间精密度和配制质量浓度比较得到方法的准确度。
2.3.3 回收率实验 取Q3-I2、阿德福韦酯质控样品的工作液1 μL,加入各孵育体系规定的空白血浆、肝微粒体、人工肠液、人工胃液涡旋30 s,余下按“2.4”项下样品处理方法处理,每个样品平行5份,计算各质量浓度样品和内标的峰面积比值A;另取Q3-I2、阿德福韦酯质量浓度质控样品的工作液加入甲醇100 μL涡旋30 s,余下按“2.4”项下样品处理方法处理,计算各质量浓度样品和内标峰面积比值B。A与B的比值即为化合物在各孵育体系中的提取回收率。
2.4 体外代谢稳定性考察
肝微粒体孵育体系:差数离心法制备肝微粒体[6],采用BCA法[7]测得肝微粒体悬浮液的蛋白浓度。将大鼠肝微粒体(0.5 mg/mL)、β-NADPH(1 mmol/L)、UDPGA(2 mmol/L)、PBS(50 mmol/L,pH 7.4)MgCl2(4 mmol/L)于37 ℃预孵育5 min,体系中加入目标化合物Q3-I2(100 μmol/L)或阿德福韦酯(100 μmol/L)启动反应。每个样品平行3次,孵育总体积100 μL,于启动反应后0,5,10,15,30,60 min加入含内标的冰乙腈400 μL终止反应,涡旋30 s,10 000 r/min离心10 min,取上清液氮气吹干,100 μL甲醇复溶,10 000 r/min离心10 min取上清液待测,进样体积3 μL。
血浆体系:将大鼠空白血浆(80 μL)与等渗PBS(pH 7.4)预孵育5 min,体系中加入目标化合物Q3-I2(100 μmol/L)或阿德福韦酯(100 μmol/L)启动反应。每个样品平行3次孵育总体积100 μL,于启动反应后0,5,10,15,30,60,120 min加入含内标的冰乙腈400 μL终止反应,样品处理待测。
2.5 化学稳定性考察
将人工胃液、人工肠液(按照《中华人民共和国药典》2015版配制)于37 ℃预孵育5 min,加入目标化合物Q3-I2(100 μmol/L)或阿德福韦酯(100 μmol/L)启动反应。每个样品平行3次,孵育总体积为100 μL,人工胃液样品于0,1,2,4 h终止反应,人工肠液体系于0,1,2,4,6 h加入含内标的冰乙腈400 μL终止反应,按“2.4”项下样品方法处理待测。
2.6 肝微粒体代谢
按照“2.4”项下肝微粒体体系孵育,于启动反应后的5、10、20、30、60、90 min加入冰乙腈400 μL终止反应,涡旋30 s,10 000 r/min离心10 min,取上清液,合并各时间点上清液用氮气吹干,按“2.4”项下处理得肝微粒体体系代谢产物样品,进样体积1 μL。空白对照组于“2.4”项下启动反应前加入终止剂,其他操作不变。
3 结 果
3.1 方法学验证
在本研究的分析条件下,各孵育体系中的其他物质不干扰Q3-I2、阿德福韦酯及内标的测定。以待测物质量浓度为横坐标,待测物与内标的峰面积比值为纵坐标,采用最小二乘法进行线性回归,得到Q3-I2在空白血浆、大鼠肝微粒体、人工胃液、人工肠液孵育体系中的回归方程为:y=0.012 5x+0.992 3(r=0.999 0);y=0.019 1x+1.178 6(r=0.999 5);y=0.049 7x+4.262 6(r=0.999 5);y=0.039 8x+3.298 6(r=0.999 5),定量限分别为7.8,5.2,1.95,1.95 ng/mL,阿德福韦酯在空白血浆、大鼠肝微粒体、人工胃液、人工肠液孵育体系中的回归方程为:y=0.002 6x+0.583 9(r=0.999 5);y=0.007 9x+1.810 1(r=0.999 5);y=0.010 7x+2.265 1(r=0.999 0);y=0.010 7x+2.265 1(r=0.999 0),二者在所列的质量浓度范围内线性关系良好。Q3-I2和阿德福韦酯的各孵育体系的日内精密度和日间精密度在1.2%~3.96%之间,准确度在96.6%~101.3%之间,各体系提取回收率在87%~95%之间,表明所建立的方法能够满足孵育液中Q3-I2和阿德福韦酯定量检测的要求。
3.2 稳定性
采用一点法[8]定量,以各时间点原型药(目标化合物:Q3-I2;阳性对照药阿德福韦酯:ADV)剩余质量浓度相对于初始质量浓度的百分比对时间作图(图2)。
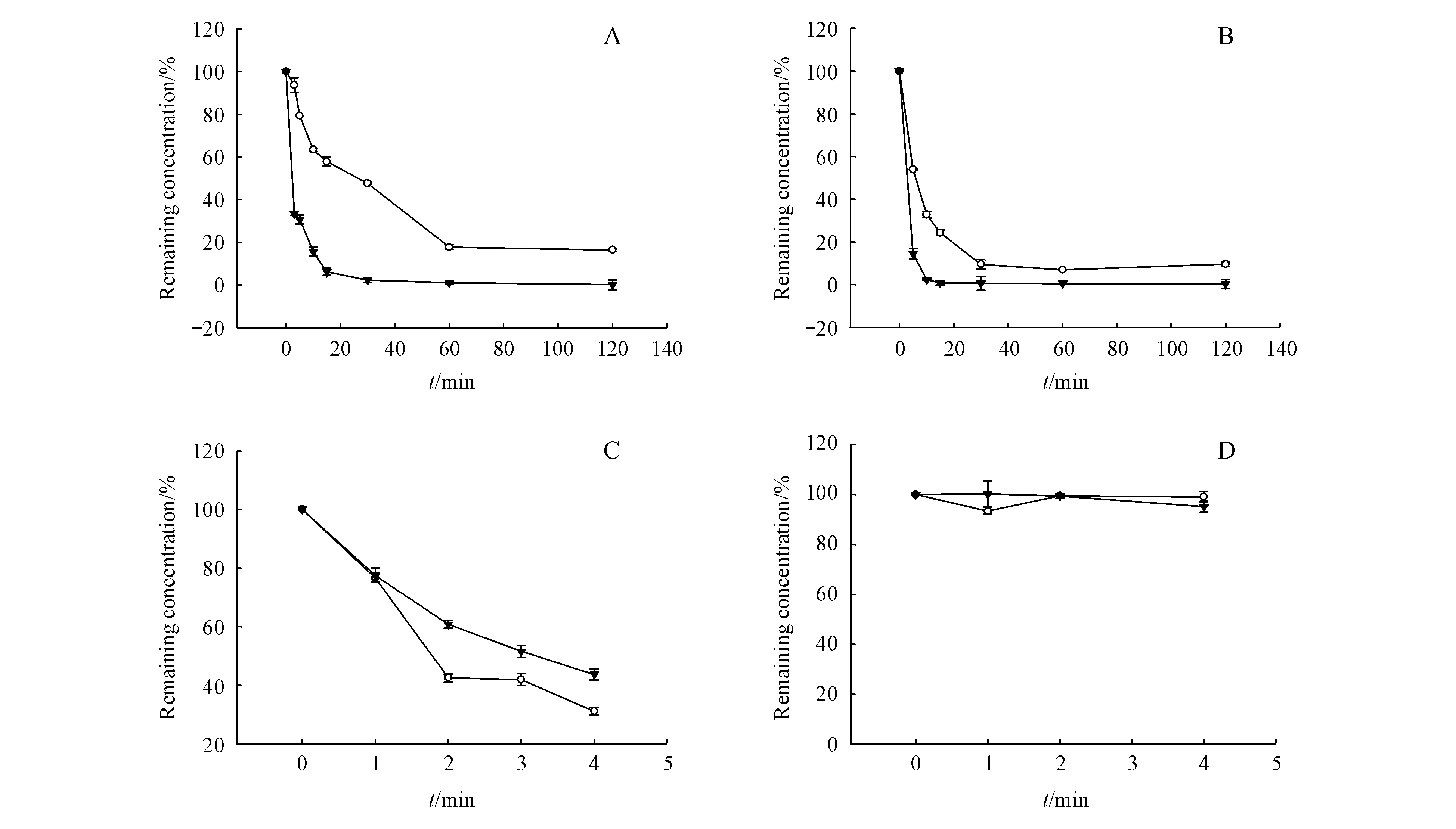

以质量浓度的自然对数(lnc)对反应时间(t)进行线性回归,消除速率常数Ke为直线斜率,消除半衰期t1/2=0.693/Ke,清除率CLint(L/min·g)=693/[t1/2(min)×蛋白浓度(g/L)]。受试化合物相应参数见表1。
Table1 Metabolic elimination corresponding parameters of tested compounds in SD rat liver microsomes
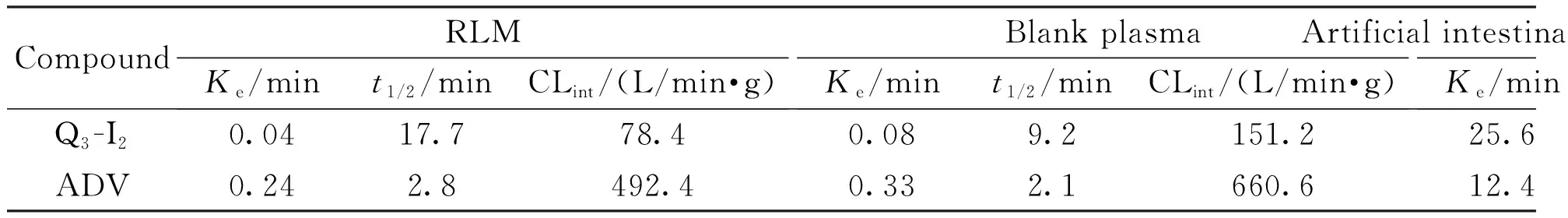
CompoundRLMKe/mint1/2/minCLint/(L/min·g)Blank plasmaKe/mint1/2/minCLint/(L/min·g)Artificial intestinal fluidKe/mint1/2/minCLint/(L/min·g)Q3-I20.0417.778.40.089.2151.225.697.214.3ADV0.242.8492.40.332.1660.612.4201.26.9
3.3 Q3-I2的质谱行为
在上述质谱色谱条件下,化合物在正模式下的二级质谱图(图3),主要碎片有m/z706.399 8,433.332 4,332.113 5,274.068 4和256.057 8。其裂解途径见图4。
3.4 代谢产物分析
按照“2.6”项下处理得到空白样品和孵育样品,利用UPLC-Q-TOF-MS的MS Scan模式分别对两个样品进行正负离子模式扫描,通过运用Metabolite tools软件的Metabolite Predict对阿德福韦混膦酯衍生物Q3-I2进行代谢产物分析,将代谢产物Mass List导入Metabolite Detect,通过软件计算得到正负模式下化合物的代谢差异图谱见图5(正模式)和图6(负模式)。结合手动比对确定代谢产物并记录其m/z和tR,再利用UPLC-Q-TOF-MS MRM模式对代谢产物进行二级质谱检测,结果见表2(正模式)和表3(负模式)。
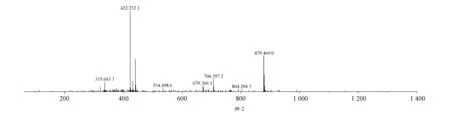
Figure3 MS/MS spectrum of Q3-I2in positive mode
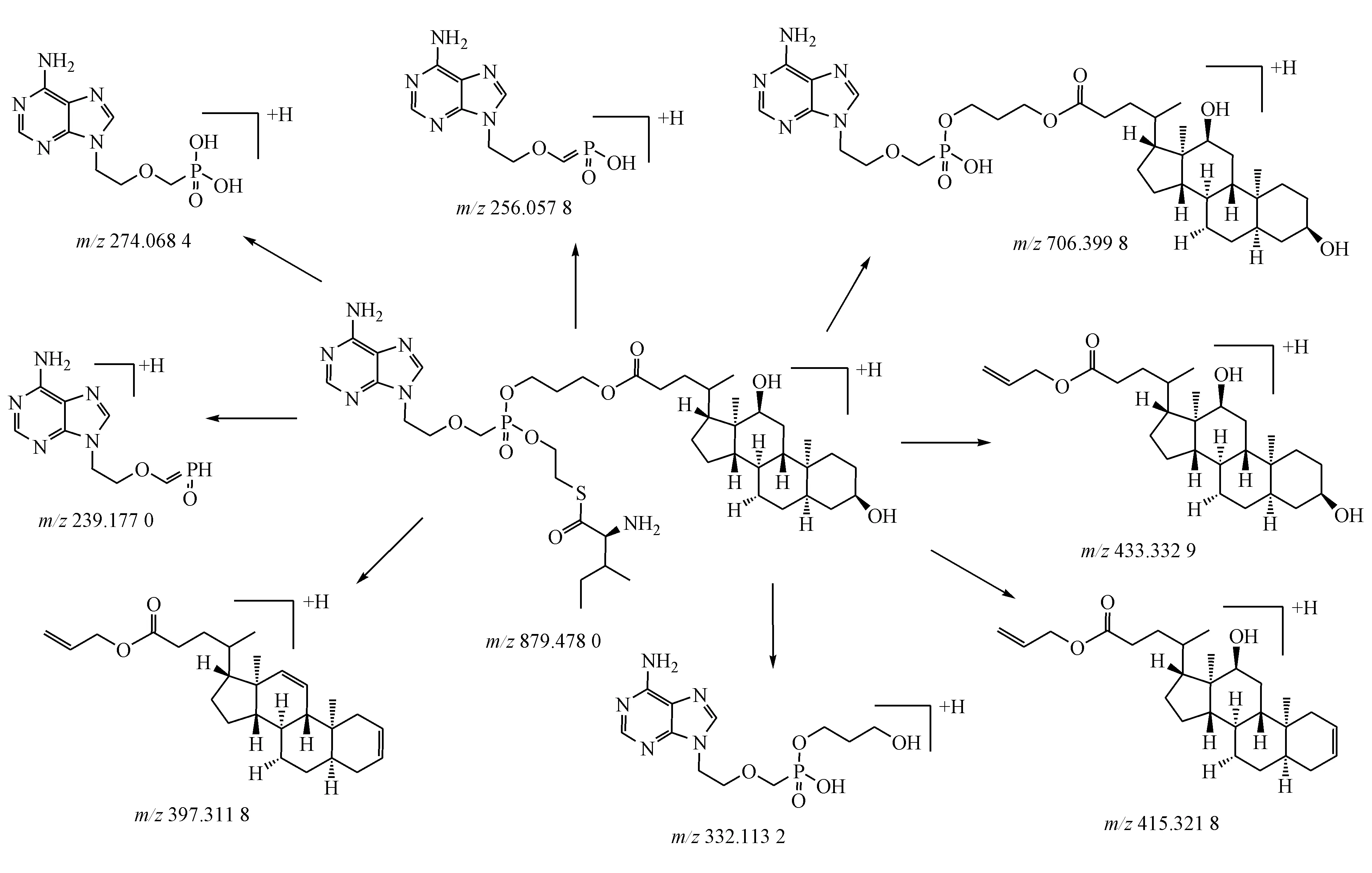
Figure4 Tentative MS/MS fragmentation pattern of Q3-I2
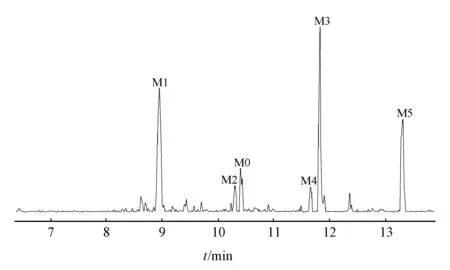
Figure5 Metabolic difference chromatogram of compounds in positive mode
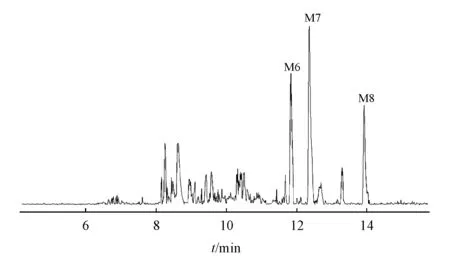
Figure6 Metabolic difference chromatogram of compounds in negative mode
Table2 UPLC-QTOF-MS data for Q3-I2metabolites detected in RLM with ES+

IDBiotrasfor-mationtR/min[M+H]+ErrorFormulaFragment ionsM0Parent10.4879.478 0-4.4C43H71N6O9PS706.399 8,433.332 4,332.113 5,274.068 4,256.057 8M1Double Hydrolysis8.9274.068 82.2C8H12N5O4P256.257 6,136.054 5M2Hydrolysis and Aldolization10.3420.122 84.7C13H26N5O6PS350.071 9,344.121 7,318.294 8,256.258 1,229.065 2M3Hydrolysis and Carbonyla-tion11.8502.181 70.7C19H31N6O6PS388.484 5,340.277 7,318.291 4,256.268 3M4Hydrolysis and Hydroxyl-ation11.6706.388 42.4C35H56N5O8P433.338 9,332.117 4,274.068 9,213.175 1M5Hydrolysis13.3766.392 12.7C37H60N5O8PS392.107 7,334.066 2,274.063 6,256.266 3
Table3 UPLC-QTOF-MS data for Q3-I2metabolites detected in RLM with ES-

IDBiotrasfor-mationtR/min[M-H]-ErrorFormulaFragment ionsM6Glucuronidation and acetyla-tion8.7721.2351-1.8C27H43N6O13PS545.202 6,177.048 1,314.073 4,272.062 8,372.114 8M7Acetylation11.9806.40130.8C39H62N5O9PS432.118 7,272.065 4,374.078 6,314.075 4M8Glucuronidation12.4854.59440.9C31H49N6O9PS177.047 9,503.192 0,679.239 2,682.168 6,174.103 8
药物通过不同的生物转化会发生一系列改变,产生与原型药物结构相同或相似的Ⅰ、Ⅱ相代谢产物,并且其代谢产物具有与原型药物相同的特征性裂解碎片,因此对代谢产物的鉴定可利用二级碎片离子或者碎片离子间的质量差进行分析[9]。
M4在上述质谱色谱条件下保留时间tR为11.6 min其m/z706.388 4[M]+,对其进行MRM模式检测其碎片离子为m/z433.338 9,332.117 4,274.068 9,213.175 1与母体化合物的二级碎片离子一致,故可推测M5为其代谢产物,通过特征性碎片m/z433.338 9,274.068 9结合母体化合物的质谱裂解规律可以初步判定代谢产物M5为氨基酸酯部分的P-O键断裂然后羟基化产生。通过软件对M4的m/z进行结构式拟合得出分子式为C35H56N5O8P,误差为2.4。
M2保留时间tR为10.3 min,m/z420.122 8[M]+其二级质谱碎片离子有m/z350.071 9,344.121 7,318.294 8,256.258 1,229.065 2,根据m/z256.258 1可推测M2为母体化合物的代谢产物,同时可初步判定代谢位点不在阿德福韦结构上,m/z344.121 7与母体化合物的碎片m/z332.113 5相差12,根据化合物结构可初步推断化合物的胆酸酯水解后羟基被醛酸化,m/z350.071 9碎片为氨基酸酯的硫酯键断裂后裸露出的巯基进一步氧化成亚砜。初步判断M2为母体化合物的代谢产物,进一步结合软件分析得出分子式C13H26N5O6PS,误差为4.7。
M1的m/z为274.068 8[M]+保留时间tR为8.9 min与阿德福韦对照品保留时间一致且质谱裂解规律一致,可初步判定代谢产物M1为活性代谢产物阿德福韦。
M3保留时间tR为11.8 min,m/z502.181 7[M]+其二级质谱碎片离子有m/z388.484 5,340.277 7,318.291 4,256.268 3,根据m/z256.268 3可推测M3为母体化合物的代谢产物,M3的特征碎片提示母体化合物通过胆酸酯键的水解后末端羟基被羰基化产生代谢产物M3。
M5保留时间tR为13.3 min,m/z392.107 7,334.066 2,274.063 6,256.266 3,根据其二级碎片离子与母体化合物的碎片离子的相似性和质量差,按照上述分析方法,初步推断M5代谢产物为母体化合物氨基酸酯部分的硫酯键断裂生成。
M6在负模式检测下保留时间tR为8.7 min,m/z721.235 1[M]-,其二级质谱碎片离子有m/z545.202 6,177.048 1,314.073 4,272.062 8,372.114 8。根据m/z272.062 8可判定M6为母体化合物的代谢产物,m/z177.048 1碎片提示化合物可能发生了葡萄糖醛酸化发应,545.202 6比阿德福为氨基酸酯部分多了42,提示这部分可能发生乙酰化反应,鉴于氨基酸酯部分的氨基存在空间位阻,初步判定为嘌呤环上氨基被乙酰化,结合545,2 026碎片和软件对化合物相对分子质量进行结构拟合,可推测M6为胆酸酯部分酯键水解裸露羟基发生葡萄糖醛酸化和嘌呤环氨基乙酰化反应的产物。
M7保留时间tR为11.9 min,m/z806.401 3[M]-其二级质谱碎片离子有m/z432.118 7,272.065 4,374.078 6,314.075 4,M7和母体化合物的代谢产物M5相差42,提示可能发生乙酰化反应,结合M7特征性碎片初步判断为母体化合物嘌呤环氨基发生乙酰化反应生成。
M8保留时间tR为12.4 min,m/z854.594 4[M]-其二级质谱碎片离子有m/z177.047 9,503.192 0,679.2392,682.168 6,174.103 8,m/z177.047 9为葡萄糖醛酸化化合物特征碎片,提示M8可能为葡萄糖醛酸化产物,根据M6的碎片545.202 6,提示其中一个反应位点在嘌呤环上的氨基位,679.239 2与母体化合物的碎片质量差提示另一葡萄糖醛酸位点在胆酸酯部分水解的羟基位上,最后结合软件拟合出分子式符合度为100%,误差为0.9。
4 讨 论
本实验建立了UPLC-MS/MS及UPLC-QTOF-MS方法分别测定目标化合物及对照药阿德福韦酯在生物样品中的含量及Q3-I2在肝微粒体中的代谢产物,并对两者进行稳定性研究,稳定性研究结果显示Q3-I2在空白血浆、大鼠肝微粒体、人工肠液中的半衰期分别为17.7,9.2,97.2 min,阿德福韦酯的半衰期分别为2.8,2.1,201.2 min,提示在空白血浆及大鼠肝微粒体中Q3-I2较阿德福韦酯稳定,在人工胃液中Q3-I2和阿德福韦酯均稳定,提示二者将以原型在胃中被吸收或进入十二指肠。肝微粒代谢产物实验中检测到代谢产物M1的m/z为274.068 8,根据其保留时间与阿德福韦相同可初步判断,代谢产物M1为活性代谢产物阿德福韦,可初步判定Q3-I2能在肝微粒体中转化为有活性的代谢产物。前药在体内除了转化为原药外,同时还存在其他的生物转化方式,因此除了关注在体内具有一定暴露量的前药和原药,同时需对其体内外可能的代谢产物进行结构分析和毒性研究[10],本实验通过建立UPLC-QTOF-MS/MS方法代谢产物进行正负离子模式检测,一共检测到8类化合物,通过其二级碎片与母离子碎片的相似性和质量差异,结合软件对结构进行解析,其代谢方式主要包括水解、氧化、乙酰化、葡萄糖醛酸化。因其代谢产物微量无法进行体外毒性测试,后期将会通过化学合成方法进行代谢产物合成并通过核磁和质谱分析进行结构确证和代谢产物毒性试验。
