Anisopus mannii 叶的化学成分和抑制黑色素生成活性研究
2018-02-15吕青林祝婉芳
叶 峰,吕青林,祝婉芳,冯 锋,2,张 杰*
(1中国药科大学中药学院,南京210009;2江苏食品药品职业技术学院,淮安223003)
黑色素是由动物黑色素细胞合成,可以吸收紫外线而保护皮肤免受紫外线的伤害,紫外线的照射会加速黑色素的合成。目前,美白逐渐成为人们审美的标准,消费者越来越青睐天然温和无刺激、安全有效的美白产品,而市场上主要的美白产品为色素合成的抑制剂例如熊果苷、曲酸等[1],但曲酸会引发肿瘤,熊果苷对黑色素的抑制受浓度限制,即在某个合适浓度下其抑制黑色素的合成,该浓度外则会增加黑色素的含量[2-3]。因此,寻找新型的美白剂仍具有重要的意义。
Anisopusmannii为萝藦科(Asclepiadaceae)植物,其主要分布于非洲,在尼日利亚北部,它作为具有传统的药用功效而被人们熟知,其药用价值主要集中于糖尿病、腹泻等。在喀麦隆,因其具有鱼毒性而被用来当捕鱼的诱饵[4]。现代药理学研究表明,其具有抗氧化[5]、抗炎镇痛[6]、降血糖[7]和抑制病原微生物[8]等活性,而关于Anisopusmannii的成分研究较少,目前从Anisopusmannii中分离得到的成分主要有生物碱类、萜类[9]等,从已分离得到的化合物和本文中分离得到化合物中大部分均为含有醇羟基或酚羟基的结构,结合本课题组前期针对抑制黑色素生成活性研究基础[10-12],发现化合物结构中含有醇羟基或酚羟基结构时,多数会显示有较强的抑制黑色素生成活性。本研究采用硅胶、ODS和大孔树脂等柱色谱分离方法和NMR、MS等手段对该植物干燥叶的化学成分进行研究,并且探索了其抑制黑色素分泌的活性,对该植物进一步的药效物质基础的研究提供依据。
1 材 料
1.1 材料与试剂
Anisopusmannii植物由Dr.Zaruwa Zira Moses(Adamawa state university)于尼日利亚采集所得。小鼠黑色素瘤细胞(B16)购自日本Riken细胞库,其他所有试剂均符合相应仪器或实验要求。
1.2 仪 器
核磁共振波谱仪(德国Bruker公司400 MHz仪器,以TMS为内标);高分辨质谱仪(Agilent 1100 series LC-MS);分析型高效液相(Shimadzu LC-20AT系列);分析柱(Shimadzu VP-ODS,250 mm×4.6 mm);CAX-370型离心机(日本Tomy Seiko公司);酶标仪(美国BioTek公司);XD-101型CO2培养箱(日本SANYO公司);XD-202型倒置显微镜(南京江南永新光学有限公司)。
2 提取和分离
Anisopusmannii的干燥叶用MeOH加热回流得总浸膏48.5 g,H2O和EtOAc分别萃取,EtOAc层浸膏用n-Hexane和MeOH-H2O(8∶2)分别萃取得n-Hexane层萃取部位5.0 g,MeOH-H2O萃取部位17.3 g,H2O层用n-BuOH萃取得n-BuOH萃取部位8.3 g,H2O层14.9 g。
n-Hexane部位:用硅胶(50.0 g)柱色谱方法分离,Hexane/EtOAc(1∶0→0∶1)洗脱得到5个洗脱组分(HFr.1~HFr.5)。HFr.2(Hexane-EtOAc,9∶1洗脱所得)用硅胶(17.5 g)柱色谱方法分离,Hexane-EtOAc(1∶0→0∶1)洗脱得到6个洗脱组分(HFr.2-1~HFr.2-6),通过RP-HPLC分离HFr.2-2(Hexane-EtOAc,9.5∶0.5洗脱所得)得到化合物1(1.9 mg);HFr.3(Hexane-EtOAc,7∶3洗脱所得)用硅胶(50.5 g)柱色谱方法分离,Hexane-EtOAc(1∶0→0∶1)洗脱得到8个洗脱组分(HFr.3-1~HFr.3-8),继续用硅胶(5 g)对HFr.3-2(Hexane-EtOAc,9∶1洗脱所得)进行柱色谱分离,Hexane-EtOAc(1∶0→0∶1)洗脱得到5个洗脱组分(HFr.3-2-1~HFr.3-2-5),通过RP-HPLC分离HFr.3-2-3(Hexane-EtOAc,8.5∶1.5洗脱所得)得到化合物2(4.2 mg)。
MeOH-H2O部位:用DIAION HP-20(600.0 g)柱色谱方法分离,H2O-MeOH(1∶0→1∶9)洗脱得到6个洗脱组分(MFr.1~MFr.6),继续用硅胶(50.0 g)对MHFr.4(H2O-MeOH,5∶5)洗脱所得)进行柱色谱分离,CHCl3-MeOH(1∶0→0∶1)洗脱得到15个洗脱组分(MHFr.4-1~MHFr.4-15),继续用ODS(4.5 g)对MHFr.4-6(CHCl3-MeOH,8∶2洗脱所得)进行柱色谱分离,H2O-MeOH(9∶1→7∶3)洗脱得到两个组分(MHFr.4-6-1~MHFr.4-6-2),通过RP-HPLC分离MHFr.4-6-2得到化合物3(3.2 mg);MHFr.4-8(CHCl3-MeOH,8∶2洗脱所得)用硅胶(22.3 g)进行柱色谱分离,CHCl3-MeOH(1∶0→0∶1)洗脱得到6个组分(MHFr.4-8-1~MHFr.4-8-6),继续用ODS(1.1 g)对MHFr.4-8-4(CHCl3-MeOH,8.5∶1.5洗脱所得)进行柱色谱分离后,通过RP-HPLC分离MHFr.4-8-4-2组分得到化合物4(4.3 mg);MHFr.6(H2O-MeOH,1∶9)用硅胶(200.0 g)进行柱色谱分离,CHCl3-MeOH(1∶0→0∶1)洗脱得到9个组分(MHFr.6-1~MHFr.6-9),通过RP-HPLC对MHFr.6-6(CHCl3-MeOH,7∶3洗脱所得)组分进行分离得到化合物5(4.3 mg);n-BuOH部位:用硅胶(450.0 g)柱色谱方法分离,CHCl3-MeOH(1∶0→0∶1)洗脱得到9个组分(BuFr.1~BuFr.9),继续用硅胶(130.0 g)对BuFr.1(CHCl3/MeOH 1∶0洗脱所得)进行柱色谱分离,CHCl3-MeOH,4∶6→CHCl3-MeOH,0∶1洗脱得到8个组分(BuFr.1-1~ BuFr.1-8),通过RP-HPLC分离BuFr.1-5(CHCl3-MeOH,5∶5 洗脱所得)得到化合物6(92.6 mg);BuFr.7(CHCl3-MeOH,3∶7洗脱所得)用Sephadex LH-20(5.0 g)进行柱色谱分离,H2O-MeOH(1∶0→0∶1)洗脱得到9个组分(BuFr.7-1~BuFr.7-9),继续用硅胶(28.0 g)对BuFr.7-6组分进行柱色谱分离,CHCl3-MeOH(9∶1→1∶9)洗脱得到6个组分(BuFr.7-6-1~ BuFr.7-6-6),对BuFr.7-6-4采用硅胶柱色谱进一步分离,通过RP-HPLC分离得到化合物7(5.4 mg)。
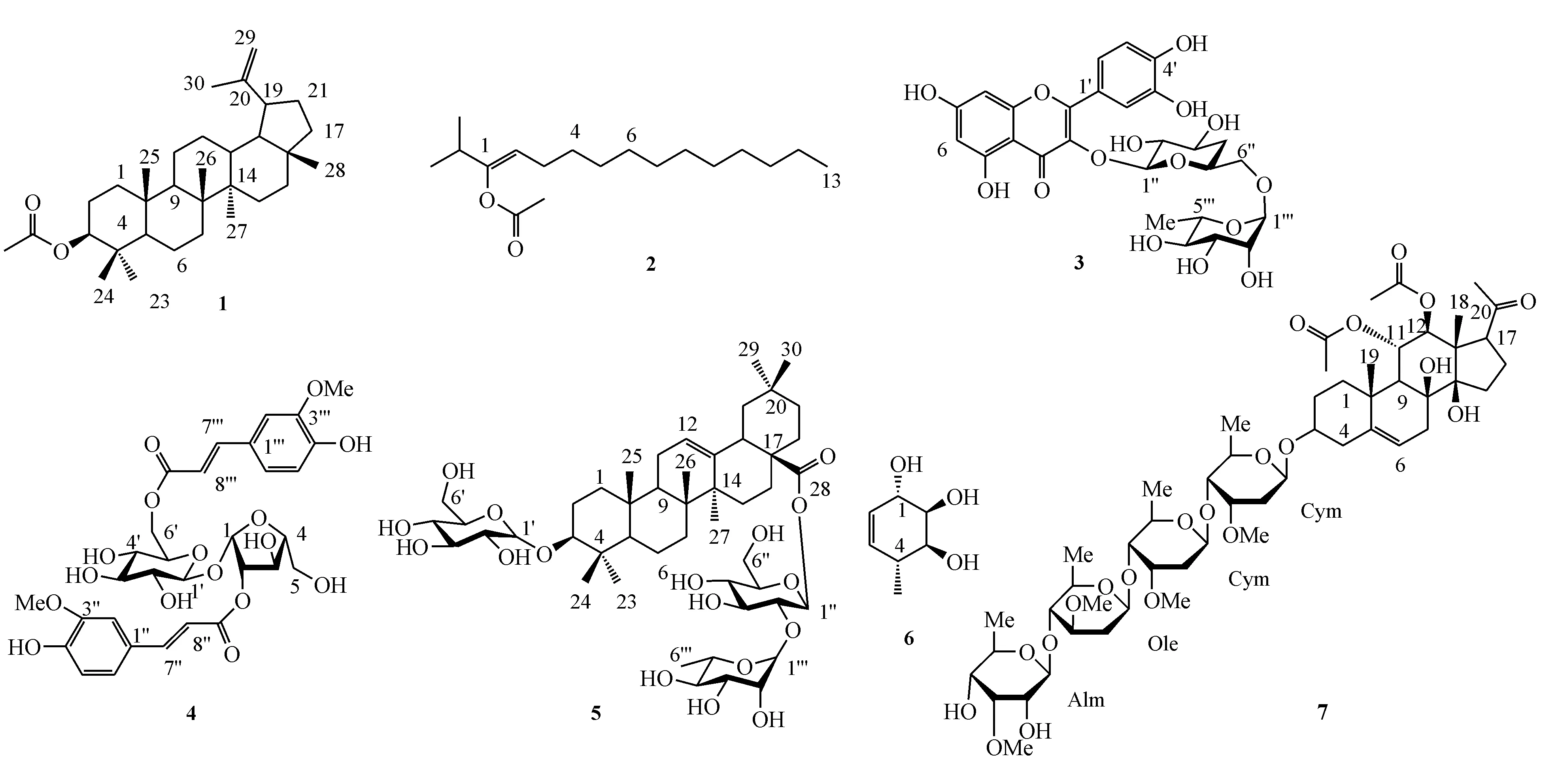
Figure1 Structures of compounds1-7from the leaves ofAnisopusmannii
3 结构鉴定
化合物1无色油状,5%硫酸乙醇加热显紫红色。1H NMR(CDCl3,400 MHz)δH:0.76(1H,dd,J=5.8,10.8 Hz,C5-H),0.82~1.66(m),1.83(m),2.33(1H,dd,J=5.6,11.1 Hz,C19-H),4.44(1H,dd,J=5.8,10.8 Hz,C3-H),4.66(2H,br.s,C29-H)。13C NMR(100 MHz,CDCl3)δC:14.5(C-27),17.9(C-28),18.1(C-6),19.0(C-30),20.9(C-10),23.7(C-1),25.0(C-11),27.4(C-14),35.5(C-15),37.0(C-9),37.7(C-2),38.0(C-12),42.8(C-13),50.3(C-8),55.3(C-4),80.9(C-3),109.3(C-29),150.9(C-20)。HR-ESI-MS Calcd.for C32H52O2[M+H]+:469.396 6;Found:469.397 2。与文献[13]对照,鉴定化合物1为3β-acetoxylup-20(29)-ene。
化合物2淡黄色油状,5%硫酸乙醇加热显黄色。1H NMR(CD3OD,400 MHz)δH:0.9(6H,d,J=13.7 Hz,C1-C(CH3)2),1.3(s),2.2(3H,d,J=15.1 Hz,CH3CO),5.3(1H,s,C2-H)。HR-ESI-MS Calcd.for C18H34O2[M+H]+:283.259 2;Found:283.258 0。与文献[14]对照,鉴定化合物2为1-acetoxy-2-isopropyl-1-tridecene。
化合物3黄色固体结晶,mp:176~177 ℃。1H NMR(CD3OD,400 MHz)δH:1.00(3H,d,J=6.2 Hz,C6‴-H),3.09(2H,m,C4″-H),3.28(1H,m,C5″-H),3.29(2H,m,C6″-H),4.39(1H,s,C1‴-H),5.09(1H,d,J=7.1 Hz,C1″-H),6.19(1H,d,J=2.1 Hz,C6-H),6.38(1H,d,J=2.1 Hz,C8-H),6.86(1H,d,J=8.5 Hz,C5′-H),7.64(1H,dd,J=2.1,8.5 Hz,C6′-H),7.76(1H,d,J=2.1 Hz,C2′-H)。HR-ESI-MS Calcd.for C27H30O16[M+H]+:611.156 5;Found:611.157 0。与文献[15]对照,鉴定化合物3为rutin。
化合物45%硫酸乙醇加热显黄色,1H NMR(CD3OD,400 MHz)δH:3.72(3H,s,OCH3),3.73(3H,s,OCH3),4.43(1H,dd,J=6.87,6.87 Hz,C3′-H),4.45(2H,dd,J=2.3,9.6 Hz,C6′-H),4.72(1H,dd,C4-H),6.02(1H,d,J=15.6 Hz,C3-H),6.13(1H,d,J=1.96 Hz,C1′-H),6.62(1H,d,J=8.7 Hz,C8″-H),6.86(1H,d,J=8.7 Hz,C8‴-H),7.10(1H,d,J=8.7 Hz,C7″-H),8.09(1H,d,J=8.7 Hz,C7‴-H)。HR-ESI-MS Calcd.for C31H36O16[M+H]+:665.203 3;Found:665.205 8。与文献[16]对照,鉴定化合物4为3,6′-diferuloylsucrose。
化合物5白色晶体,mp:221~222 ℃。5%硫酸乙醇加热显紫色,1H NMR(CD3OD,400 MHz)δH:0.76(1H,m,C5-H),0.79(3H,s,C26-H),0.84(3H,s,C24-H),0.90(3H,s,C29-H),0.93(3H,s,C30-H),0.95(3H,s,C25-H),0.98(2H,m,C1-H),1.02(2H,m,C2-H),1.04(3H,s,C23-H),1,15(3H,s,C27-H),1,21(2H,m,C21-H),1.25(3H,d,J=6.6 Hz,C6‴-H),1.31(2H,s,C19-H),1.46(2H,m,C22-H),1.55(2H,m,C6-H),1.57(1H.m,C9-H),1.65(2H,m,C7-H),1.68(2H,m,C15-H),2.81(1H,dd,J=3.0,14.0 Hz,C18-H),3.17(1H,dd,J=4.5,12.0 Hz,C3-H),3.19(1H,dd,J=7.6,9.0 Hz,C2′-H),3.24(1H,m,C5′-H),3.29(1H,t,J=9.0 Hz,C4′-H),3.32(1H,m,C5″-H),3.34(1H,t,J=9.0 Hz,C3′-H),3.38(1H,t,J=8.5 Hz,C4‴-H),3.39(1H,t,J=9.0 Hz,C4′-H),3.55(1H,dd,J=7.5,9.0 Hz,C2″-H),3.66(1H,dd,J=4.5,12.0 Hz,C6″-H),3.68(1H,dd,J=4.0,12.0 Hz,C6′-H),3.75(1H,m,C5‴-H)3.79(1H,dd,J=3.5,12.0 Hz,C6″-H),3.84(1H,dd,J=2.5,12.0 Hz,C6′-H),3.93(1H,dd,J=1.5,2.0 Hz,C2‴-H),4.31(1H,d,J=7.6 Hz,C1′-H),5.25(1H,t,C12-H),5.37(1H,d,J=1.5 Hz,C1‴-H),5.44(1H,d,J=7.6 Hz,C1″-H)。13C NMR(CD3OD,100 MHz)δC:15.3(C-25),16.1(C-26),16.8(C-24),17.9(C-6‴),18.4(C-6),22.6(C-11),23.2(C-16),23.3(C-30),25.1(C-15),25.6(C-27),27.8(C-23),28.8(C-2),30.7(C-20),31.9(C-7),32.8(C-29),33.2(C-22),34.0(C-21),37.3(C-10),39.1(C-1),39.5(C-4),40.2(C-8),41.8(C-18),42.2(C-14),46.5(C-19),47.3(C-17),48.4(C-9),56.3(C-5),61.8(C-6′),62.3(C-6″),69.8(C-5‴),70.6(C-4″),71.5(C-2‴),71.6(C-3‴),73.3(C-4‴),75.3(C-2′),76.8(C-5′),77.4(C-3′),77.9(C-5″),78.1(C-3″),78.8(C-2″),90.1(C-3),94.8(C-1″),101.6(C-1‴),105.8(C-1′),122.9(C-12),144.9(C-13),177.8(C-28)。HR-ESI-MS Calcd.for C49H80O16[M+H]+:925.547 5;Found:925.548 2。与文献[17]对照,鉴定化合物5为3-O-β-D-glucopyranosyl-3-β-hydroxyolean-12-en-28-oic acid 28-O-[α-L-rhamno- pyranosyl-(1→2)-β-D-glucopyranosyl]ester。
化合物6白色针状结晶,5%硫酸乙醇加热显黄色,mp:147~148 ℃。1H NMR(CD3OD,400 MHz)δH:3.64(1H,d,J=4.6 Hz,C1-H),3.99(1H,d,J=4.1 Hz,C6-H),5.56(1H,d,J=1.2 Hz,C2-H)。13C NMR(CD3OD,100 MHz)δC:70.6(C-1),74.2(C-6),130.7(C-2).HR-ESI-MS Calcd.for C6H10O4Na[M+Na]+:169.047 6;Found:169.045 1。与文献[18]对照,鉴定化合物6为conduritol A。
化合物7白色无定形粉末,5%硫酸乙醇加热显紫黑色。1H NMR(CD3OD,400 MHz)δH:1.19(3H,s,C19-H),1.23(3H,s,C18-H),1.89(1H,d,J=11 Hz,C9-H),1.99(3H,s,C11-CH3CO),2.09(3H,s,C12-CH3CO),2.20(3H,s,C21-H),2.90(1H,dd,J=5,9 Hz,C17-H),3.42(1H,m,C3-H),5.32(1H,m,C6-H),5.69(1H,d,J=11 Hz,C11-H) Cym:1.55(3H,d,J=6 Hz,C6-H),1.90(1H,m,C2-H),2.31(1H,m,C2-H),3.58(1H,dd,J=2,9 Hz,C4-H),4.07(1H,q,J=3 Hz,C3-H),4.15(1H,m,C5-H),5.82(1H,br.d,J=10 Hz,C1-H),Cym:1.37(3H,d,J=6 Hz,C6-H),1.79(1H,m,C2-H),2.28(1H,m,C2-H),3.42(1H,dd,J=2,9 Hz,C4-H),3.99(1H,q,J=3 Hz,C3-H),4.14(1H,m,C5-H),5.09(1H,dd,J=2,9 Hz,C1-H),Ole:1.63(3H,d,J=6 Hz,C6-H),1.72(1H,m,C2-H),2.47(1H,m,C2-H),3.50(1H,C3-H),3.52(1H,C5-H),3.60(1H,t,J=9 Hz,C4-H),4.67(1H,dd,J=2,9 Hz,C1-H),Alm:1.55(3H,d,J=6 Hz,C6-H),3.58(1H,dd,J=3,8 Hz,C4-H),3.87(2H,br d,J=8 Hz,C2-H),4.07(1H,t,J=3 Hz,C3-H),4.15(1H,m,C5-H),5.28(1H,d,J=8 Hz,C1-H)。13C NMR(CD3OD,100 MHz)δC:13.4(C-18),18.3(C-19),20.8(12-CH3CO),21.6(11-CH3CO),24.9(C-16),31.7(C-21),31.9(C-2),35.9(C-7),37.4(C-15),39.7(C-10),41.2(C-1),43.3(C-4),49.7(C-9),56.0(C-13),60.0(C-17),72.6(C-3),76.5(C-8),79.1(C-12),86.2(C-14),118.8(C-6),140.9(C-5),171.5(11-CH3CO),172.6(12-CH3CO),216.4(C-20),Cym:18.5(C-6),37.2(C-2),68.9(C-5),78.0(C-3),83.3(C-4),96.2(C-1),Cym:18.4(C-6),37.0(C-2),68.8(C-5),77.6(C-3),83.1(C-4),100.4(C-1),Ole:18.8(C-6),37.5(C-2),72.0(C-5),79.2(C-3),82.7(C-4),101.8(C-1),Alm:18.5(C-6),71.0(C-5),73.2(C-2),74.5(C-4),83.9(C-3),101.9(C-1)。HR-ESI-MS Calcd.for C53H84O21[M+Na]+:1 079.542 8;Found:1 079.541 5。与文献[19]对照,鉴定化合物7为hoyacarnoside I。
4 活性检测
4.1 细胞的培养
B16细胞在湿度为95%、CO2浓度为5%的空气中,37 ℃环境下进行培养,培养液为10% FBS的DMEM。
4.2 黑色素含量的测定
B16细胞以每孔5×104个的密度接种在24孔板上培养24 h后,待细胞完全贴壁后,弃去上层培养基,加入不同浓度的含药培养500 μL,设定正常组和阳性对照组,继续培养48 h后,弃去上清液,PBS清洗3次,胰酶消化,收集细胞到离心管中,10 000 r/min离心10 min,弃去上清液,用含有10% DMSO的2 mol/L NaOH 150 μL溶解黑色素,并于80 ℃水浴中保温2 h,最后吸取溶解液100 μL转移到96孔板中,通过每孔上清液在405 nm波长下的吸收度,测定黑色素的含量用相对于空白对照吸收度的百分比表示,含量的百分比越小,证明样品对黑色素生成的抑制作用越强。
4.3 存活率活性的测定
B16细胞以每孔5×103个细胞接种在24孔板上培养24 h后,待细胞完全贴壁后弃去上层培养基,加入含有相应浓度的含药培养基100 μL,设定正常组和阳性对照组,继续培养48 h后,弃去上清液,每孔加入质量浓度为5 mg/mL的MTT溶液10 μL,继续培养4 h后,弃去上清液,每孔加入DMSO溶液100 μL,室温振摇10 min,通过每孔在570 nm波长下的吸收度,并计算B16细胞的存活率。
4.4 活性测定结果
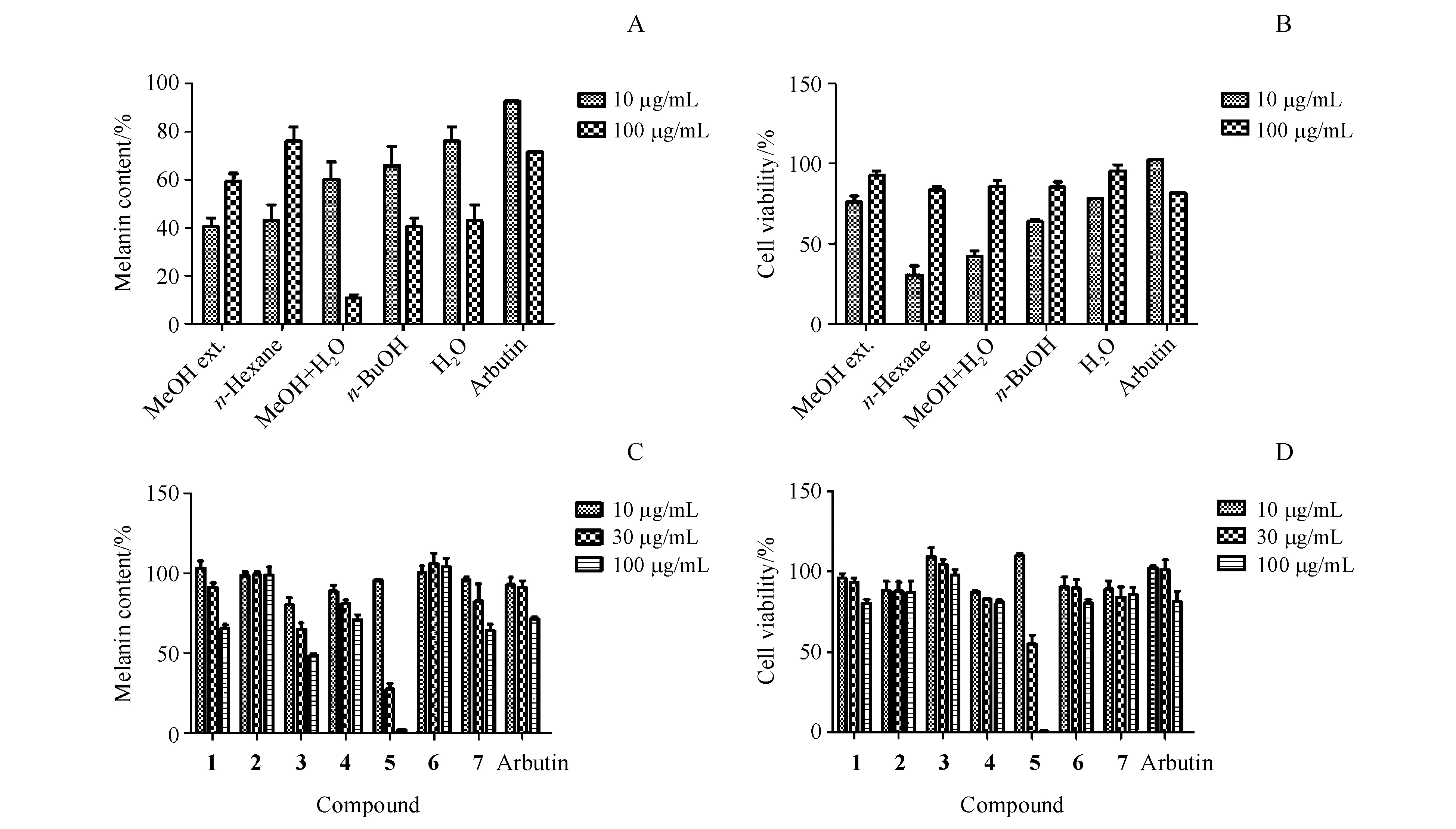
由图2可知,不同的萃取部位对黑色素生成均显示较强的抑制活性,同等浓度下,所有萃取部位抑制黑色素的活性均强于阳性对照熊果苷,同时对B16细胞的毒性较小,在10~100 μg/mL范围内,萃取物浓度越高反而对细胞的毒性越小。而且大部分化合物抑制黑色素生成活性表现出浓度依赖性,其中化合物5当浓度达到30 μmol/L时,抑制黑色素生成的活性明显提高。
5 结果与讨论
本研究对A.mannii叶的化学成分进行初步研究,分离并鉴定了7个化合物,均为首次从该植物中分离得到,本研究成果丰富了A.mannii的化学库,为其药用价值的开发利用提供了研究基础。本文对分离得到的7个化合物在B16细胞株上进行了细胞存活率实验,结果显示大部分化合物对B16细胞存活率影响较小,在不影响细胞存活率的条件下,大部分化合物能够抑制α-MSH诱导黑色素的生成,且与阳性对照药熊果苷活性相当。同时,不同萃取部位的抑制黑色素生成活性高、毒性小这一点不容忽视,以萃取部位作为美容产品进一步开发也可作为后期研究方向。
目前本研究对A.mannii的成分分离还不够彻底全面,不同种类的化合物无规律性,故在后期的研究中,仍需对各部位进行系统彻底的分离鉴定,更进一步丰富该植物的化合物库。
