结肠镜二次进镜检查后影响结直肠息肉检出率的相关因素分析
2018-02-09
(广东医科大学附属惠东医院 消化内科,广东 惠东 516300)
大肠癌的发病率居恶性肿瘤的第三位,死亡率居恶性肿瘤第四位[1]。大肠息肉作为大肠癌的癌前病变已得到广泛认可,及时对大肠息肉进行干预是阻止其癌变的基本措施[2]。临床经验表明,结肠镜检查以及镜下息肉切除可以大大降低大肠癌的发生率[3]。但是,临床数据也显示,结肠镜检查中的漏诊时有发生,致使一部分患者失去了早期治疗和预防的机会。因此,有必要采取措施在初次检查中提高结直肠息肉的检出率。本研究作为一项前瞻性研究,严格控制结肠镜检查中的客观因素(内镜医师的经验、内镜操作方式、退镜时间和肠道清洁的程度等),选取2016年2月-2017年2月本院消化内科进行二次结肠镜检查的400例患者,旨在发现影响大肠息肉检出率的主要因素,同时找出可以提高检出率的新方法。现报道如下:
1 资料与方法
1.1 一般资料
2016年2月-2017年2月本院消化内科共有400例患者进行二次结肠镜检查。其中,男271例,女129例,年龄21~68岁,平均(47.35±6.46)岁。本研究经患者及家属知情同意,医院伦理委员会批准。
1.2 纳入与排除标准
1.2.1 纳入标准①年龄18~70岁;②本院消化内科行无痛结肠镜检查的患者。
1.2.2 排除标准①肠道准备较差者(Boston肠道准备评分[4]总分<6分或任意肠段<2分);②有结直肠手术史;③患有炎症性肠病者;④有家族性息肉病史者。
1.2.3 剔除标准①试验期间无法耐受;②肠道准备差、肠道痉挛明显,影响观察;③结肠镜检查无法插镜至回盲部。
1.3 方法
1.3.1 检查前准备检查前完善心电图、传染疾病和凝血检查。检查前1 d无渣流质饮食,晚上果导片0.4 g口服。检查当天禁食禁水,将4盒聚乙二醇电解质加入3 000 ml水中,于检查前4 h开始服用,全部喝完,达到结直肠内无残留粪便及液体。
1.3.2 肠镜检查采用日本奥林巴斯公司生产Olympus CV-260主机和Olympus CF-H260AI结肠镜。要求内镜医师具有熟练的操作技术、丰富理论知识和实践经验,使用统一型号的内镜,均进镜至回盲部,退镜时间不少于6 min(若取活检,则去除活检时间)。患者镇静状态下左侧卧位,单人进镜操作法,寻腔进镜,仔细观察每段结肠和直肠黏膜,在回盲部冻结并存储图像。随后退镜观察,在常规模式下仔细观察全部结肠和直肠黏膜,当发现息肉样病变时,冻结并存储图像。记录息肉的数目、大小、形态和位置等相关检查结果。镜下切除息肉,将标本浸泡于10.00%福尔马林溶液中送病理组织学检查。最后退镜至齿状线时冻结并保存图像。
1.4 评价指标
①息肉数目:分为单发(1枚)与多发(≥2枚);②息肉大小:按活检钳张开口径的大小(约5 mm)衡量息肉直径,分为≤5 mm、5~10 mm和≥10 mm;③息肉形态:分为有蒂息肉和无蒂息肉;④息肉位置:分为直肠、乙状结肠、降结肠、横结肠、升结肠、回盲部;⑤病理类型:分为炎性息肉、增生性息肉和腺瘤性息肉[5];⑥漏诊息肉的判定及息肉漏诊率的计算:将第二次检查时新发现的息肉判定为漏诊息肉。息肉漏诊率=漏诊息肉数目/两次肠镜检查发现息肉总数×100.00%[6]。
1.5 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计数资料采用数字(n)或百分比(%)表示,息肉漏诊率相关因素的单因素分析采用χ2检验,影响漏诊的独立因素分析采用Logistic回归分析,取P<0.05为差异具有统计学意义。
2 结果
2.1 同一患者患者前后两次进镜观察检出的息肉数目、大小、形态、位置和病理类型比较
随机抽取的400例两次进镜检查的患者中,第一次进镜观察检出息肉362枚,第二次进镜观察检出漏诊息肉94枚,息肉漏诊率为20.61%(94/456)。单因素分析显示,多发息肉、小息肉(≤5 mm)、无蒂息肉、乙状结肠息肉、横结肠息肉以及升结肠息肉等存在较高的漏诊率(P<0.05);息肉的病理类型与漏诊无关(P>0.05)。见表1。
2.2 同一患者前后两次进镜漏诊相关因素的Logistic回归分析
以单因素分析结果中与漏诊相关的因素(数目、大小、形态、位置)为自变量,漏诊与否为因变量,进一步评估导致同一患者前后两次进镜漏诊的独立危险因素。息肉数目赋值为:0=单发,1=多发;息肉大小赋值为:0=≤5 mm,1=5~10 mm,2=≥10 mm;息肉形态赋值为:0=有蒂息肉,1=无蒂息肉;息肉位置赋值为:0=直肠,1=乙状结肠,2=降结肠,3=横结肠,4=升结肠,5=回盲部。通过Logistic回归分析,计算回归系数、标准误、P值、值和95%CI。结果显示,息肉的数目、大小、形态、位置均为进镜漏诊的独立影响因素,差异有统计学意义(P<0.05)。见表2。
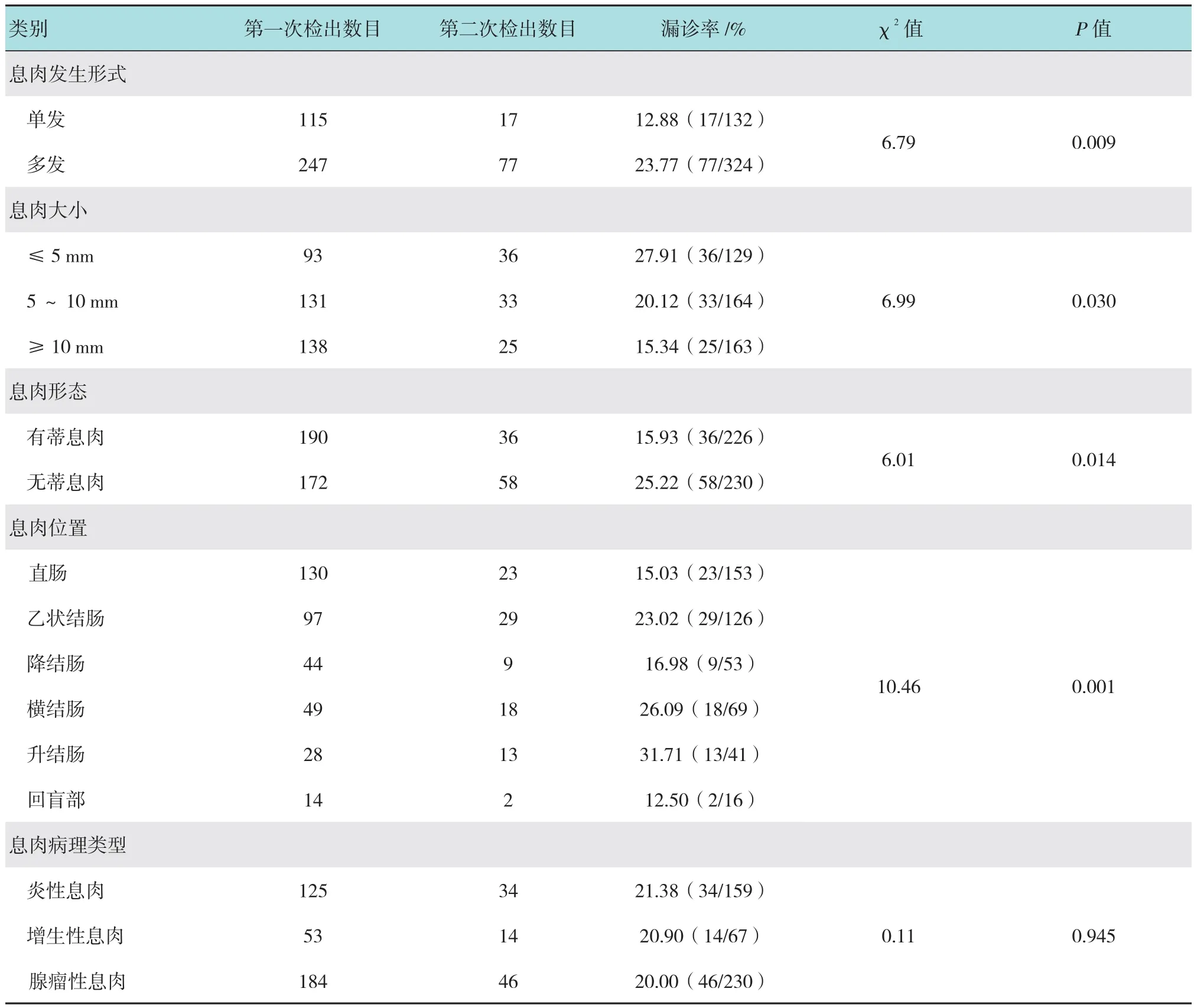
表1 同一患者前后两次进镜观察检出的息肉数目、大小、形态、位置和病理类型的比较Table 1 Comparison of the number of polyps detected,size,shape,location and pathological types between the first and the second microscopic examination in the same patient

表2 同一患者前后两次进镜漏诊相关因素的Logistic回归分析Table 2 The Logistic regression analysis of misdiagnosis related factors between the first and the second microscopic examination in the same patient
3 讨论
直结肠息肉是公认的癌前病变,尤其是其中的腺瘤样息肉具有十分明显的癌变倾向。目前认为[7],结肠镜检查是检测结直肠癌及其癌前病变的金标准,在结肠镜下发现并切除息肉能达到预防肿瘤的作用,降低其发病率。有研究表明[8],检查过程中的一些客观因素(内镜医师的经验、内镜操作方式、退镜时间和肠道清洁的程度等)、肠道结构以及息肉特性均可能对检查结果产生一定影响,造成漏诊的问题。
本研究针对上述客观因素,严格选用经验丰富的内镜医师,采用单人进镜操作方式,要求退镜时间不少于6 min,并且肠道准备达到Ⅰ级标准,尽量避免客观因素对漏诊产生的影响,本文重点探讨的是肠道结构及息肉特性对息肉漏诊的影响。
文献报道,结直肠息肉的总漏诊率为处于6.00%~27.00%之间[9],本文多项目分组计算后显示漏诊率基本在此区间,与文献相符。经过前后两次进镜观察比较,结合其单因素及多因素回归分析,本文最终得出,息肉的数目、大小、形态及位置是漏诊的独立影响因素。
本研究显示,多发息肉的漏诊率高于单发息肉(P<0.05),息肉越多,检查过程中漏掉某一个或某一些息肉的概率越大。CHOI等[10]指出,息肉数目是漏诊的独立预测因素。LEUFKENS等[11]认为,息肉数目过多,可能影响了内镜医师在检查过程中的注意力,由此产生漏诊。有学者建议,如果发现多发息肉,应缩短复诊时间,也许是一项较好的补救措施[12]。
本研究还显示,较小的息肉相对较大者更容易漏诊(P<0.05),原因是息肉越小,越难以被观察。国外的文献报道[13],≤5 mm者漏诊率为26.00%,5~10 mm者漏诊率为13.00%,而≥10 mm者漏诊率为2.00%。国内则报道,≤5 mm者漏诊率为89.40%,5~10 mm者漏诊率为9.50%,≥10 mm者漏诊率为1.20%(总漏诊率22.50%)[14]。尽管有报道提出[15],息肉越大,癌变的概率越大,但是也不能忽视漏诊的小息肉可能带来的小概率事件。因此,建议小息肉患者定期复诊。
本研究还发现,无蒂息肉的漏诊率较有蒂息肉高(P<0.05),这类息肉通常呈现扁平状态,导致内镜医师的识别率较低,因而具有较高的漏诊率。而无蒂的扁平型病变往往存在重度异型增生或黏膜内癌的可能性。因此,对此类形态的息肉需高度重视。
同时,本研究也认为,在大肠的不同区域,息肉的漏诊率存在差异,乙状结肠、横结肠和升结肠的息肉漏诊率明显高于其他区域(P<0.05)。乙状结肠存在较多的弯曲,加上肠镜构造的限制,于弯曲处难以全面观察到整个肠道,故有漏诊概率;横结肠和升结肠处皱襞深大,不易展开,因而也存在漏诊现象。
降低大肠息肉的漏诊率是结肠镜检查中的一项重点。随着临床科技的发展,更多更新的技术已经或即将用于提高大肠息肉的检出率。放大内镜[16]具有高像素和高分辨率,可80~100倍放大肉眼所见的黏膜组织,清晰显示病灶部位的细微结构,对于小息肉及无蒂息肉检出率的提高具有很大意义。染色内镜[17]对肠黏膜喷洒特定的化学物质,提高病灶与正常黏膜的对比度,增加识别能力。透明帽辅助肠镜检查法[18]通过在肠镜前段安装透明帽,使肠黏膜和肠镜头间保持距离,以便发现容易漏诊部位的息肉。广角结肠镜[19]可旋转170°,提高了镜下可视范围,更容易发现隐藏于肠道皱襞中的息肉。
综上所述,本研究认为,大肠息肉的数目、大小、形态和位置均是影响其检出率的重要因素,随着临床技术的进步,运用新的技术有可能使息肉的检出率得到提高。
[1]曾红梅, 陈万青. 中国癌症流行病学与防治研 究现状[J]. 化学进展, 2013, 25(9):1415-1420.
[1]ZENG H M, CHEN W Q. Cancer epidemiology and control in China:state of the art[J]. Progress in Chemistry, 2013, 25(9):1415-1420. Chinese
[2]乐亚朋, 孔令斌. 大肠癌筛查方法的研究进展[J]. 国际肿瘤学杂志, 2016, 43(3):229-231.
[2]LE Y P, KONG L B. Research progress of colorectal cancer screening methods[J]. Journal of International Oncology, 2016, 43(3):229-231. Chinese
[3]侯国伟, 刘晓菲, 姜南阳, 等. 大肠癌筛查新策略及研究进展[J].现代生物医学进展, 2015, 15(9):1772-1774.
[3]HOU G W, LIU X F, JIANG N Y, et al. The new strategy and research progress of colorectal cancer screening[J]. Progress in Modern Biomedicine, 2015, 15(9):1772-1774. Chinese
[4]CALDERWOOD A H, SCHROY P C, LIEBERMAN D A, et al. Boston bowel preparation scale scores provide a standardized definition of adequate for describing bowel cleanliness[J]. Gastrointest Endosc, 2014, 80(2):269-276.
[5]唐保东, 陈志娜, 马博, 等. 大肠息肉临床与病理相关性研究[J].中国医药导报, 2012, 9(35):115-116.
[5]TANG B D, CHEN Z N, MA B, et al. Correlational study between clinical characteristic and pathological type of colorectal polyps[J]. China Medical Herald, 2012, 9(35):115-116. Chinese
[6]MENEES S B, KIM H M, ELLIOTT E E, et al. The impact of fair colonoscopy preparation on colonoscopy use and adenoma miss rates in patients undergoing outpatient colonoscopy[J]. Gastrointest Endosc, 2013, 78(3):510-516.
[7]DENIS B, SAULEAU E A, GENDRE I, et al. The mean number of adenomas per procedure should become the gold standard to measure the neoplasia yield of colonoscopy:a population-based cohort study[J]. Dig Liver Dis, 2014, 46(2):176-181.
[8]HALPERN Z, GROSS S A, GRALNEK I M, et al. Comparison of adenoma detection and miss rates between a novel balloon colonoscope and standard colonoscopy:a randomized tandem study[J]. Endoscopy, 2015, 47(4):301.
[9]CORLEY D A, LEVIN T R, DOUBENI C A, et al. Adenoma detection rate and risk of colorec tal cancer and death[J]. N Engl J Med, 2014, 370(26):2541.
[10]CHOI H N, KIM H H, OH J S, et al. Factors influencing the miss rate of polyps in a tandem colonoscopy study[J]. Korean J Gastroenterol, 2014, 64(1):24-30.
[11]LEUFKENS A M, VAN OIJEN M G H, VLEGGAAR F P, et al. Factors influencing the miss rate of polyps in a back-to-back colonoscopy study[J]. Endoscopy, 2012, 44(5):470-475.
[12]黄永红, 刘志先, 高枫. 多发性结直肠息肉的临床特点分析[J].广西医学, 2016, 38(6):880-881.
[12]HUANG Y H, LIU Z X, GAO F. Analysis of clinical features in multiple colorectal polyps[J]. Guangxi Medical Journal, 2016, 38(6):880-881. Chinese
[13]VAN RIJN J C, REITSMA J B, STOKER J, et al. Polyp miss rate determined by tandem colonoscopy:a systematic review[J]. Am J Gastroenterol, 2006, 101(2):343-350.
[14]何晋德, 王怀堂, 刘玉兰, 等. 常规电子结肠镜检查中结肠息肉漏诊分析[J]. 中华消化内镜杂志, 2007, 24(5):354-356.
[14]HE J D, WANG H T, LIU Y L, et al. Analysis of colonic miss polyps by routine video colonscopy[J]. Chin J Dig Endosc, 2007, 24(5):354-356. Chinese
[15]杨黎明, 杨琛, 闫蓓, 等. 大肠癌筛查癌前病变人群随访间隔的研究进展[J]. 世界华人消化杂志, 2013, 21(35):3971-3976.
[15]YANG L M, YANG C, YAN B, et al. Follow-up interval for precancerous colorectal conditions[J]. World Chinese Journal of Digestology, 2013, 21(35):3971-3976. Chinese
[16]SENORE C, REGGIO D, MUSSO A, et al. Narrow band imaging vs. high definition colonoscopy for detection of colorectal adenomas in patients with positive faecal occult blood test:a randomised trial[J]. Dig Liver Dis, 2014, 46(9):803-807.
[17]黄健, 钟清连, 陈小华, 等. 电子染色内镜技术对大肠息肉样病变诊断价值的研究[J]. 中国医学工程, 2016, 24(9):6-9.
[17]HUANG J, ZHONG Q L, CHEN X H, et al. Study on diagnostic value of electron dye endoscopy in colorectal polyps[J]. China Medical Engineering, 2016, 24(9):6-9. Chinese
[18]RASTOGI A. Cap-assisted colonoscopy[J]. Gastroenterol Clin North Am, 2013, 42(3):479-489.
[19]李延青. 消化内镜诊断新技术[J]. 山东大学学报(医学版), 2011, 49(10):54-55.
[19]LI Y Q. New technologies of digestive endoscopy diagnosis[J]. Journal of Shandong University (Health Sciences), 2011, 49(10):54-55. Chinese
