关节镜下髁间窝微骨折术与髌下脂肪垫粉碎术在半月板损伤中的应用研究*
2018-02-09
[湖南师范大学第一附属医院(湖南省人民医院) 关节与运动医学科,湖南 长沙 410000]
半月板是一种纤维软骨结构,在关节内传递负荷、营养软骨及减少摩擦等,其损伤后导致关节内异常负荷及炎症的产生,继发软骨的退变,加速骨关节炎的进展[1],成为了运动医学中的难题。早期的治疗如半月板切除术,虽能在一定程度上缓解症状,但导致软骨的 接触应力大幅度增加。随着微创技术的发展,关节镜下修复半月板损伤是目前最佳的手术方式。然而,由于半月板最常见的损伤区域(白区)的无脉管系统分布,常导致术 后恢复受限[2]。因此,在行手术时,使用其他方法促进半月板修复成为了热点[3]。目前临床上的方法如纤维蛋白凝块技术[4]、滑膜移植[5-6]、药物[7]及生长因子[8]等,效果有限,且手术难度和费用较高。随着基础医学的发展,间充质干细胞(mesenchyma stem cell,MSC)得到了广泛的研究[9],并视其为修复半月板损伤的最佳种子细胞[10]。MSC可体外复合天然生物或高分子合成支架,构建半月板再生结构组织[11-12];缺损处自体MSC聚集组装移植与关节腔内MSC注射能促进半月板再生等[13-15]。因此,围手术期中利用干细胞的多分化潜能成为了焦点[16],但现有的MSC治疗方法存在周期长、细胞来源少、支架力学性能及生物活性差和二次手术的可能等问题[17],导致其在临床上使 用受到限制。从解剖中,本团队发现膝关节毗邻股骨髓腔,其内有髌下脂肪垫,若通过在关节镜下手术处理,释放骨髓及脂肪来源 的干细胞,可减少操作流程,有望加快和简化修复半月板损伤的进程。本研究希望通过基础实验及临床研究,分析关节镜下髁间窝微骨折术与髌下脂肪垫粉碎术对半月板损伤修复的作用机制及其疗效。
1 资料与方法
1.1 试剂与材料
DMEM/F12培养基、胎牛血清、甘氨酸购自Sigma公司;红细胞裂解液、磷酸缓冲盐溶液( p hosphate buffer saline,PBS)购自Beyotime公司;Human MSC Analysis Kit购自BD StemflowTM;二氧化碳CO2恒温培养箱购自Thermo Forma公司;倒置显微镜、光学显微镜购自Olympus公司;台式冷冻离心机购自Thermo Scientific公司。
1.2 髁间窝微骨折术
于股骨髁间窝内行微骨折术,吸引器将孔洞流出的骨髓液吸入离心管,转运至实验室。500 g离心5 min,弃上清,红细胞裂解液重悬,避光裂解2 min,500 g离心5 min,弃上清,PBS重悬,500 g离心5 min,弃上清,加入10%胎牛血清(fetal bovine serum,FBS)的DMEM/F12培养基重悬,转移至培养瓶,于37℃+5% CO2孵箱中培养,48 h后首次换液,每隔2 d换液,细胞汇合度达到80% 以上时传代,对第1代实验细胞进行镜下观察,用人间充质干细胞试剂盒对其进行鉴定。
1.3 髌下脂肪垫粉碎术
在股骨髁间窝前方髌下脂肪垫处,刨削刀将一小块脂肪垫打碎成1.0 mm×1.0 mm大小,吸引器将脂肪小块连同周围的液体吸入离心管,转运至实验室。PBS反复清洗,100μm及40μm滤网过滤,400 g离心5 min,弃上清,红细胞裂解液重悬,避光裂解10 min,400 g离心5 min,加入10% FBS的DMEM/ F12培养基重悬,转移至培养瓶,于37℃+5% CO2孵箱中培养,48 h后首次换液,每隔2 d换液,细胞汇合度达到80%以上时传代,对第1代实验细胞进行镜下观察,用人间充质干细胞试剂盒对其进行鉴定。
1.4 一般资料
回顾性分析2014年1月-2016年1月诊疗的单侧单纯半月板损伤并行手术的患者,共计75例(75膝),病例均来自本院同一治疗组的住院患者。纳入标准:年龄18~35岁,无严重肝、肾、心及造血系统疾病等;既往无膝关节手术史;符合下述诊断标准者;签署知情同意书者。排除标准:患有韧带损伤、髌骨软骨软化、软骨损伤、游离体及滑膜皱襞综合征等其他关节紊乱疾病;精神状态欠佳或不配合者;既往有膝关节手术史;患有严重肝、肾、心及造血系统疾病等;骨肿瘤;未签知情同意书者。按照关节镜中手术处理方式不同,将75例患者分为髁间窝微骨折术组(A组25例)、髌下脂肪垫粉碎术组(B组25例)及对照组(C组25例)。3组患者的年龄、体质指数(body mass index,BMI)、半月板损伤类型及性别构成比等方面分布相近,差异无统计学意义(P>0.05),具有可比性。见表1。
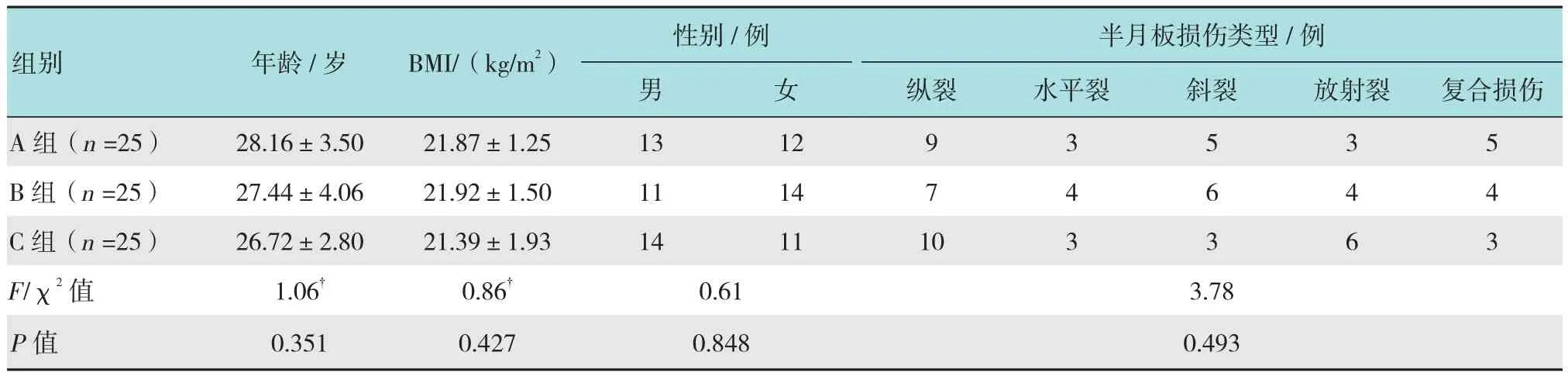
表1 各组患者一般资料比较Table 1 Comparison of general data among the three groups
1.5 诊断标准
1.5.1 症状急性受伤时膝关节内可有撕裂声;上下楼时有打软腿及错动感;患肢有乏力不稳感;运动能力明显下降。
1.5.2 体征急性期间可有关节肿胀;关节间隙压痛;McMurry(+),Apley(+);过伸、过屈(+)。
1.5.3 检验结果急性损伤可有红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C reactive protein,CRP)及白细胞数目增多;陈旧性损伤中血生化检查一般无明显异常。
1.5.4 影像学检查X片及CT一般无明显异常,偶见关节间隙增宽;磁共振成像(magnetic resonance imaging,MRI)提示半月板损伤(多为Ⅲ度信号,通向上下关节腔表面)影像。
1.6 治疗方法
A组:在行半月板成型缝合术后,用微骨折器械,于髁间窝处钻出小孔,使一部分骨髓和血液从孔中渗出。B组:在行半月板成型缝合术后,在髁间窝前方髌下脂肪垫处,用刨削刀将一小块脂肪垫(约0.5 cm×0.5 cm)充分反复打碎,成1.0 mm×1.0 mm大小。C组:空白对照组,行常规的半月板缝合术后,并未进行其他特殊处理。
常规手术方式:麻醉满意后,患者取仰卧位,取常规膝前内外侧入路长约0.5 cm,置入关节镜,探查可见半月板损伤,清理半月板白区撕裂组织,红白区采用Fast-fix进行缝合,修整半月板边缘,注入玻璃酸钠,弹力绷带加压包扎。术中具体过程见图1。
1.7 治疗后随访及疗效评估
所有患者手术前及随访时均采用Lysholm、视觉模拟评分法(visual analogue scale,VAS)评分 及不良事件(关节肿胀及膝前区疼痛)评估。
1.8 统计学方法
应用SPSS 21.0统计学软件进行处理。检验数据差值是否符合正态分布和满足组间方差齐性,如果满足,采用均数±标准差(±s)表示,组间采用单因素方差分析与配对t检验;若不满足,采用秩和检验,计数资料的比较采用χ2检验。以P<0.05为差异有统计学意义。

图1 术中具体过程Fig.1 Intraoperative specific process

图2 髁间窝微骨折体外细胞培养镜下图片Fig.2 Micrograph of cells released by fossa intercondyloidea of micro-fracture
2 结果
2.1 体外基础实验
2.1.1 髁间窝微骨折术体外实验在体外培养8~10 d后可见培养瓶中细胞类似 成纤维细胞,生长迅速,长梭状,呈旋涡状分布,细胞界限清楚,排列紧密,密度较高,具有干细胞的特性,见图2。将第1代细胞用人干细胞分析试剂盒进行鉴定,可见样本细胞表面CD90、CD105、CD73及CD44表达比例高(>95%),符合干细胞的定义标准,考虑其为骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)[18],见图3。

图3 髁间窝微骨折体外细胞干细胞试剂盒鉴定结果Fig.3 Human MSC Analysis Kit results of cells released by fossa intercondyloidea of micro-fracture
2.1.2 髌下脂肪垫粉 碎术体外实验在体外培养8~10 d后可见培养瓶中绝大多 数细胞类似成纤维细胞,含有少量杂质及坏死细胞,呈长梭状,呈平行排列,网状辐射状生长,细胞界限清楚,排列规则,具有干细胞的特征,见图4。将第1代细胞用人干细胞分析试剂盒进行鉴定,可见样本细胞表面CD90、CD105及CD73表达比例高(>95%),CD44相对较少,符合干细胞的定义标准,考虑其为髌下脂肪垫来源干细胞(infrapatellar fat pad-derived stem cells,IPFPSCs)[18],见图5。
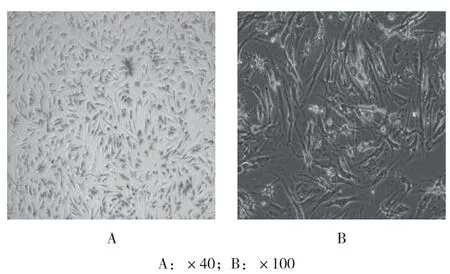
图4 髌下脂肪垫粉碎体外细胞镜下图片Fig.4 Micrograph of cells released by comminution of subcutaneous fat pad
2.2 临床研究
所有患者均获平均10个月(8~11个月)随访,无神经血管损伤、感染等并发症。术前,A、B、C组的Lysholm及VAS评分的组间差异无统计学意义(P>0.05),不良事件大致相同。术后末次随访中,各组末次随访的结果较治疗前均有明显改善,差异有统计学意义(P<0.05);A组与C组、B组与C组间的Lysholm及VAS评分差异具有统计学意义(P<0.05);A组与B组间的差异无统计学意义(P>0.05),见表2。B组的不良事件早期发生率高于A组及C组,末次随访时无明显差异,见表3。半月板损伤修复术后情况见图6。

图5 髌下脂肪垫粉碎体外细胞干细胞试剂盒鉴定结果Fig.5 Human MSC Analysis Kit results of cells released by comminution of subcutaneous fat pad
表2 各组治疗前后Lysholm和VAS评分比较 (分,±s)Table 2 Comparison of Lysholm and VAS score among the three groups (score,±s)

表2 各组治疗前后Lysholm和VAS评分比较 (分,±s)Table 2 Comparison of Lysholm and VAS score among the three groups (score,±s)
注:1)A组与C组比较,差异有统计学意义(P <0.05);2)B组与C组比较,差异有统计学意义(P <0.05)
t值 P值治疗前 末次随访 治疗前 末次随访A组(n =25) 55.16±5.09 90.16±2.801) 30.15 0.001 2.24±0.93 0.64±0.571) 7.37 0.001 B组(n =25) 54.96±5.22 90.92±2.342) 31.44 0.0 01 2.12±1.01 0.68±0.632) 6.04 0.001 C组(n =25) 54.16±4.88 87.20±3.07 28.66 0.001 2.24±1.05 1.08±0.57 4.85 0.001 F值 0.273 12.75 0.12 4.26 P值 0.792 0.001 0.887 0.018 Lysholm评分VAS评分组别t值 P值
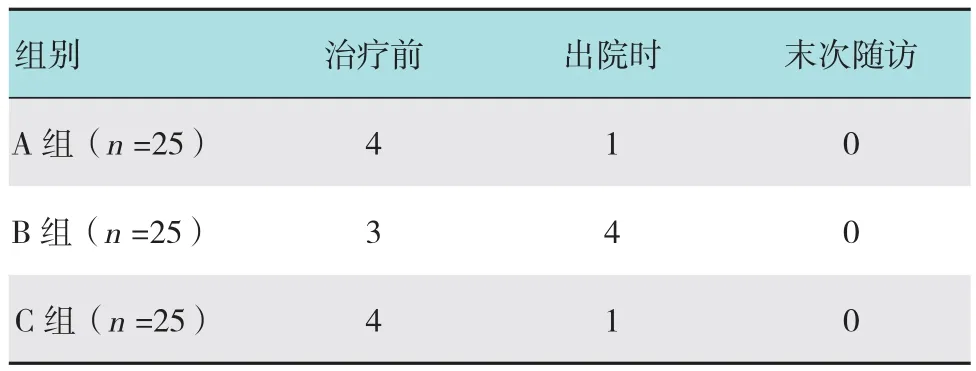
表3 各组治疗前后不良事件发生例数比较 例Table 3 Comparison of adverse event rate among the three groups n

图6 半月板损伤修复术后Fig.6 Repaired meniscus injury
3 讨论
半月板损伤后增加关节内接触压力,导致关节功能障碍[19]。近年来,随着基础医学的深入,通过再生医学修复损伤的半月板得到了关注[20-21],并认为最佳的修复方法通过下列途径:①细胞通过黏附于机械支架并形成新的组织形态;②选择合适的种子细胞进行诱导分化,来促进组织的愈合及新基质的合成;③添加某种生长因子或寻找能刺激细胞分化及基因表达的信号[22-24]。
目前,研究者们希望使用MSCs治疗半月板白区损伤。HORIE等[25]研究发现将滑膜干细胞移植黏附于半月板白区受损部位,最终可分化成类似于天然半月板成纤维软骨的细胞;HATSUSHIKA等[26]通过组织学和MRI检查发现滑膜干细胞使半月板缺损处滑膜早期填充,可有效保留更多的半月板;DUYGULU等[27]通过电镜观察到自体BMSCs可使半月板缺损处新生血管、纤维软骨细胞及软骨斑块增多。因此,MSC被认为是修复半月板损伤的最佳种子细胞[28]。
临床中常用微骨折术修复关节软骨损伤,其机制是利用从骨髓腔流出的BMSC填充于缺损处,利用其多分化功能,最终可形成纤维软骨[29]。由此,本研究设想其是否同样可以利用来修复半月板损伤。相比常规在软骨上的微骨折术,选择髁间窝处微骨折,在释放干细胞的基础上,可避免造成新的软骨损伤、能减少疼痛的发生率及康复难度。基础实验可证实术中释放的骨髓液中含有BMSC;临床随访可见Lysholm评分及VAS评分较对照组改善。因此,髁间窝微骨折术从理论、基础和临床应用中证实其对半月板损伤修复有良好的效果,这与HOWARTH等研究是相同的[30]。
半月板损伤后,髌下脂肪垫常发生水肿,导致膝前区疼痛。在术中,脂肪垫需修整,减少其病理炎症的发展。研究表明:髌下脂肪垫靠近滑膜面,所处环境与关节腔类似,具有同源性[31],其干细胞为脂肪来源,具有多分化能力[32-33]。由此,本研究探索性地提出了髌下脂肪垫粉碎术,在缓解病理炎症的基础上,释放脂肪干细胞至关节内。基础实验表明粉碎后的脂肪垫悬液中含有IPFPSC。临床随访提示该技术的术后评分优于对照组,与髁间窝微骨折术的效果相当,这与NISHIMUTA及HINDLE等研究较为相似[32-34]。然而,本研究中发现,髌下脂肪垫粉碎术的早期不良事件发生率较高,远期则无明显差异,可能与脂肪垫的出血及无菌炎症反应增加有关[35]。综上所述,关节下髁间窝微骨折术与髌下脂肪垫粉碎术能在一定程度上促进半月板损伤的修复,并具有独特的优势。至于其具体的详细作用机制及修复的远期效果,还有待进一步研究。
[1]FELSON D T. Osteoarthritis as a disease of mechanics[J]. Osteoarthritis Cartilage, 2013, 21(1):10-15.
[2]BOCHYNSKA A I, VAN TIENEN T G, HANNINK G, et al. Development of biodegradable hyper-branched tissue adhesives for the repair of meniscus tears[J]. Acta Biomaterialia, 2016, 32:1-9.
[3]CUCCHIARINI M, MCNULTY A L, MAUCK R L, et al. Advances in combining gene therapy with cell and tissue engineering-based approaches to enhance healing of the meniscus[J]. Osteoarthritis Cartilage, 2016, 24(8):1330-1339.
[4]ISHIMURA M, OHGUSHI H, HABATA T, et al. Arthroscopic meniscal repair using fibrin glue. Part I:Experimental study[J]. Arthroscopy, 1997,13(5):551-557.
[5]SHIRAKURA K, NIIJIMA M, KOBUNA Y, et al. Free synovium promotes meniscal healing. Synovium, muscle and synthetic mesh compared in dogs[J]. Acta Orthopaedica Scandinavica, 1997, 68(1):51-54.
[6]CISA J, BASORA J, MADARNAS P, et al. Meniscal repa ir by synovial fl ap transfer. Healing of the avascular zone in rabbits[J]. Acta Orthopaedica Scandinavica, 1 995, 66(1):38-40.
[7]ZHANG S, MATSUSHITA T, KURODA R, et al. Local Administration of simvastatin stimulates healing of an avascular meniscus in a rabbit model of a meniscal defect[J]. American Journal of Sports Medicine, 2016, 44(7):1735-1743.
[8]PETERSEN W, PUFE T, STÄRKE C, et al. The effect of locally applied vascular endothelial growth factor on meniscus healing:gross and histological findings[J]. Arc hives of Orthopaedic and Trauma Surgery, 2007, 127(4):235-240.
[9]JONES E A, CRAWFORD A, ENGLISH A, et al. Synovial fl uid mesenchymal stem cells in heal th and early osteoarthritis:detection and functional evaluation at the single-cell level[J]. Arthritis Rheumatism, 2008, 58(6):1731-1740.
[10]TER HUURNE M, SCHELBERGEN R, BLATTES R, et al. Ant iin fl ammatory and chondroprotective effects of intraarticular injection of adipose-derived stem cells in experimental osteoarthritis[J]. Arthritis Rheumatism, 2012, 64(11):3604-3613. [11]KONDO S, MUNETA T, NAKAGAWA Y, et al. Transplantation of autologous synovial mesenchymal stem cells promotes meniscus regeneration in aged primates[J]. J Orthop Res, 2017, 35(6):1274-1282.
[12]HATSUSHIKA D, MUNETA T, H ORIE M, et al. Intraarticular injection of synovial stem cells promotes meniscal regeneration in a rabbit massive meniscal defect model[J]. Journal of Orthopaedic Research, 2013, 31(9):1354-1359.
[13]AL FAQEH H, NOR HAMDAN B M, C HEN H C, et al. The potential of intra-articular injection of chondrogenic-induced bone marrow stem cells to retard the progression of osteoarthritis in a sheep model[J]. Experimental Gerontology, 2012, 47(6):458-464.
[14]TORATA NI T, NAKASE J, NUMATA H, et al. Scaffold-free tissue-engineered allogenic adipose-derived stem cells promote meniscus healing[J]. Arthroscopy, 2017, 33(2):346-354.
[15]NUMPAISAL P O, ROTHRAUFF B B, GOTTARDI R, et al. Rapidly dissociated autologous meniscus tissue enhances meniscus healing:An in vitro study[J]. Connective Tissue Research, 2016, 58(3-4):355-365.
[16]BOCHYNSKA A I, HANNINK G, GRIJPMA D W, et al. Tissue adhesives for meniscus tear repair:an overview of current advances and prospects for future clinical solutions[J]. Journal of Materials Science Materials in Medicine, 2016, 27(5):85.
[17]BUMA P, RAMRATTAN N N, VAN TIENEN T G, et al. Tissue engineering of the meniscus[J]. Biomaterials, 2004, 25(9):1523-1532.
[18]DOMINICI M, LE BLANC K, MUELLER I, et al. Minimal criteria for de fi ning multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position sta tement[J]. Cytotherapy, 2006, 8(4):315-317.
[19]WALKER P S, ARNO S, BELL C, et al. Function of the medial meniscus in force transmission and stability[J]. Journal of Biomechan ics, 2015, 48(8):1383-1388.
[20]YU H, ADESIDA A B, JOMHA N M. Meniscus repair using mesenchymal stem cells - a comprehensive review[J]. Stem Cell Research Therapy, 2015, 6:86.
[21]LIU C, TOMA I C, MASTROGIACOMO M, et al. Meniscus reconstruction:today’s achievements and premises for the future[J]. Archives of Orthopaedic and Trauma Surgery, 2013, 133(1): 95-109.
[22]FREYMANN U, METZLAFF S, KRUGER J P, et al. Effect of human serum and 2 different types of platelet concentrates on human meniscus cell migration, proliferation, and matrix formation[J]. Arthroscopy, 2016, 32(6):1106-1116.
[23]PIONTEK T, CIEMNIEWSKA-GORZELA K, NACZK J, et al. Complex meniscus tears treated with collagen matrix wrapping and bone marrow blood injection:a 2-year clinical follow-up[J]. Cartilage, 201 6, 7(2):123-139.
[24]HADIDI P, PASCHOS N K, HUANG B J, et al. Tendon and ligament as novel cell sources for engineering the knee meniscus[J]. Osteoarthritis Ca rtilage, 2016, 24(12):2126-2134.
[25]HORIE M, DRISCOLL M D, SAMPSON H W, et al. Implantation of allogenic synovial stem cells promotes meniscal rege neration in a rabbit meniscal defect model[J]. J Bone Joint Surg Am, 2012, 94(8):701-712.
[26]HATSUSHIKA D, MUNETA T, NAKAMURA T, et al. Repetitive allogeneic intraarticular injections of s ynovial mesenchymal stem cells promote meniscus regeneration in a porcine massive meniscus defect model[J]. Osteoarthritis Cartilage, 2014, 22(7):941-950.
[27]DUYGULU F, DEMIREL M, ATALAN G, et al. Effects of intraarticular a dministration of autologous bone marrow aspirate on healing of full-thickness meniscal tear:an experimental study on sheep[J]. Acta orthopaedica et traumatologica turcica, 2012, 46(1):61-67.
[28]QI Y, CHEN G, FE NG G. Osteoarthritis prevention and meniscus regeneration induced by transplantation of mesenchymal stem cell sheet in a rat meniscal defect model[J]. Experimental and Therapeuti c Medicine, 2016, 12(1):95-100.
[29]OGURA T, BRYANT T, MINAS T. Biological knee reconstruction with concomitant autologous chondrocyte implantation and meniscal allograft transplantation:mid- to long-term outcomes[J]. Orthopaedic Journal of Sports Medicine, 2016, 4(10):2325967116668490.
[30]HOWARTH W R, BROCHARD K, CAMPBELL S E, et al. Effect of Microfracture on Meniscal Tear Healing in a Goat (Capra hircus) Model[J]. Orthopedics, 2016, 39(2):105-110.
[31]FELIMBAN R, YE K, TRAIANEDES K, et al. Differentiation of stem cells from human infrapatellar fat pad:characterization of cells undergoing chondrogenesis[J]. Tissue Engineering Part A, 2014, 20(15-16):2213-2223.
[32]NISHIMUTA J F, BENDERNAGEL M F, LEVENSTO N M E. Co-culture with infrapatellar fat pad differentially stimulates proteoglycan synthesis and accumulation in cartilage and meniscus tissues[J]. Connective Tissue Research, 2017, 58(5):447-455.
[33]HINDLE P, KHAN N, BIANT L, e t al. The infrapatellar fat pad as a source of perivascular stem cells with increased chondrogenic potential for regenerative medicine[J]. Stem Cells Translational Medicine, 2017, 6(1):77-87.
[34]NORDBERG R C, CHAROENPANICH A, VAUGHN C E, et al. Enhanced ce llular in fi ltration of human adipose-derived stem cells in allograft menisci using a needle-punch method[J]. Journal of Orthopaedic Surgery and Research, 2016, 11(1):132.
[35]EYMARD F, PIGENET A, CITADELLE D, et al. Knee and hip intra-articular adipose tissues (IAATs) compared with autologous subcutaneous adipose tissue:a specific phenotype for a central player in osteoarthritis[J]. A nn Rheum Dis, 2017, 76(6):1142-1148.
