内镜下治疗十二指肠占位性病变的安全性、有效性及临床价值研究*
2018-02-09
(南京医科大学第二附属医院 消化内镜中心,江苏 南京 210011)
十二指肠占位性病变发病率极低,恶性率低,较少引起明显的临床症状。外科手术治疗,包括胰十二指肠切除术(Whipple手术)、保留幽门胰腺切除术(pylorus-preserving pancreatectomy,PPP)或保留幽门胰十二指肠切除术(pylorus-preserving pancreaticoduodenectomy,PPPD)等仍作为大部分十二指肠占位性病变治疗的首选方式。这些手术治疗虽然提供了有效切除,但存在着显著的并发症发生率(37.00%~41.00%)和死亡率(1.00%~6.00%)[1-3]。近年来,内镜下治疗技术迅速发展,尤其是以内镜下黏膜切除术(endoscopic mucosal resection,EMR)和内镜黏膜下剥离术(endoscopic submucosal desection,ESD)为代表的技术不断成熟,内镜下治疗为十二指肠占位性病变提供了一个可行的选择。但目前国内将内镜下治疗技术应用于十二指肠占位性病变的报道很少,一是因为十二指肠占位性病变发病率极低[4];二是由于十二指肠本身的解剖特点致使内镜下治疗的风险较大[5]。南京医科大学第二附属医院消化内镜中心自2012年12月以来,累计开展了内镜下十二指肠占位性病变手术59例,现将内镜下治疗技术在十二指肠占位性病变中的安全性、有效性及临床价值进行总结。
1 资料与方法
1.1 一般资料
2012年12月-2016年12月南京医科大学第二附属医院消化内镜中心对共计59例十二指肠占位性病变行内镜下治疗。其中,男31例,女28例,年龄17~81(58.2±13.3)岁。病变位于球部24例(40.68%),降部35例(59.32%),降部包括球降交界部11例及乳头部10例,病灶直径0.2~5.0(1.4±0.9)cm。其中包括高血压患者25例,糖尿病患者4例。
所有患者均进行术前评估,评估患者的一般健康状况,基础疾病,并且评估病变的大小、位置、组织病理学(如果可行)、与乳头的位置关系等。所有患者都接受了关于手术过程、手术收益、风险及替代方案的详细解释,并签署了知情同意书。根据相关指南,接受抗血小板药物或抗凝药物治疗的患者在手术前5~7 d停止服药。
1.2 EMR和ESD手术
内镜及相关器械均来自日本奥林巴斯和富士公司,包括电子胃镜(GIF-Q260J,CF-H260AI,Olympus)、十二指肠镜(TJF-260V,Olympus)、超声内镜(EG-530UR2,Fujifilm)、透明帽(D-201-11804,D-201-13404,Olympus)、注射针(NM-200L,Olympus)、IT刀(KD-611L,KD-612L,Olympus)、Hook刀(KD-620LR,Olympus)、Dual刀(KD-650L,Olympus)、圈套器(FD-210U10/15/25,Olympus)、热活检钳(SD-410LR,Olympus)、电切机(ERBE ICC 200D)、止血夹(HX-110LR,2.75 mm,Olympus)。
手术操作步骤:①术前评估:胃镜或十二指肠镜确定乳头及病变位置,对于黏膜层来源的病变,术前行染色或放大内镜了解腺管开口类型;对于黏膜下层来源的病变,术前行超声内镜明确病变来源层次;②根据病变来源、层次选择合适的术式,黏膜层病变,未侵及黏膜下层,采用EMR;黏膜下层病变采用ESD;③创面处理:切除病灶后,对创面可见的小血管行氩离子血浆凝固术(argon plasma coagulation,APC)凝固治疗或用热活检钳夹闭,必要时应用金属夹夹闭创面;④部分ESD术中穿孔病例,使用荷包缝合和吻合夹系统(over-the-scope clip,OTSC)进行创面吻合。术中情况见图1~3。

图1 十二指肠球部前壁神经内分泌瘤G2期ESD+荷包缝合Fig.1 ESD for neuroendocrine tumors G2 (NET G2) on anterior wall of duodenal bulb and use of the endoloop and hemoclips to close a duodenal defect
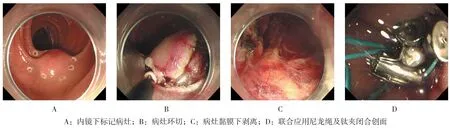
图2 十二指肠球降交界部间质瘤ESD+荷包缝合Fig.2 ESD for stromal tumors in the intersection of the first and second portions of duodenum and use of the endoloop and hemoclips to close a duodenal defect
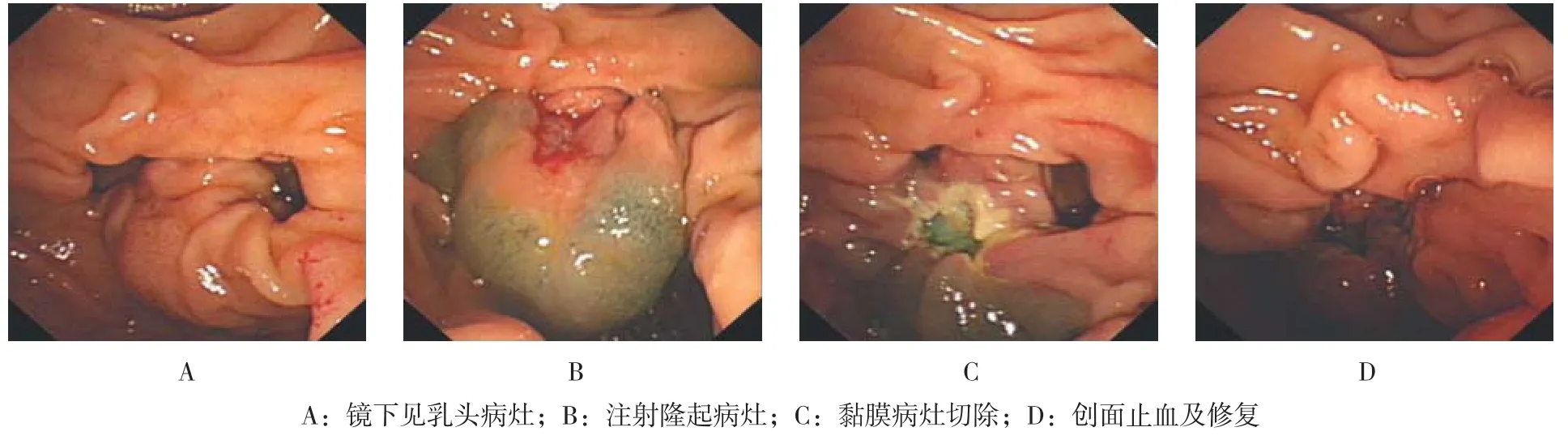
图3 十二指肠乳头占位性病变行EMR术Fig.3 EMR for lesion on duodenal papilla
1.3 术后处理和随访
术后患者取半卧位,予禁食、胃肠减压、预防感染和抑酸止血等处理,复查血象正常并行消化道造影无明显异常后予进食。对于术中有穿孔、内镜下金属夹夹闭创面或荷包缝合创面的患者可适当延长禁食的时间。术后1个月来本院行第一次胃镜复查。以后根据创面愈合情况及术后病理结果,复查间隔可延长至3~6个月,随后可延长至每年复查一次。
1.4 统计学方法
采用Stata 12.0统计软件进行数据分析。计量资料以均数正负标准差(±s)表示,采用单因素Logistic回归分析,检验水准α=0.05。
2 结果
2.1 手术情况
本研究59例均成功完成内镜下治疗,预后良好。其中EMR术34例(57.63%),ESD术25例(42.37%)。全组围手术期发生并发症4例(6.78%),均为术后迟发性出血,1例为ESD术后,3例为EMR术后,1例予内镜下钛夹夹闭止血,2例予内镜下喷洒止血凝胶,1例予保守治疗,4例患者预后均良好,附表所示,术后迟发性出血并无明显的风险因素(P>0.05)。术中医源性穿孔5例,均为ESD术,4例行荷包缝合术,1例行OTSC术,5例患者经治疗后均未出现并发症。2例后期追加外科手术治疗,术后病理1例为神经内分泌肿瘤G2期,1例为腺癌。
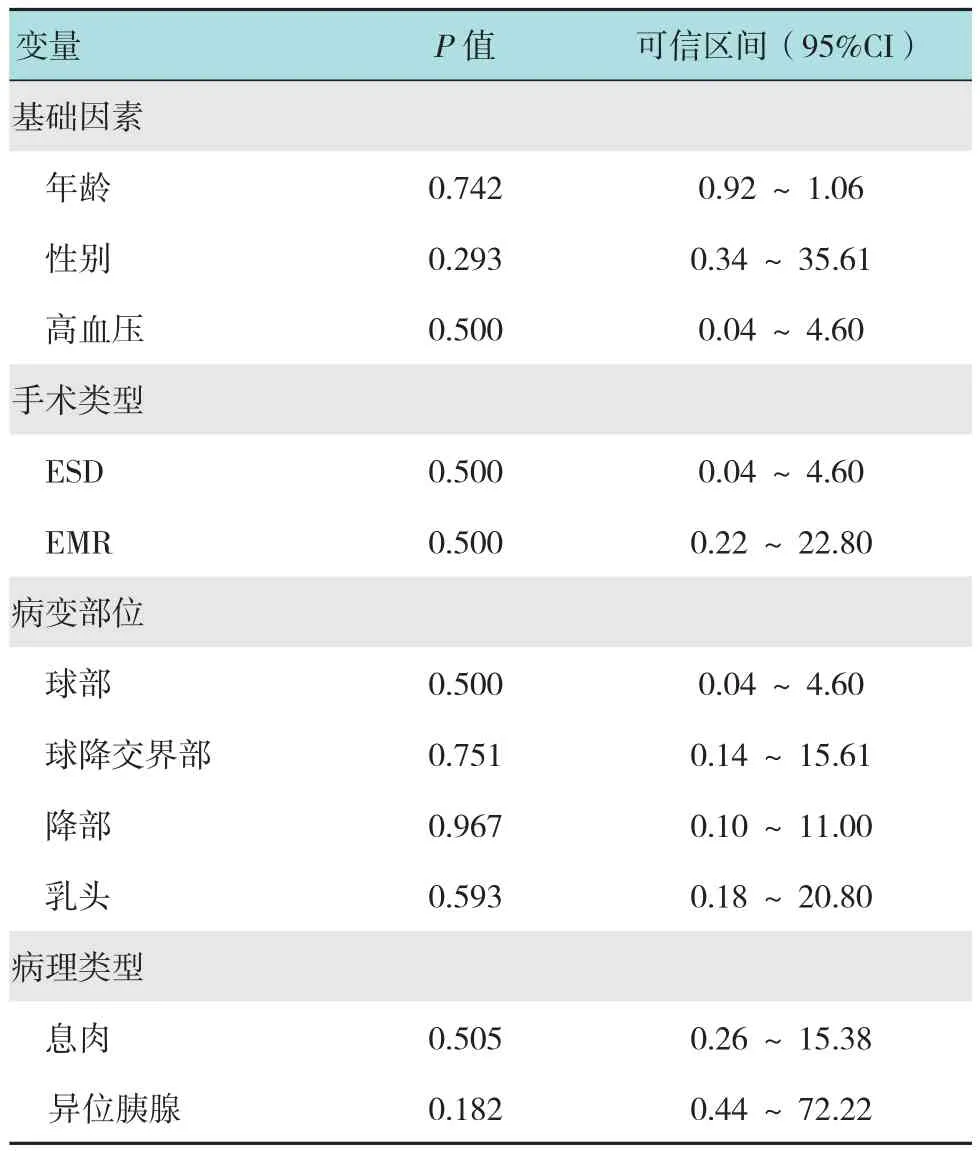
附表 单因素Logistic回归分析内镜下治疗术后迟发性出血的危险因素Attached table Simple factor Logistic regression analysis of risk factors for postoperative delayed bleeding
2.2 术后组织病理学检查
59例患者中,病变来源于黏膜层者39例(66.10%),包括炎性或增生性息肉18例,绒毛状-管状腺瘤6例,高级别上皮内瘤变5例及其他。来源于黏膜下层的病变者20例(33.90%),包括布氏腺瘤4例,异位胰腺5例,脂肪瘤4例,间质瘤4例,神经内分泌瘤2例,平滑肌瘤1例。
2.3 随访结果
2例后期追加外科手术治疗,术后病理1例为神经内分泌肿瘤G2型,1例为腺癌。术后病理切缘均阴性,未见肿瘤细胞。59例患者均接受了3~30(10.8±7.9)个月的术后随访,接受了1~3次不等的内镜检查。随访期间无1例复发。复查情况见图4。
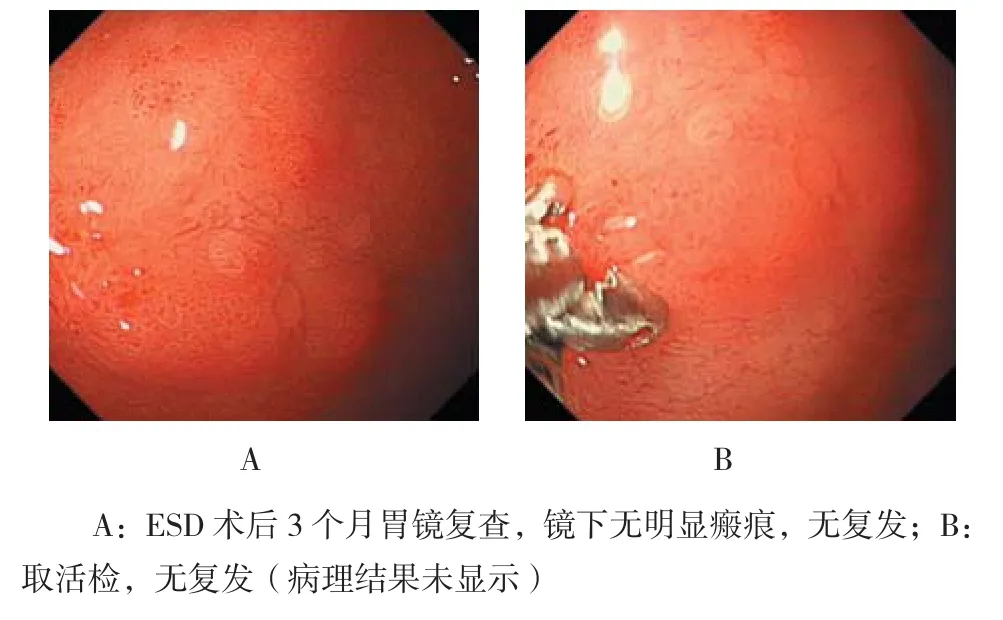
图4 十二指肠球部神经内分泌瘤G2期行ESD术后3个月胃镜复查Fig.4 Gastroscopy 3 months later after ESD for neuroendocrine tumors G2
3 讨论
十二指肠占位性病变发病率极低,良性占位性病变的发生率仅为0.008%,主要包括息肉、囊肿、异位胰腺、Brunner腺瘤和脂肪瘤等[4],多发生在十二指肠降部[6-7]。本组病例资料提示,息肉所占的比例达30.51%(18/59),为最常见的十二指肠占位性病变,其他依次为腺瘤、异位胰腺等,病变位于球部24例(40.68%),降部35例(59.32%),与文献报道相仿[8-9]。
随着内镜下治疗技术的不断发展与成熟,围手术期的并发症发生率及处理受到广泛重视。内镜下治疗的并发症主要包括出血、穿孔及胰腺炎等,发生率为10.00%~30.00%不等[10]。KLEIN和AHMAD等[11-12]认为十二指肠EMR术后出血风险与占位的大小正相关。而LÉPILLIEZ等[7]则认为,出血主要与十二指肠解剖位置与肠壁薄弱的特性相关。在本组研究中,术后迟发性出血并无明显的风险因素(P>0.05)。笔者认为,本组研究中仅纳入59例患者,其中4例出血,样本量较小,可能存在较大偏倚。内镜医生操作水平等原因也可能影响相关结果。
在操作上,KEDIA等[6]提出,对于带蒂或直径<1.5 cm不带蒂的占位性腺瘤采取圈套器套扎,无蒂且直径>1.5 cm的腺瘤采取黏膜下注射,并注射1∶10 000的去甲肾上腺素以防止术中出血。本组术中注射亚甲蓝或生理盐水隆起病灶,仅对于术中创面渗血或有出血风险的患者注射1∶10 000去甲肾上腺素,对于创面可见的小血管行APC术或用热活检钳夹闭,创面较大者则用钛夹夹闭创面,以减少术后迟发性出血的可能。并发症的发生与选择正确的手术方式密切相关,如术中穿孔仅出现在5例接受ESD术的患者当中,这与ESD的操作难度、病变所涉及肠壁层次及术中选择性主动穿孔相关。本研究全组并发症发生率仅为6.78%,且经过内镜下治疗或保守治疗后病情均好转,预后与未发生穿孔者并无明显差异,说明充分的术前准备及良好的术中操作可以有效预防并发症的发生,使得内镜下治疗十二指肠占位性病变安全可行。
有研究表明足够的内镜治疗策略可以导致有利的结果和良好的预后[13]。ESD和EMR已被确立为用于治疗胃、食道和结肠表面肿瘤的可固化安全程序,而大多数内镜下切除十二指肠肿瘤的策略仍未定义[13]。本组中,根据术前评估结果(包括胃镜检查所见息肉外部形态,超声胃镜探及病灶层次、浸润深度等)由内镜医师选择EMR或ESD。EMR针对黏膜层病变,未侵及黏膜下层;ESD应用于黏膜下层病变。HOTEYA等[14]分析认为ESD与EMR的两组患者的术后出血与穿孔的发生率差异无统计学意义。而BASFORD等[15]也认为迟发型出血的风险与所使用的内镜技术不相关。本组研究中也发现,术后出血发生率在不同术式中并无明显区别。一般认为,ESD相较于EMR穿孔风险更大,但完全切除病变的可能性也更大,在LÉPILLIEZ等[7]的研究中仅19.00%的EMR病例组织学证实了完全切除。BACKES等[16]分析认为,ESD能一次性完全切除病灶,与EMR在并发症上并无明显差异,长期预后上则有明显优势,而且避免了反复的额外的内镜检查,有效提高了手术效益。本组中患者ESD术后预后均良好,无1例复发,说明了ESD在十二指肠病变治疗中的有效性。因此,笔者认为,合理进行术前评估,对具有适应证的患者应首选ESD术,以求一次性完全切除病灶,从而追求更高的医疗效益。
十二指肠乳头是胰胆管在十二指肠的共同开口,由于解剖位置的特殊性,该部位容易发生出血、穿孔和胰腺炎等并发症。十二指肠乳头部占位多为腺瘤,是一种少见的良性肿瘤,但目前认为其与结肠腺瘤一样具有恶变的潜能[17]。本组患者中共有乳头部占位者10例,术前行超声内镜(endoscopic ultrasonography,EUS)提示病变局限于十二指肠黏膜及黏膜下层,术前行内镜下逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography,ERCP)了解腺瘤是否侵犯胰胆管,EMR和ERCP操作均由同一名经验丰富的内镜医师完成。术后病理示6例为腺瘤,其中3例伴有高级别上皮内瘤变,提示乳头部腺瘤高度恶变可能。本组10例十二指肠乳头部占位患者中仅1例予术后1 d出血,内镜下给予去甲肾上腺素冲洗止血,并予输血,预后良好。本组患者术前联合EUS和ERCP评估,减少了术后并发症的发生。对于伴有胆道疾病或由于乳头部肿瘤引起胆道梗阻的患者,还可以同时行胆道内的支架置入或解除胆道梗阻,避免了患者承受重复手术的痛苦,减轻了患者生理与经济负担,同时为后续治疗争取了时机。
2013年,SHI等[18]报道了一种新型的“内镜下间断缝合法”,此方法联合了传统的尼龙绳及钛夹用于闭合手术创面,广泛应用于修补胃ESD术中的医源性穿孔或主动穿孔。根据此方法,本中心在2010年-2015年采用改进后的荷包缝合技术,对共计37例内镜下诊疗导致消化道穿孔的患者进行创面的闭合处理,均取得良好预后[19]。本中心将荷包缝合技术应用于闭合十二指肠创面,国内鲜有相关的报道。术后患者一般情况可,仅少量腹腔内积气,经保守治疗后均好转。这可能与荷包缝合技术尚不成熟,在十二指肠中应用较少相关,但并未显著影响患者的预后。在一项仅应用钛夹闭合创面的研究中,术后3个月的胃镜复查结果表明15例患者创面黏膜重生,可见明显的绒毛,但瘢痕处褶皱消失,其中行广泛切除的患者出现了管腔狭窄[20]。这与十二指肠的特殊解剖结构、位置相对固定、肠腔较窄且弯曲、可利用空间较小和内镜下操作难度较大相关。在本组的4例行荷包缝合患者术后复查中,创面光滑,黏膜重生完好,肠腔未见明显狭窄,预后明显优于仅用钛夹夹闭创面的患者。
综上所述,荷包缝合是内镜下固有肌病灶切除、全层切除和大块病灶切除后闭合创面的有效手段,针对十二指肠肠壁薄弱、操作空间狭小等特点做出相应改进,在治疗十二指肠占位性病变上有很大的发展空间。十二指肠占位病变的内镜下治疗,仍处于发展阶段,EMR技术相对成熟,ESD技术的并发症相对较多。但内镜下治疗有效地避免了大部分传统的外科手术,减少了患者的痛苦,缩短了住院周期,提高了医疗效率,而在预后上两者并没有明显的差别。内镜下治疗十二指肠占位性病变是安全且有效的。只要掌握合适的适应证,根据全面的术前评估选择适当的内镜下治疗技术,减少围手术期并发症,降低治疗费用,提高医疗效益,内镜下治疗可作为十二指肠占位性病变治疗的选择之一。
[1]CAMERON J L, RIALL T S, COLEMAN J, et al. One thousand consecutive pancreaticoduodenectomies[J]. Ann Surg, 2006, 244(1):10-15.
[2]KEMP C D, RUSSELL R T, SHARP K W. Resection of benign duodenal neoplasms[J]. Am Surg, 2007, 73(11):1086-1091.
[3]KRUKOWSKI Z H, EWEN S W, DAVIDSON A I, et al. Operative management of tubulovillous neoplasms of the duodenum and ampulla[J]. Br J Surg, 1988, 75(2):150-153.
[4]HONDA T, YAMAMOTO H, OSAWA H, et al. Endoscopic submucosal dissection for super fi cial duodenal neoplasms[J]. Dig Endosc, 2009, 21(4):270-274.
[5]FATHY O, ABDEL-WAHAB M, ELGHWALBY N, et al. Surgical management of peri-ampullary tumors:a retrospective study[J]. Hepatogastroenterology, 2008, 55(85):1463-1469.
[6]KEDIA P, BRENSINGER C, GINSBERG G. Endoscopic predictors of successful endoluminal eradication in sporadic duodenal adenomas and its acute complications[J]. Gastrointest Endosc, 2010, 72(6):1297-1301.
[7]LÉPILLIEZ V, CHEMALY M, PONCHON T, et al. Endoscopic resection of sporadic duodenal adenomas:an efficient technique with a substantial risk of delayed bleeding[J]. Endoscopy, 2008, 40(10):806-810.
[8]KRAFT M, ARENS C. Technique of high-frequency endolaryngeal ultrasound[J]. The Journal of laryngology and otology, 2008,122(10):1109-1111.
[9]ICHIKAWA T, KUDO M, MATSUI S, et al. Endoscopic ultrasonography with three miniature probes of different frequency is an accurate diagnostic tool for endoscopic submucosal dissection[J]. Hepatogastroenterology, 2007, 54(73):325-328.
[10]YAMAMOTO H. Technology insight:endoscopic submucosal dissection of gastrointestinal neoplasms[J]. Nat Clin Pract Gastroenterol Hepatol, 2007, 4(9):511-520.
[11]KLEIN A, NAYYAR D, BAHIN F F, et al. Endoscopic mucosal resection of large and giant lateral spreading lesions of the duodenum:success, adverse events, and long-term outcomes[J]. Gastrointest Endosc, 2016, 84(4):688-696.
[12]AHMAD N A, KOCHMAN M L, LONG W B, et al. Efficacy, safety, and clinical outcomes of endoscopic mucosal resection:a study of 101 cases[J]. Gastrointest Endosc, 2002, 55(3):390-396. [13]HOTEYA S, FURUHATA T, TAKAHITO T, et al. Endoscopic submucosal dissection and endoscopic mucosal resection for nonampullary super fi cial duodenal tumor[J]. Digestion, 2017, 95(1):36-42.
[14]HOTEYA S, IIZUKA T, KIKUCHI D, et al. Bene fi ts of endoscopic submucosal dissection according to size and location of gastric neoplasm, compared with conventional mucosal resection[J]. J Gastroenterol Hepatol, 2009, 24(6):1102-1106.
[15]BASFORD P J, GEORGE R, NIXON E, et al. Endoscopic resection of sporadic duodenal adenomas:comparison of endoscopic mucosal resection (EMR) with hybrid endoscopic submucosal dissection (ESD) techniques and the risks of late delayed bleeding[J]. Surg Endosc, 2014, 28(5):1594-1600.
[16]BACKES Y, MOONS L M, VAN BERGEIJK J D, et al. Endoscopic mucosal resection (EMR) versus endoscopic submucosal dissection (ESD) for resection of large distal nonpedunculated colorectal adenomas (matilda-trial):rationale and design of a multicenter randomized clinical trial[J]. BMC Gastroenterol, 2016, 16(1):56.
[17]YAO T, IDA M, OHSATO K, et al. Duodenal lesions in familial polyposis of the colon[J]. Gastroenterology, 1977, 73(5):1086-1092.
[18]SHI Q, CHEN T, ZHONG Y S, et al. Complete closure of large gastric defects after endoscopic full-thickness resection, using endoloop and metallic clip interrupted suture[J]. Endoscopy, 2013, 45(5):329-334.
[19]李全鹏, 缪林, 张秀华, 等. 荷包缝合技术治疗内镜相关消化道穿孔[J]. 中华消化内镜杂志, 2016, 33(8):558-560.
[19]LI Q P, MIAO L, ZHANG X H, et al. Treatment of digestive tract perforation with endoscopic purse-string suture[J]. Chinese Journal of Digestive Endoscopy, 2016, 33(8):558-560. Chinese
[20]ALEXANDER S, BOURKE M J, WILLIAMS S J, et al. Emr of large, sessile, sporadic nonampullary duodenal adenomas:Technical aspects and long-term outcome (with videos)[J]. Gastrointest Endosc, 2009, 69(1):66-73.
