玉屏风颗粒对急性发作期哮喘患儿H4R表达的影响
2018-02-06高宇沈朝斌周霖刘晓颖雷蕾曹诗燕蒋瑾瑾
高宇,沈朝斌,周霖,刘晓颖,雷蕾,曹诗燕,蒋瑾瑾
(1.第二军医大学附属长海医院儿科,上海 200433;2.上海中医药大学附属上海市中西医结合医院儿科,上海 200082)
支气管哮喘是儿童常见的一种呼吸道疾病,由肥大细胞、T淋巴细胞、嗜酸性粒细胞以及上皮细胞、中性粒细胞等气道炎性细胞以及结构细胞和细胞组分参与,以气道高反应性和慢性气道炎症为主要特征,其反复发作,迁延难愈,对家庭和社会造成了不可忽视的影响[1]。全球范围内,随着气候环境的恶化,哮喘的发病率和死亡率呈现出逐年上升的趋势[2]。玉屏风颗粒具有抗炎、抗菌、抗过敏及调节免疫功能的作用,对哮喘有一定的治疗效果。为此,我科对玉屏风颗粒治疗哮喘展开相关研究。
1 资料与方法
1.1 一般资料 选取2016年1月—12月在第二军医大学附属长海医院儿科就诊的哮喘患儿120例分别纳入哮喘急性发作期组及哮喘临床缓解期组。其中哮喘急性发作期组患儿表现为突然发生喘息、咳嗽、气促、胸闷等症状,共选取60例,其中男性36例,女性24例,年龄3.42~12.58岁,平均(7.15±2.14)岁;哮喘临床缓解期组患儿指经过治疗或未经治疗哮喘症状、体征消失,肺功能恢复到急性发作前水平,并维持3个月以上,共选取60例,其中男性34例,女性26例,年龄3.83~12.42岁,平均(7.16±2.02)岁;同时选取同期来我科门诊体检的健康儿童60例为健康对照组,其中男性35例,女性25例,年龄3.75~11.75岁,平均(6.93±1.89)岁。以上三组性别、年龄组成均差异无统计学意义(P>0.05)。本研究得到了第二军医大学附属长海医院医学伦理委员会批准。
1.2 入选标准 诊断符合儿童支气管哮喘诊断与防治指南(2016年版)[3]哮喘诊断标准:(1)反复喘息、咳嗽、气促、胸闷,多与接触变应原、冷空气、物理、化学性刺激、呼吸道感染、运动以及过度通气(如大笑和哭闹)等有关,常在夜间和(或)凌晨发作或加剧;(2)发作时双肺可闻及散在或弥漫性,以呼气相为主的哮鸣音,呼气相延长;(3)上述症状和体征经抗哮喘治疗有效,或自行缓解;(4)除外其他疾病所引起的喘息、咳嗽、气促和胸闷;(5)患儿近亲属均签署知情同意书。
1.3 排除标准 有以下情况者需排除:(1)近8周内使过抗组胺药物或者糖皮质激素;(2)患儿已使用或曾使用其它中成药或中药汤剂;(3)用过免疫抑制剂或患有其他免疫系统疾病者;(4)急性发作期重症哮喘,并需静脉补液治疗。
1.4 治疗方法及疗程 将60例支气管哮喘急性发作期患儿确诊后均按哮喘急性发作期医院治疗流程,吸入速效β2受体激动剂联合抗胆碱能药物、吸入糖皮质激素(ICS)及氧疗,存在感染者予抗感染治疗,待将哮喘控制进入不需要使用糖皮质激素的治疗阶段后,将患儿采用随机数字表法随机分为两组,其中常规治疗组30例,玉屏风组30例,两组患儿在性别、年龄、病程及病情轻重方面差异无统计学意义。常规治疗组给孟鲁斯特(顺尔宁,默沙东投资有限公司),1~5岁4 mg,每晚顿服;>5岁5 mg,每晚顿服,连续用药8周;玉屏风组除给予孟鲁斯特治疗外,联合玉屏风颗粒(广东环球制药有限公司)口服治疗,3~6岁每次5 g,每日2次;>6岁每次5 g,每日3次,持续治疗8周。
1.5 实验室指标检测 用实时定量荧光聚合酶链反应(RT-PCR)及 Western蛋白印迹法(Western blot)检测支气管哮喘急性发作期患儿、支气管哮喘临床缓解期患儿、健康对照儿童三组对象外周血单个核细胞中组胺H4R的基因含量及蛋白表达,用酶联免疫吸附试验(ELISA)检测三组对象外周血血清人白细胞介素-12(P70)[IL-12(P70)]的含量。
用RT-PCR及Western blot检测玉屏风组和常规治疗组治疗前后外周血单个核细胞中组胺H4R的基因含量及蛋白表达,用ELISA法检测两组对象治疗前后血清IL-12(P70)水平的变化。
1.6 主要仪器与试剂 PCR仪ViiA7(life technology ABI),电泳仪、转膜仪DYCZ-40D(北京市六一仪器厂),X射线摄影暗匣AX-II(广东粤华医疗器械厂有限公司),酶标仪DNM-9602(北京普朗新科技有限公司),H4R、β-actin引物(Invitrogen公司),逆转录试剂盒(Biotnt),BCA蛋白定量试剂盒(Roche),IL-12(P70)ELISA试剂盒(博士德生物)。
1.7 研究方法 入组儿童均于清晨空腹采集静脉血3 mL×2管,4℃下离心20 min,转速3 000 r·min-1,取血清置于超低温冰箱(-80℃)中采用ELISA法待检IL-12(P70)水平,具体操作程序严格按说明书进行;留取下层血样,用密度梯度离心法分离并提取外周血单个核细胞,最后放置-80℃的冰箱中保存,用RT-PCR及Western blot检测组胺H4R的基因含量及蛋白。
1.7.1 使用RT-PCR进行H4R mRNA的检测 在Genbank查找H4R及内参基因的mRNA序列,采用oligo和primer5设计引物,设计好的引物由Invitrogen公司合成。H4R的引物:上游引物5′-GTC CCA TTT CTT CCT GTT-3′,下游引物 5′-GCA GTC TCT TCA CCA TCT-3′;内参基因β-actin引物:上游引物5′-GAA ATC GTG CGT GAC ATT-3′,下游引物 5′-AGG CAG CTC GTA GCT CTT-3′。
采用Trizol一步法从细胞中提取总RNA,异丙醇法浓缩RNA,提取出的mRNA进行逆转录合成cDNA,以cDNA为模板进行RT-PCR合成,用逆转录试剂盒逆转录合成cDNA后,再用定量PCR仪进行定量PCR检测。
1.7.2 使用Western blot检测H4R的蛋白表达将样本进行总蛋白的提取,使用BCA系统进行蛋白初定量,根据标准曲线和使用的样品体积计算出样品的蛋白浓度,利用BCA蛋白定量结果,均一化所有样本总蛋白浓度,将样本放入恒温金属浴95℃15 min,取出即可上样电泳,电泳转膜后,将转膜制得的承载膜先置于TBST中浸润,在丽春红中染色,验证转膜成功后用TBST将丽春红洗脱,进入孵育步骤,用5%脱脂奶粉封闭1 h,加入稀释过的GPADH一抗 (1∶500),4℃孵育过夜或者室温孵育1.5 h,0.1%TBST液洗膜10 min×3次,加入对应稀释过的二抗(1∶20 000),室温孵育1 h洗膜10 min×3次,洗膜后加入ECL发光液,曝光,显影,定影,此时X线片上相应位置的黑色条带即为最终结果。
1.8 统计学方法 采用统计软件(SPSS19.0)对数据进行分析。计量资料,正态分布者以x±s表示。三组间结果比较采用方差分析,组间两两比较采用SNK-q检验,两组间均数的比较采用独立样本t检验,同一组别治疗前后比较采用配对样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 三组对象组胺H4R mRNA的表达水平及IL-12(P70)的水平 哮喘急性发作期组患儿H4R mRNA表达明显高于哮喘临床缓解期组患儿、健康对照组儿童(P<0.05),哮喘急性发作期组患儿IL-12(P70)低于哮喘临床缓解期组患儿、健康对照组儿童,其差异有统计学意义(P<0.05);哮喘临床缓解期组患儿H4R mRNA及IL-12(P70)与健康对照组儿童差异无统计学意义(P>0.05)。见表1。
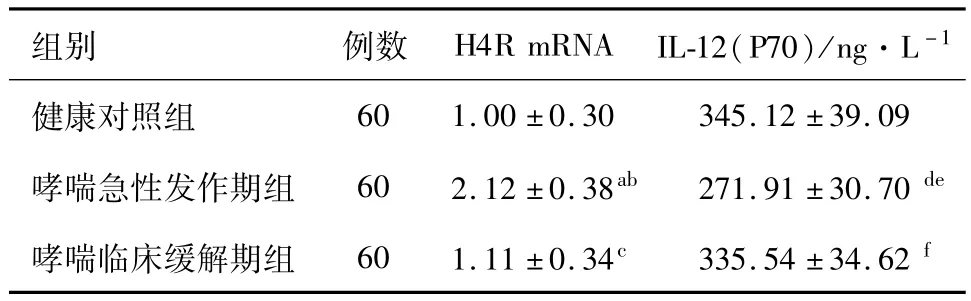
表1 哮喘急性发作期、临床缓解期、健康对照组H4R mRNA及 IL-12(P70)的表达
2.2 三组对象组胺H4R的蛋白表达 见图1。哮喘急性发作期组患儿H4R的蛋白表达均高于哮喘临床缓解期组患儿及健康对照组儿童,哮喘临床缓解期组患儿H4R蛋白表达与健康对照组儿童无明显差异。H4R的蛋白表达结果与H4R mRNA表达结果一致。

图1 哮喘急性发作期、临床缓解期、健康对照组H4R的蛋白表达
2.3 玉屏风组和常规治疗组治疗前后组胺H4R mRNA的表达水平及IL-12(P70)的水平 玉屏风组治疗前H4R的mRNA、IL-12(P70)水平与常规治疗组治疗前水平差异无统计学意义(P>0.05),具有可参照意义;玉屏风组治疗前后H4R的mRNA及IL-12(P70)水平变化差异有统计学意义(P<0.05);常规治疗组治疗前后 H4R的mRNA、IL-12(P70)水平变化差异无统计学意义(P>0.05);玉屏风组治疗后H4R的mRNA、IL-12(P70)水平与常规治疗组治疗后的水平变化差异有统计学意义(P<0.05)。见表2。
2.4 玉屏风组和常规治疗组治疗前后组胺H4R的蛋白表达变化 见图2。哮喘患儿玉屏风组治疗前后H4R的蛋白表达变化有差异,常规治疗组治疗前后H4R的蛋白表达无明显差异。H4R的蛋白表达变化与H4R mRNA表达变化一致。
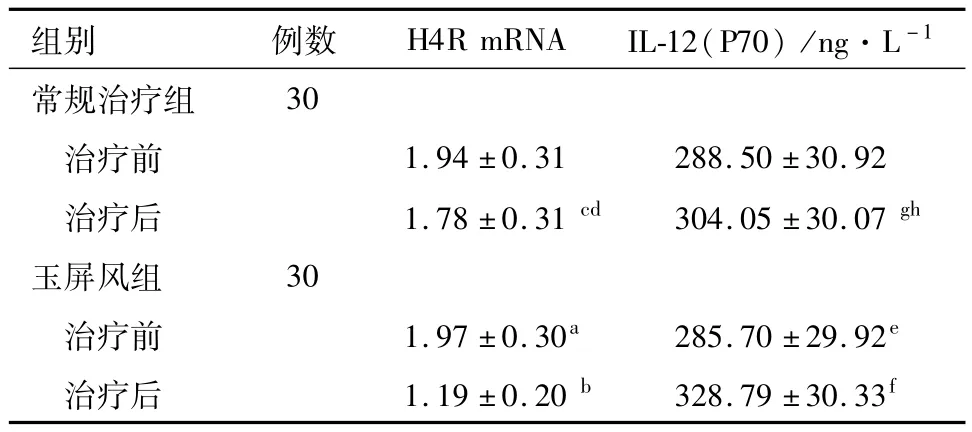
表2 玉屏风组和常规治疗组治疗前后H4RmRNA及IL-12(P70)的表达变化

图2 玉屏风组和常规治疗组治疗前后H4R的蛋白表达
3 讨论
支气管哮喘是一种儿童常见的气道慢性炎症性疾病,其发病率正在逐年上升。吸入性糖皮质激素布地奈德可抑制多种细胞因子的活性而达到控制哮喘患者的呼吸道炎症反应和抑制重塑[4]。但临床研究发现,单纯应用激素虽能较快缓解症状,但对于减少急性哮喘发作次数效果不大,不能改善免疫功能,长期使用可产生一定的副作用[5]。白三烯也参与哮喘发病的多项环节,在哮喘炎症中发挥重要作用。白三烯受体拮抗剂可降低人半胱氨酰白三烯诱导的黏附分子Mac-1的表达和嗜酸性粒细胞游走迁移,抑制气道嗜酸性粒细胞增殖和活化,减少气道嗜酸性粒细胞的浸润,抑制气道变态反应性炎症及对多种炎性介质和细胞因子产生抑制作用[6]。但在临床应用中,单纯使用白三烯受体拮抗剂孟鲁司特控制哮喘发作效果不令人满意。因此,调节哮喘患儿免疫功能至关重要,是预防哮喘发作、达到长期缓解和治愈的重要环节。
玉屏风颗粒主要成分为黄芪、白术、防风,三药合用,犹如在人体表面形成一道屏障,使邪自祛,表自固,气通畅[7]。现代药理学研究表明玉屏风颗粒可双向调节人体免疫状态。有研究表明[8],玉屏风颗粒能下调血清IL-4水平、提升IFN-γ的表达水平,诱发Th1细胞应答,抑制Th2细胞应答,调节支气管哮喘患者的Th1/Th2免疫失衡,从而改善支气管哮喘的治疗功效。最近又有相关研究表明玉屏风可通过对miR-210和miR-126表达的影响抑制参与哮喘的发病机制的Th2和Th17细胞,通过调节Th细胞而达到治疗哮喘的功效[9]。
组胺在过敏反应中起着重要的作用[10]。组胺的生物效应是由组胺受体介导的,H4R是近来比较新发现的受体,具有独特的药理学性质,参与了肥大细胞、树突状细胞和嗜酸性粒细胞的趋化过程以及T细胞、树突状细胞细胞因子的产生。因为这些细胞都涉及哮喘的病因学,并且由于H4R在所有这些细胞中都有表达,因此提示H4R可能在哮喘发病中发挥了重要的作用。
2006年,Dunford等[11]发现 H4R缺陷型小鼠和使用H4R拮抗剂的小鼠患过敏性肺炎的概率较普通小鼠减少。在H4R缺陷型小鼠中,观察到浸润性肺嗜酸性粒细胞数目和淋巴细胞的数目均减少,Th2应答也减轻。Cowden等[12]通过小鼠模型研究发现,使用 H4R拮抗剂 JNJ7777120和JNJ28307474可通过减少IL-4、IL-6等Ⅱ类细胞因子及粒细胞-巨噬细胞集落刺激因子等炎性因子的表达水平,可从而减少嗜酸性粒细胞的浸润及树突状细胞的趋化作用。这些都说明H4R可以调节Th1/Th2的平衡。
研究发现[13],H4R可通过抑制核因子-κB通路下调脂多糖诱导的细胞因子IL-27,而IL-27为细胞因子IL-12家族中一员,从而使Th1细胞型更多向Th2细胞型转化。H4R的刺激可活化转录因子AP-1并抑制IL-12P70水平[14]。也有研究证明H4R激活树突状细胞产生的TNF-α和IL-12水平较低。由于IL-12是调节Th1细胞分化的主要细胞因子之一,可诱导T细胞向Th1细胞分化,并促进Th1分泌IFN-γ、TNF-α及IL-2等细胞因子,同时 IL-12能抑制Th2类细胞因子如IL-4、1L-5等的产生,从而抑制Th2型免疫应答和气道炎症反应。故IL-12水平的变化与Th1/Th2细胞亚群失衡密切相关。
本实验发现支气管哮喘急性发作期患儿组胺H4R表达增高,IL-12(P70)表达降低,而处于临床缓解期患儿与正常儿童水平无差异,说明组胺H4R、血清IL-12(P70)参与了支气管哮喘急性期的炎症反应。发现仅用孟鲁司特对于哮喘患儿组胺H4R及IL-12(P70)表达无明显影响,加用玉屏风颗粒能明显抑制组胺H4R的mRNA及蛋白的表达,提升IL-12(P70)水平,说明玉屏风颗粒能抑制组胺H4R的表达,有效促进IL-12的分泌,促进Th1细胞分化,抑制Th2合成,从而调节与哮喘发生相关的细胞因子的表达,起到免疫调控作用。
[1] 程诗亮,江春燕,倪美良.miR-21与IL-12在儿童支气管哮喘血清中的含量及意义[J].浙江临床医学,2016,18(2):347-348.
[2] 王文东,张念志.气管哮喘缓解期的中医治疗进展[J].河南中医,2013,2(6):21-23.
[3] 中华医学会儿科学分会呼吸学组.儿童支气管哮喘诊断与防治指南(2016年版)[J].中华儿科杂志,2016,16(3):167-181.
[4] 赖天文,吕莹莹,王少冰,等.Notch配体在哮喘气道重塑小鼠中的表达及布地奈德的干预作用[J].分子影像学杂志,2016,16(4):397-402.
[5] 张玉泉.玉屏风颗粒对儿童哮喘缓解期的免疫调节作用[J].承德医学院学报,2013,30(4):299-301.
[6] 徐佳莉.孟鲁司特治疗咳嗽变异性哮喘80例[J].中国医院药学杂志,2012,32(14):1137-1139.
[7] 黄秀君.玉屏风散辅助治疗小儿咳嗽变异性哮喘临床观察[J].新中医,2015,47(10):141-143.
[8] 蔡旭俊.玉屏风颗粒对支气管哮喘患儿Th1/Th2免疫平衡的影响[J].中国实用医刊,2014,41(5):9-11.
[9] 丁肖媛,蔡红,王嵩,等.玉屏风散对支气管哮喘小鼠微小RNA表达的影响[J].中华实用儿科临床杂志,2016,31(4):284-287.
[10]CHEN O,ZHU XB,REN H,et al.The imbalance of Th17/Treg in Chinese children with Henoch-Schonlein purpura[J].Int Immunopharmacol,2013,16(1):67-71.
[11]DUNFORD PJ,O′DONNELL N,RILEY JP,et al.The histamine H4 receptor mediates allergic airway inflammation by regulating the activation of CD4+T cells[J].J Immunol 2006,176(11):7062-7070.
[12]COWDEN JM,ZHANG M,DUNFORD PJ,et al.The histamine H4 receptor mediates inflammation and pruritus in Th2-dependent dermal inflammation[J].J Invest Dermatol,2010,130(4):1023-1033.
[13]GUTZMER R,KOETHER B,GSCHWANDTNER M,et al.Histamine downregulates IL-27,another member of the IL-12 family,via H2R and H4R on human monocytes[C].The European Histamine Research Society Meeting,Durham,UK,2010.
[14]GSCHWANDTNER M,SCHÃKEL K,WERFEL T,et al.Histamine H4 receptor activation on human slan-dendritic cells down-regulates their pro-inflammatory capacity[J].Immunology,2011,132:49-56.
