中学化学课堂自主学习教学模式实践探究
2018-02-05胡云贺罗桂山
胡云贺+罗桂山
以“一杯废液处理的背后——电解质在水溶液中的反应”教学为例,在课堂教学中,通过创设情境、小组互助合作以及自主探究学习的方式实践化学课堂(新授课)自主学习教学模式。
一、问题的提出
“课堂自主学习”是指学生在教师的科学指导下,在课堂上一定的时间内,对指定的学习内容,通过能动的创造性的学习活动,实现自主性发展的教学实践活动。通过自主学习模式的构建,能有效激发学生内在的学习兴趣,培养学生学习的自主性、主动性和创造性,使之不仅会学习,而且爱学习,进而养成良好的学习习惯,并为其终身学习奠定坚实的基础。
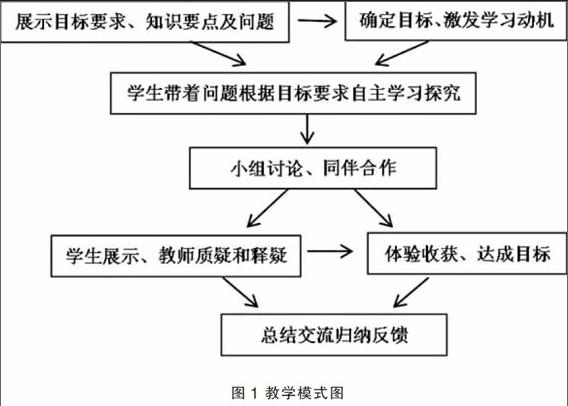
笔者有幸参加罗桂山老师主持的“化学课堂自主学习教学模式的建构研究”课题组,通过不断地实践探究,课题组提出新授课的教学模式。
该流程图包含三个环节,首先教师展示目标要求、知识要点及问题,采用任务驱动,确定目标、激发学生的学习动机;此环节中,教师要尽可能创设问题情景,把学生的思维引入与问题有关的情境中,调动学生的主动性,使学生萌生解决问题的愿望。环节二是学生的自主探究学习过程,采用小组讨论、同伴合作的学习方式;此环节中教师要尽可能地参与各小组的讨论,引导学生有效的沿着问题的思路去探究。环节三是学生代表展示、教师质疑和释疑,在教师的评价中学生体验收获的喜悦,教学也达成目标。在实践此教学模式时,如何采用任务驱动,激发学生的学习动机;在学生自主学习过程中,教师如何引导学生进行有效讨论;如何使课堂教学过程流畅,达成教学目标。结合“一杯废液处理的背后——电解质在水溶液中的反应”教学的过程进行诠释。
二、设计思路
电解质在水溶液中的反应属于理论教学,理论教学一直是化学教学中的一个难题,如何将枯燥的化学理论转化为学生的知识并指导其学习呢?古希腊生物学家普罗塔弋说过这样一句话:“头脑不是一个要被填满的容器,而是一把需被点燃的火把。”根据这种情况,首先我创设一个情景:“一杯实验室收集的废液在倒入下水道之前如何处理呢?”采用的是任务驱动教学法,激发学生的学习动机。接着我采用了分组实验探究、小组讨论和阅读探究相结合的方式,给学生创设自主学习的空间和时间。在此过程中,我再采用归纳分析法、多媒体辅助教学法,让学生能自主、积极地参与知识的形成过程,实现“三维”教学目标。对于难点处理则采用了思维建模的方法,将难点分散到各个环节中。学生主要采用实验探究、观察思考、交流研讨的方法进行自主学习,边实验,边观察、边记录、边思考,在教师的引导下,按科学的方法处理所得的材料,得出结论,达成学习目标。
三、教学实录
教学环节一:情景引入,生成要探究的问题
PPT展示:水污染图片。
师:桌面上有一杯在实验室收集的废液,能不能直接倒入下水道?
生1:不能,会污染我们的水资源。
生2:污水在排放之前要净化处理。
师:这种废液中的Ag+、Ba2+、Cu2+属于重金属离子,若直接排放会污染水源,如何处理才能排放?
板书:电解质在水溶液中的反应
生1:加入NaCl溶液、Na2SO4溶液、NaOH溶液,产生AgCl、BaSO4、Cu(OH)2沉淀。
生2:加入盐酸、稀硫酸、KOH溶液,产生AgCl、BaSO4、Cu(OH)2沉淀。
生3:加入含Cl-、SO42-和OH-的溶液,产生AgCl、BaSO4、Cu(OH)2沉淀。
师:三种电解质溶液加入废液中反生了化学反应,产生沉淀,从而除去这些重金属离子。电解质溶液之间是如何反应的?反应和离子有什么关系?如何选择电解质以及选择哪些电解质?
教学环节二:实验探究,小组合作进行自主学习
实验探究1:稀硫酸和氢氧化钡在溶液中反应的导电性实验,教师播放录制的“微课视频”。
师:观看视频,在学案上记录实验现象,并小组交流讨论“电流表指针的变化说明了什么问题”“溶液颜色的变化是什么原因引起的”“白色沉淀的成分是什么,如何形成”“稀硫酸与Ba(OH)2溶液混合后反應的实质是什么”四个问题。
学生观看微课视频,小组交流讨论,展示汇报讨论的结论。
师: 稀硫酸与Ba(OH)2溶液反应的实质是电离出的离子发生了反应;反应向着离子浓度减小的方向进行。
师:电解质溶液间反应的实质:电解质电离得到的离子发生了反应。离子反应若要发生需要具备哪些条件?电解质溶液中的离子是否全部都参加了反应?
实验探究2:取2ml0.01mol/LCuSO4溶液于试管中,滴加少量NaOH溶液;取2ml0.01mol/LNa2CO3溶液于试管中,滴加过量盐酸;取2ml0.01mol/L的NaOH溶液于试管中,滴加一滴酚酞试液,再逐滴加入盐酸至过量;取2ml0.01mol/LCuSO4溶液于试管中,滴加少量NaCl溶液。
学生思考,小组实验探究;并小组交流讨论,展示汇报讨论的结论。
生:第1个实验产生蓝色沉淀,因为Cu2+和OH-反应,产生了Cu(OH)2沉淀;第2个实验有气体产生,因为CO32-和H+反应产生CO2气体;第3个实验溶液红色逐渐褪去,是因为OH-和H+反应生成水;第4个实验无现象,不符合复分解反应的条件,没有反应。我们组得出的结论是离子反应若要发生需要能产生沉淀、气体和水,和复分解反应反生的条件是一样的。
师:沉淀的物质属于难溶电解质,水属于难电离的物质,CO2是气体,属于挥发性物质。
师:电解质溶液间的反应实质是离子间的反应,在以上的分析过程中我们也看到,并非所有的离子都参加了反应,因此我们就用实际参加反应的离子符号来表达离子反应,称之为离子反应方程式。请同学们自主学习离子方程式的书写。
板书:离子方程式(用实际参加反应离子的符号来表示化学反应的式子)。
学生阅读教材第32页,完成学案上离子方程式的书写,小组交流讨论,展示汇报。
责任编辑黄博彦endprint
