甘草指纹图谱的研究进展
2018-02-05柯昌虎陈琴华
柯昌虎,严 慧,郑 芳,陈琴华
0 引言
甘草(Licorice)是我国最为常见的中草药之一,约60%的中药配方中含有甘草。药用甘草来源于乌拉尔甘草(GlycyrrhizauralensisFisch)、胀果甘草(GlycyrrhizainflateBat)或光果甘草(GlycyrrhizaglabraL)的干燥根及根茎。现代药理研究表明,甘草具有抗氧化、抗炎、抗病毒、解痉、抗癌、抗过敏、抗溃疡、抗糖尿病等多种活性[1-2],有关甘草化学成分研究表明,甘草主要含有三萜皂苷类、黄酮类、多糖等活性物质[2]。目前我国甘草属植物共18种,植物来源、产地、变异类型、栽培条件、生产方式等方面的不同均使得甘草的成分组成和含量存在差异,且仅以甘草酸或甘草苷等某个单一指标成分难以完整而全面表现出甘草中药材的质量优劣。基于化学技术(色谱、光谱)与现代生物技术的指纹图谱(Fingerprint)是近年来用于表征中药中多成分特征的一种综合性质量分析方法,可以较为全面地反映出中药多成分体系的整体状况,并能体现中药成分的复杂性和相关性,与中医药的传统理论相适应[3],且已成为控制中草药质量的有效手段。将指纹图谱与中药药效评价相结合,基于“谱效关系”,可以确定中药特定药效物质基础。本文就甘草指纹图谱的研究成果进行综述。
1 色谱指纹图谱
1.1 液相
1.1.1 不同来源甘草的高效液相色谱分析 目前,高效液相色谱法(HPLC)应用最为广泛,其分析速度快,信息量大,可以配置不同的检测器,适用于甘草等各类中药材及其制剂指纹图谱的建立与分析。朱中佳等[4]采用HPLC建立了10个不同产地甘草药材的指纹图谱,指认出11个共有峰,相似度均大于0.9,从而为中药甘草的质量控制提供依据。李成义等[5]建立了西北地区16批商品甘草的HPLC指纹图谱,确认了10个特征峰,相似度均大于0.904,聚类分析结果显示,16批甘草共聚为4类,该研究为西北地区商品甘草的质量评价和等级划分提供了依据。Dong等[6]采用HPLC-DAD分析了种子经18 d太空飞行返回地面后培育生长的甘草,HPLC指纹图谱显示出12批样品共有26个共有峰,且太空飞行组中异甘草素、异甘草苷、甘草素、光甘草定4种成分的含量明显高于对照组,表明地外环境可能会影响其次生代谢产物的量,也为药用植物的航天育种提供了科学数据。Chen等[7]采用LC-DAD-MS建立了葛根芩连配方颗粒的LC指纹图谱,对其进行归属研究发现,其中有3个成分源于炙甘草。孙磊等[8]建立了10批产自不同地区炙甘草HPLC指纹图谱,HPLC-MS/MS指认出19个共有峰中的6个指纹峰,相似度范围为0.72~0.99,为炙甘草的质控提供了方法。另外,濮润等[9]建立了不同地区甘草药材的快速高效液相色谱(RRLC)指纹图谱,LC-MS联用技术结合对照化合物指认了其中6个色谱峰,70个产地甘草聚为胀果甘草和乌拉尔甘草两大类,其中乌拉尔甘草数量占84%以上,且发现甘草素葡萄糖芹糖苷、甘草苷和甘草酸3个指标成分的联合可以有效评价甘草品种,从而为甘草商品药材的鉴别及质量控制提供依据。
1.1.2 甘草不同提取成分的高效液相色谱分析 张翠英等[10]采用RP-HPLC法建立了乌拉尔甘草水溶性成分的HPLC指纹图谱,12批样品中共确定了18个共有峰,其中4个特征指纹峰分别为甘草苷、异甘草苷、异甘草素和甘草酸,该研究为乌拉尔甘草药材有效成分研究及其浸膏的质量控制提供了参考。苏本正等[11]采用RP-HPLC法建立了甘草饮片乙酸乙酯提取部位HPLC指纹图谱,比较了生炙饮片乙酸乙酯部位化学成分差异,10批甘草样品测定结果发现:①不同产地甘草饮片图谱与对照图谱之间相似度均大于0.90;②甘草与炙甘草乙酸乙酯部位的化学成分有所不同,二者共有峰数目分别为10、8个,且蜜炙使甘草极性成分峰面积增大。该研究为阐明甘草蜜炙后增强药效作用的物质基础,为解析甘草蜜炙原理提供了依据。Zhang等[12]基于比较分析经口服进入消化系统中的甘草成分而建立多组分连续代谢方法,在250 nm下对甘草水提取物进行HPLC指纹图谱分析,按照保留时间的不同标识出13个特征组分,确定出组分2、11分别为甘草苷和甘草酸,并采用LC-MS/MS鉴别出甘草水提取物中的一系列成分。
1.1.3 不同配伍比例甘草的高效液相色谱分析 刘颖等[13]采用RP-HPLC法建立了不同比例甘草海藻配伍的HPLC指纹图谱,结果发现,甘草21个共有峰峰面积随配伍比例的不同而变化,说明二者的配伍比例显著地影响着甘草指纹图谱。王亮等[14]采用HPLC对芫花甘草不同配伍比例的指纹图谱进行比较,并用HPLC-ESI-MS对共有峰进行归属,发现二者配伍后成分的溶出减少,从而可能导致其药理作用下降,其成果从化学成分角度为中药配伍禁忌评价研究提供了思路和方法。陈梅等[15]采用血清HPLC指纹图谱技术考察了芍药甘草汤伍用的合理性,发现甘草单味药有23个入血成分,配伍后二者的生物利用度明显提高,可以产生相互协同作用。
1.1.4 谱效关系 以指纹图谱为基础,可以借助中药的谱效关系来指导相应的药效和药理研究。陈云华[16]采用HPLC确定了甘草的指纹图谱,发现不同来源甘草中甘草酸、甘草苷、异甘草素含量差异明显,并采用误差反传人工神经网络对药材指纹图谱和抗菌作用进行了组效建模和测试,指出可以通过指纹图谱信息预测相关药效。马玲[17]建立了10个不同产地甘草黄酮及皂苷类成分的HPLC指纹图谱,分别确定了11个共有峰和13个共有峰,氨水引咳实验表明,甘草黄酮及皂苷类成分对氨水引起的咳嗽有一定的抑制作用,小鼠致肝损伤实验表明,10个不同产地甘草皂苷类成分均能降低四氯化碳致肝损伤引起的AST、ALT升高,从而对肝损伤具有一定的保护作用。对甘草指纹图谱及药效学数据进行灰色关联分析,发现甘草黄酮中有5个特征峰与镇咳作用高度关联,皂苷中有3个特征峰与血清中AST酶活力高度关联、4个特征峰与血清中ALT酶活力高度关联。
1.2 毛细管电泳 毛细管电泳法(CE)广泛应用于甘草等中药材及其制剂的鉴别及质量评价研究,特别适用于中药中水溶性的极性成分分析。孙国祥等[18]采用毛细管区带电泳法(CZE),对6个厂家各10批以上复方甘草片进行指纹图谱研究,评价不同批指纹与标准对照指纹间的相似性,结果表明,所建立的CE指纹图谱具有较好的稳定性和重现性,可以用于复方甘草片的质量控制。周逸芝等[19]采用高效毛细管电泳法(HPCE),建立了甘草饮片HPCE-DAD指纹图谱分析方法,确定了10个共有峰,对甘草生品及其炮制品的指纹图谱进行了比较,发现二者指纹谱中共有峰的相对峰面积差异较为显著,该方法可用于评价甘草饮片的内在质量。智雪枝[20]也建立了21批复方甘草片的HPCE数字化指纹图谱,确定了18个共有峰,考察了提取溶剂、运行电压、背景电解质三者对电泳图谱的影响,并应用系统指纹定量法判定了复方甘草片的质量等级。
1.3 薄层 薄层色谱(TLC)兼有定性和定量作用,可以提供直观形象的可见光或荧光色谱图像,TLC指纹图谱可以在同一薄层板上同时比较多个样品,并通过获取指纹确定组合物的身份,成为植物原料或天然产物快速可靠的质量检测工具。崔淑芬等[21]以乙酸乙酯-乙酸-甲酸-水(15∶1∶1∶2)为展开剂,于254 nm处对来自内蒙古的5个等级的甘草样品进行薄层吸收扫描,建立了甘草样品TLC指纹图谱,发现6个共有峰,依此建立的柱状条形码图可以快速评判药材品质。在相同条件下又得到了来自不同产地的14个甘草药材样品的TLC指纹图谱,也发现有6个共有峰,聚类分析发现,正品甘草药材有较好的相似度且三维图谱可对不同产地的甘草质量进行直观比较[22]。进一步研究发现,微乳薄层色谱(METLC)指纹图谱可以准确且有效地区分不同甘草样品的特征组成成分,从而成为快速评价甘草质量的工具[23]。崔淑芬等[24]又建立了甘草的胶束薄层色谱(MTLC)指纹图谱,通过优化得到最优胶束流动相为:0.23 mol/L SDS+16%(v/v)正丁醇+11%(v/v)甲酸,在展距为95 mm时分离得到17个色谱峰,且分离效果良好。另外,高效薄层色谱法(HPTLC)自动化程度高,可与其他色谱技术联用,已成为天然产物中复杂化合物的有效分析工具[25]。Liu等[26]利用HPTLC准确地确定了甘草的多种组分,对其进行HPTLC指纹图谱分析,发现有16个共有峰,其中8个指纹峰得到确认,且相似性很高,表明HPTLC可以快速、准确、有效地实现甘草质量的评价。
1.4 气相 不同品种及采集时间的中药挥发性成分出峰时间及含量存在差异,气相色谱以此可将不同中药进行有效区分,通过建立指纹图谱来达到对原料药、中药材及其制剂质量控制的目的。禹晓梅[27]采用GC法对10批甘草药材进行了研究,建立了不同产地甘草药材气相色谱指纹图谱,发现不同产地的甘草中挥发油具有一定的相似性,相似度均在0.78以上,且药材中十六酸的含量均很高。另外,不同产地甘草的成分组成大体相同,流出次序基本一致,且5、12、20、44、48 min左右10批药材均有比较明显的共有峰出现,可以判断不同产地的甘草药材挥发油的绝大部分成分是相同的,说明甘草间具有共性,但在甘草组分的含量上存在一定的差异。
2 光谱指纹图谱
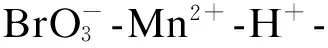
基于振荡指纹图谱等非线性化学原理,方宣启等[32]提出了非线性化学指纹图谱的概念,建立了甘草等中药诱导时间相同的非线性化学指纹图谱,相似度评价能够很好地将甘草从其他中药中鉴别出来,并确立了4个产地甘草中活性物质的当量关系。非线性化学指纹图谱技术成为一种鉴别和评价甘草的新方法,也为其临床使用提供了依据。
2.2 红外 红外光谱是鉴别化合物和确定物质分子结构的有力手段,适用的药材范围广泛,对样品无损伤,是药物的专属鉴别方法。高燕菁等[33]采用傅立叶变换红外光谱法(FTIR)对4种批号且产地均为内蒙古的炙甘草进行质量鉴定,发现所建立的红外指纹图谱不仅能够提供完整的特征图像,准确而形象地鉴别药材的真伪优劣,还可以判别各批次质量的相关性。莫文龙等[34]采用傅立叶红外技术对4个不同产地的甘草样品进行考察,建立其红外指纹图谱,聚类分析将样品分为2个类别,且相同类别中化学组分十分相似,反映出在不同地理位置和气候条件下甘草的多样化,从而为甘草的质量评价和合理开发提供参考。
另外,杨天鸣等[35]采用近红外漫反射(NIRS)技术对来自新疆、内蒙古(种植)、内蒙古(野生)、甘肃4个产地的甘草进行鉴别,建立其近红外指纹图谱。欧氏距离判别分析方法能够清晰地反映出野生和种植的内蒙古甘草相似程度最高,新疆甘草较为接近,甘肃甘草则相差较大,而将其与PLSDA结合则可实现甘草等中药材产地的快速准确鉴别。Wang等[36]通过多级红外光谱(FT-IR、SD-IR和2DCOS-IR)建立了甘草的宏观指纹图谱分析方法,全面表征了甘草的整体及单个活性成分的指纹特征,从而有助于甘草等中草药的综合利用。
2.3 紫外 紫外(UV)指纹图谱法根据药材各成分之间的非对称性关系和药材自身具有遗传稳定性和变异性的生物学特点,从整体上更为细致地反映药材的成分信息。采用UV指纹图谱共有峰率和变异峰率双指标序列法可以从整体或局部区别不同品种野生和种植甘草的远近关系。邹华彬等[37]采用氯仿、无水乙醇及水3种溶剂系统提取甘草中不同极性区间成分,建立了多维共有峰率和变异率双指标序列紫外指纹图谱,分析甘草样品,发现野生甘草与种植甘草以及产地和品种不同的甘草之间差异显著,该方法可以对两个或多个甘草样本进行可靠的鉴别。王玲[38]建立了黄芪、甘草等9种中药的UV指纹图谱,发现不同浓度的甘草水提醇沉液紫外吸收图谱相似,200~500 nm区间内的紫外吸收值存在差异,在271.00 nm处甘草浓度与吸收值之间线性关系良好,借此可以对其进行定量分析,从而对中药饮片及其提取物进行质量评价。张丹等[39]采用UV测定附子与甘草不同炮制品配伍前后总生物碱、酯型生物碱含量,结合指纹图谱研究配伍前后附子甘草总体成分变化,发现配伍后附子总生物碱、酯型生物碱均降低,炙甘草降低的程度要高于生甘草;从指纹图谱分析可知附子甘草配伍后,生甘草各成分的总加权变化率总体上有所降低,而炙甘草各成分的总加权变化率总体上有所增加,从而说明炙甘草解毒的作用强于生甘草,达到很好的减毒作用。
2.4 X射线 X射线图谱可以反映出物质的固有属性,使其具有指纹特性,重现性好、专属性强,在中药鉴别和质量评价中具有独特的优势和广阔的应用前景。张丽娟等[40]采用粉末X射线衍射Fouirer指纹图谱鉴定法,对甘草对照品(2个)和内蒙古产甘草样品(8个)进行分析,获得了甘草的标准X射线衍射Fouirer指纹图谱及特征标记峰值,结果发现:①甘草药材对照品1#和2#具有一致的几何拓扑图形,共有40个衍射峰值,其中有3个特有的衍射特征标记峰,衍射峰一致程度分别为91%、87%;②第一类甘草药材3#~6#具有一致的几何拓扑图形,共有30个衍射峰值,其中有6个特有的衍射特征标记峰,衍射峰一致程度分别为83%、71%、75%、79%;③第二类甘草药材7#~10#甘草药材对照品具有一致的几何拓扑图形,共有25个衍射峰值,其中有10个特有的衍射特征标记峰,衍射峰一致程度分别为86%、63%、63%、76%;④所有甘草药材均含有α-石英、一水草酸钙,且含量各自存在差异。以上结果表明,X射线衍射Fouirer指纹图谱中的几何拓扑图形与衍射特征标记峰值可以作为甘草药材的鉴定依据。
2.5 NMR1H NMR和13C NMR是鉴别中药中有机化合物结构的有力手段,其指纹图谱具有高度的特征性和重现性,且与植物品种间存在十分准确的对应关系,特别适用于中草药的真伪鉴别和质量评价。Farag等[41]研究发现,在600 MHz下,以氘代甲醇作为溶剂,光果甘草1H NMR图谱显示有3个特征区域:①查尔酮和黄烷酮类的芳香质子(5.5~8.0 ppm),②糖单元的异头质子(4.0~5.5 ppm),③甘草酸的甲基、亚甲基和次甲基(0.8~3.2 ppm)。在其芳香区域(5.5~9.0 ppm)中甘草查尔酮A信号相当强。以上数据均表明,NMR代谢指纹分析可以有效区分胀果甘草和其他3个品种。
3 联用技术
联用技术的运用实现了色谱法与波谱法的有力结合,它兼具分离能力和结构鉴别能力,已成为中药品种鉴别和质量评价的有效方法。段天璇等[42]以甲醇为溶剂对内蒙古野生和人工栽培的乌拉尔甘草以及新疆胀果甘草进行提取,建立其甲醇提取物的HPLC-DAD及HPLC-MS指纹图谱,结合文献推断出17个色谱峰中19个可能的成分,并发现野生和栽培、野生不同品种甘草的色谱峰的数量不同、相同色谱峰的峰面积存在差异,从而为甘草质量、品种、种植及谱效关系等各类研究提供较全面的化学依据。王爱潮等[43]建立了14批温胆汤的UPLC-UV指纹图谱,共标记了22个共有峰,相似度在0.863~0.998,分别以内蒙古3个产地的甘草作为阴性对照品,发现3号、9号、10号、18号和20号峰来源于甘草;UPLC-MS/MS法定性分析发现9号色谱峰为甘草苷,18号色谱峰为甘草酸,所建立的UPLC-UV-MS/MS指纹图谱方法可靠、准确,可以将其应用于温胆汤等复方的质量控制。
Farag等[41]对刺果甘草、胀果甘草、光果甘草及乌拉尔甘草根部的代谢物和指纹图谱进行了比较分析,LC-MS分析结果显示,包括三萜皂苷类、黄酮类和香豆素类在内共有61个化合物,其中有46个得到确认,所有化合物中皂苷类的丰度最高。采用GC-MS对甘草代谢产物进行分析,发现主要代谢物为糖类、脂肪酸和酚酸。在刺果甘草中,糖类和酚酸衍生物含量较高,其他甘草品种中类黄酮和甘草酸的含量占据优势,联用技术的使用有助于确定物种之间的关系。
4 生物指纹图谱
中药生物指纹图谱是从分子水平揭示中药及其与细胞作用后的基因和蛋白的表达特征,研究解决化学成分和药理作用、药效活性的相关性,对于中药品种鉴别更加准确可靠。
周成明等[44]采用AFLP标记技术对乌拉尔甘草栽培新品系“民勤1号”、“喀什1号”、“阿克苏1号”和常规栽培品系内蒙古乌拉尔甘草进行遗传基础研究,筛选得到8对引物组合,对其进行多态性分析,并以E-AAC/M-CAG组合构建不同来源甘草的指纹图谱,UPGMA聚类分析将4个来源甘草分为4组,表现出不同的亲缘关系,“民勤1号”、“喀什1号”、“阿克苏1号”三者的基因构成较为独特,可以作为选育品种进行深入研究。
刘婷[45]采用ISSR分子标记法对甘草、胀果甘草和光果甘草3种药用甘草进行遗传多样性研究,5条引物对60份DNA样品进行ISSR扩增,共扩展出886条有效条带,其中多态性条带共498条,甘草、胀果甘草和光果甘草的多态率分别为48.57%、62.86%和57.14%,三者多态性条带分别为148、187和162条,采用UPGMA聚类法发现三者Nei氏遗传距离分别为0.44、0.47和0.52,三者Nei氏相似系数范围为0.45~0.51,甘草与胀果甘草、光果甘草的遗传相似系数分别为0.51和0.45,且发现ISSR分子标记指纹图谱法和化学色谱指纹图谱法所得结果具有一致性,从而为甘草资源的利用和抚育提供了科学依据。
5 小结
甘草是我国常用的中药材,种类多,质量不一。植物来源、药材产地、生产方式等因素均显著影响甘草的质量,仅以其单个成分也难以完整反映甘草的真实品质,对其制定科学可靠的质量评价体系显得尤为重要。甘草化学指纹图谱技术主要借助光谱、色谱等现代先进技术手段,可以较为全面地反映甘草所含化学成分的真实情况,进而对其质量进行整体描述和评价。甘草生物指纹图谱则在分子水平上反映其遗传多样性,已成为真伪鉴别的有力手段。因此,综合运用各种现代技术对甘草进行深入全面的分析研究,不仅可以进一步明确甘草药效的物质基础,全面控制甘草药材及饮片的质量,还可以进一步完善其鉴别体系和质量评价系统,为甘草的合理开发和应用提供科学依据。
[1] Zhu Z,Tao W,Li J,et al.Rapid determination of flavonoids in licorice and comparison of three licorice species[J].J Sep Sci,2016,39(3):473-482.
[2] Zhang Q,Ye M.Chemical analysis of the Chinese herbal medicine Gan-Cao (licorice)[J].J Chromatogr A,2009,1216(11):1954-1969.
[3] 李强,杜思邈,张忠亮,等.中药指纹图谱技术进展及未来发展方向展望[J].中草药,2013,44(22):3095-3104.
[4] 朱中佳,熊富良,张雪琼,等.不同产地甘草药材高效液相色谱指纹图谱研究[J].医药导报,2011,30(8):1090-1091.
[5] 李成义,马艳茹,李越峰,等.西北地区商品甘草HPLC指纹图谱[J].中国实验方剂学杂志,2012,18(9):129-132.
[6] Dong YY,Gao WY,Zhang JZ,et al.Quantification of four active ingredients and fingerprint analysis of Licorice(Glycyrrhiza uralensis Fisch.)after spaceflight by HPLC-DAD[J].Res Chem Intermed,2012,38(8):1719-1731.
[7] Chen L,Tang YP,Chen MJ,et al.Chemical correlation between Gegen Qinlian dispensing granule and its four raw herbs by LC fingerprint[J].Phytomedicine,2010,17(2):100-107.
[8] 孙磊,靳勇,刘晓晴,等.炙甘草药材指纹图谱研究[J].中国中药杂志,2014,39(11):2056-2059.
[9] 濮润,王卫星,王京辉,等.甘草药材的快速HPLC指纹图谱分析[J].中国中药杂志,2008,33(22):2650-2652.
[10]张翠英,常断玲,周应群,等.乌拉尔甘草水溶性成分的HPLC指纹图谱研究[J].北京中医药大学学报,2009,32(12):842-845.
[11]苏本正,周倩,孙立立.甘草饮片乙酸乙酯提取部位HPLC指纹图谱研究[J].中成药,2011,33(2):203-207.
[12]Zhang L,Zhao H,Liu Y,et al.Metabolic routes along digestive system of licorice:multicomponent sequential metabolism method in rat[J].Biomed Chromatogr,2016,30(6):902-912.
[13]刘颖,武传文,赵春杰,等.甘草与海藻配伍对甘草高效液相指纹图谱的影响[J].辽宁中医药大学学报,2011,13(10):235-238.
[14]王亮,张振秋,邓仕任,等.芫花甘草不同配伍比例的HPLC指纹图谱探讨[J].中国实验方剂学杂志,2015,21(2):80-82.
[15]陈梅,姚楠,周秋香,等.血清HPLC指纹图谱法研究芍药甘草汤伍用的合理性[J].中国药房,2010,21(15):1347-1350.
[16]陈云华.不同来源甘草的化学成分及其相关药效的研究[D].北京:北京中医药大学,2008.
[17]马玲.甘草黄酮及皂苷类成分谱效关系研究[D].银川:宁夏医科大学,2015.
[18]孙国祥,孙毓庆,王宇.复方甘草片的毛细管电泳指纹图谱研究[J].中南药学,2003,1(3):131-134.
[19]周逸芝,韩乐,刘训红,等.甘草饮片HPCE指纹图谱研究[J].中国现代应用药学,2012,29(5):405-409.
[20]智雪枝.复方甘草片数字化指纹图谱研究[D].沈阳:沈阳药科大学,2009.
[21]崔淑芬,蒋轶伦,王小如.薄层色谱指纹图谱在甘草GAP生产与质控中的应用[J].现代中药研究与实践,2004,18(4):3-6.
[22]崔淑芬,蒋轶伦,王小如.甘草药材薄层扫描指纹图谱研究[J].沈阳药科大学学报,2004,21(5):367-370.
[23]崔淑芬.微乳薄层色谱及其在中药甘草指纹图谱质量控制方面的应用研究[D].厦门:厦门大学,2006.
[24]崔淑芬,林焕冰,王小如.胶束薄层色谱分离甘草活性成分的影响因素及优化方法[J].药物分析杂志,2012,32(3):505-511.
[25]Nicoletti M.HPTLC fingerprint:a modern approach for the analytical determination of botanicals[J].Rev Bras Farmacogn,2011,21(21):818-823.
[26]Liu X,Li Q,Lv C,et al.Combination of the advantages of chromatographic methods based on active components for the quality evaluation of licorice[J].J Sep Sci,2015,38(24):4180-4186.
[27]禹晓梅.甘草药材指纹图谱研究及其与清肝注射液非挥发性成分的相关分析[D].长沙:中南大学,2007.
[28]张孟民.化学振荡技术在中药研究中的应用[J].中草药,2006,37(7):961-965.
[29]张秀莉,王金珠,王旭,等.几种豆科中草药的电化学指纹图谱鉴别[J].佳木斯大学学报(自然科学版),2010,28(3):429-430.
[30]李祖君,邹桂华,李守君,等.甘草参与的B-Z振荡反应研究[J].分子科学学报,2011,27(1):14-18.
[32]方宣启,张泰铭,赵哲,等.非线性化学指纹图谱技术在鉴别和评价甘草及其临床应用中的作用[J].科学通报,2010,55(17):1661-1669.
[33]高燕菁,林佳佳,张剑平,等.4种炙甘草样品的质量分析[J].中国药业,2011,20(19):36-37.
[34]莫文龙,唐军,王强,等.聚类分析在甘草红外测定指纹图谱中的应用研究[J].中国石油和化工标准与质量,2013,(3):27-28.
[35]杨天鸣,张璐,付海燕,等.不同产地甘草的近红外指纹图谱模式识别鉴别方法[J].亚太传统医药,2015,11(14):11-14.
[36]Wang Y,Wang P,Xu CH,et al.Macro-fingerprint analysis through separation of licorice based on FT-IR and 2DCOS-IR[J].J Mol Struct,2014,1070(1):1-9.
[37]邹华彬,袁久荣,吕青涛,等.共有峰率和变异率双指标序列分析法分析甘草紫外指纹图谱[J].中药材,2003,26(9):625-629.
[38]王玲.黄芩等中药的紫外指纹图谱及黄芩苷活性研究[D].青岛:青岛农业大学,2011.
[39]张丹,叶强.附子配伍不同甘草炮制品及其比例的研究[J].中国医院药学杂志,2013,33(13):1102-1104.
[34]张丽娟,龚宁波,郑笑为,等.中药材甘草的X射线衍射Fourier指纹图谱鉴定研究[J].中药材,2004,27(5):332-335.
[41]Farag MA,Porzel A,Wessjohann LA.Comparative metabolite profiling and fingerprinting of medicinal licorice roots using a multiplex approach of GC-MS,LC-MS and 1D NMR techniques[J].Phytochemistry,2012,76:60-72.
[42]段天璇,马长华,王文全,等.HPLC-MS法鉴定甘草的指纹图谱[J].中国药师,2009,12(4):414-417.
[43]王爱潮,祁东利,罗配,等.温胆汤UPLC-UV-MS/MS指纹图谱研究[J].中草药,2014,45(23):3408-3413.
[44]周成明,许彬,张金屯,等.乌拉尔甘草优良品系选育研究(Ⅰ)-4个来源甘草遗传基础的AFLP分析[J].中草药,2007,38(7):1078-1081.
[45]刘婷.三种药用甘草遗传多样性和次生代谢物含量研究[D].兰州:甘肃农业大学,2011.
