血浆非对称性二甲基精氨酸与维持性透析患者心血管并发症的相关性研究
2018-02-05梁榆英熊祖应廖玉梅熊子波
梁榆英,熊祖应,廖玉梅,熊子波*
慢性肾脏病(CKD),特别是终末期肾脏病(ESRD)患者心血管疾病(CVD)的高发生率不容忽视[1]。据统计,CVD病死率约占透析患者全因病死率的50%,是正常人群的17倍[2]。美国肾脏病数据统计显示,患者在开始血液透析(HD)后第1年病死率超25%[3],HD和腹膜透析(PD)患者3年存活率分别为52%和61%[4]。如此严峻形势促使学者不断寻找防治CKD患者发生CVD的新切入点,从而提高患者生存率、降低心血管事件发生率。近年来发现的一种CVD新标志物和预测因子,非对称性二甲基精氨酸(ADMA)[5]是其中研究热点之一。目前国外有关于血浆ADMA(pADMA)水平与ESRD患者颈动脉粥样硬化(CAS)和左心室肥厚(LVH)的关系研究[5-8],但研究结论大相径庭,结论尚未明确,国内尚未见系统报道。本研究旨在探讨CKD(包括HD、PD及CKD透析前期)患者pADMA差异,探讨pADMA与维持性透析患者CAS、LVH间的相关性,探讨pADMA对预测ESRD患者不良心血管事件的临床应用价值。
1 资料与方法
1.1 一般资料 选取2015年3—11月于北京大学深圳医院肾内科诊断为ESRD并长期肾脏替代治疗患者108例(ESRD组),其中男70例,女38例;年龄26~80岁,平均年龄(49.7±10.7)岁;透析时间6~276个月,平均透析时间(85.0±66.2)个月;维持性血液透析(MHD)37例,持续性非卧床腹膜透析(CAPD)71例;慢性肾小球肾炎61例,糖尿病肾病21例,梗阻性肾病6例,高血压性肾病4例,自身免疫性相关性肾炎4例,多囊肾3例,其他9例。另选取2014年经临床诊断为慢性肾小球肾炎患者60例(CKD组),其中男41例,女19例;年龄22~68岁,平均年龄(37.5±10.3)岁。ESRD组和CKD组在入选前1个月存在以下任一种情况均排除:严重感染,急性心脑血管疾病,重大创伤及手术史,活动性肝炎,恶性肿瘤,活动性狼疮,正接受激素或免疫抑制剂治疗,静脉注射铁剂。选取2015年12月本院体检健康者60例(对照组),其中男41例,女19例;年龄22~68岁,平均年龄(37.6±10.2)岁。排除高血压、糖尿病、心脑血管疾病及肝肾疾病等。研究对象均签署知情同意书。
1.2 资料收集 收集所有研究对象性别、年龄、身高、体质量、血压、糖尿病、吸烟史、吸烟时间、基础肾脏疾病、透析时间、透析方式等,计算体质指数(BMI)、体表面积(BSA)和平均动脉压(MABP)。男性BSA=0.005 7×身高(cm)+0.012 1×体质量(kg)+0.008 2,女性BSA=0.007 3× 身高(cm)+0.012 7×体质量(kg)-0.152 9。MABP(mm Hg)=舒张压+1/3(收缩压-舒张压)。
1.3 血标本采集 所有研究对象抽血前禁食12 h,清晨采集静脉血5 ml(MHD患者为透析前清晨抽血),血样置于分别含促凝剂/抗凝剂和分离胶的真空采血器并立即离心,以2 500×g,离心15 min,提取上清液,于-80 ℃冷冻保存备用。
1.4 检测指标和方法
1.4.1 临床指标检测 采用全自动生化仪测定血红蛋白(Hb)、血肌酐(Scr)、血清清蛋白(ALB)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、血磷(P)、血钙(Ca)、甲状旁腺激素(PTH)等指标。根据改良简化MDRD方程计算估算肾小球滤过率(eGFR),eGFR =175×Scr-1.234×年龄-0.179×〔0.79(女性)〕。1.4.2 pADMA测定 采用双抗体夹心酶标免疫分析法测定pADMA,pADMA检测试剂盒〔100-310-ADM Human Asymmetrical Dimethylarginine(ADMA) ELISA Kit〕采购于Alpha Diagnostic Intl Inc.,USA。检测过程严格按照人pADMA检测试剂盒说明书操作。
1.4.3 颈动脉超声检测 由超声医师采用美国飞利浦HDI5000超声仪检测。探测双侧颈总动脉斑块、颈动脉内膜中层厚度(cIMT)等。cIMT增厚定义为cIMT≥1.0 mm[9];颈动脉粥样斑块定义为局限性回声结构突出管腔(回声可不均匀或伴有声影),厚度≥1.3 mm;cIMT增厚和/或颈动脉粥样斑块形成为CAS。斑块分级:0级为无斑块,1级为单侧斑块≤2 mm,2级为单侧斑块>2 mm或双侧均有斑块且其中至少一侧斑块≤2 mm,3级为双侧斑块均>2 mm。cIMT是衡量早期CAS的指标[10],而颈动脉粥样斑块是评估CAS的可靠指标[11]。本试验中,联合cIMT与斑块分级对CAS程度进行分级:无CAS包括无cIMT增厚且无颈动脉粥样斑块形成;轻度CAS包括cIMT增厚无颈动脉粥样斑块形成和颈动脉粥样斑块1级无合并cIMT增厚;重度CAS包括cIMT增厚合并颈动脉斑块形成、颈动脉粥样斑块2级或以上无合并cIMT增厚。ESRD组中无或轻度CAS 54例,重度CAS 54例。
1.4.4 超声心动图检测 采用美国GE公司Vivid7彩色多普勒超声诊断仪对透析患者进行测定,根据Deverux公式计算左心室心肌质量(LVM):LVM=0.8×1.04×〔(LVDd+IVST+PWT)3-LVDd3〕+0.6, 其 中 LVDd=左心室舒张末期直径,IVST=室间隔舒张末期厚度,PWT=左心室后壁舒张末期厚度。左心室心肌质量指数(LVMI)是LVM体表面积比,即LVMI=LVM/BAS。
1.5 统计学方法 采用SPSS 19.0软件进行统计学分析,符合正态分布的计量资料以(x ±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用q检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数秩和检验;计数资料的分析采用χ2检验;采用Spearman相关分析进行相关性分析;采用多元线性回归分析影响pADMA、LVMI的因素;采用多因素Logistic回归分析影响CAS的因素。以P<0.05为差异有统计学意义。
2 结果
2.1 各组临床资料比较 3组性别、BMI比较,差异均无统计学意义(P>0.05);3组年龄、MABP、糖尿病、吸烟史、吸烟时间、Hb、Scr、ALB、TG、TC、HDL-C、LDL-C、P、Ca、PTH、eGFR、pADMA 水 平比较,差异均有统计学意义(P<0.05)。其中CKD组MABP、Scr、TG、TC、LDL-C、pADMA水平高于对照组,吸烟史、Hb、ALB、HDL-C、eGFR低于对照组,差异均有统计学意义(P<0.05);ESRD组TG水平高于对照组,HDL-C水平低于CKD组,P、Ca、PTH水平高于CKD组,年龄、MABP、糖尿病检出率、吸烟史、Scr、pADMA水平高于对照组和CKD组,Hb、ALB、TC、LDL-C、eGFR低于对照组和CKD组,差异均有统计学意义(P<0.05,见表1)。
2.2 pADMA与临床指标的单因素及多因素分析
Spearman相关分析结果显示,pADMA与年龄、MABP、糖尿病、吸烟时间、TG呈正相关(rs=0.300、0.203、0.162、0.133、0.134,P<0.05), 与 Hb、ALB、HDL-C、eGFR呈负相关(rs=-0.410、-0.409、-0.163、-0.575,P<0.05),与性别、BMI、吸烟史、TC、LDL-C无直线相关性(rs=-0.045、0.050、0.074、-0.026、-0.027,P>0.05)。以pADMA为因变量,以性别(赋值:女=0,男=1)、年龄、MABP、糖尿病(赋值:无=0,有=1)、吸烟时间、Hb、ALB、TG、HDL-C、eGFR为自变量进行多元线性回归分析,结果显示,eGFR是影响pADMA水平的独立危险因素(P<0.05,见表2)。
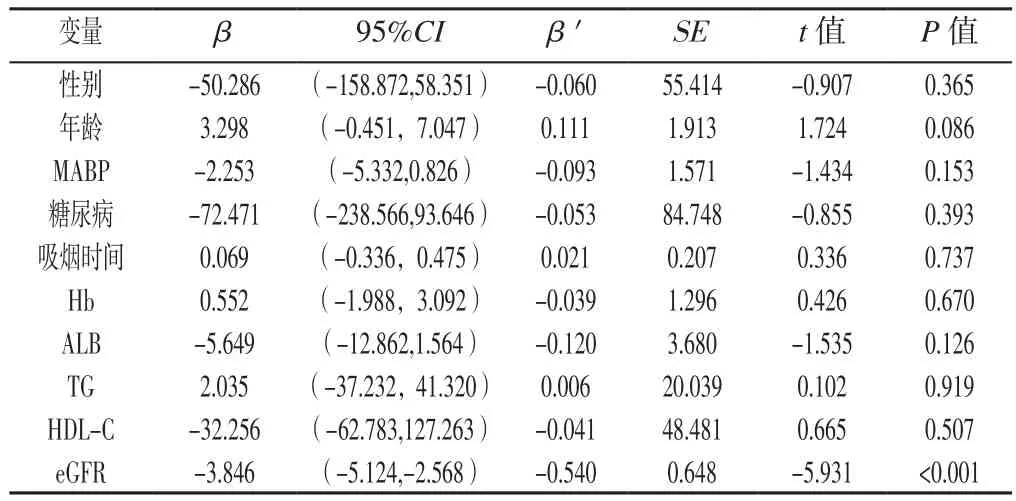
表2 pADMA影响因素的多元线性回归分析Table 2 Multiple linear regression analysis of the influencing factors of pADMA in the participants
2.3 ESRD组无或轻度CAS和重度CAS患者临床资料比较 无或轻度CAS和重度CAS患者性别、BMI、吸烟史、吸烟时间、Hb、Scr、ALB、TC、HDL-C、LDL-C、P、Ca、PTH、eGFR比较,差异均无统计学意义(P>0.05)。无或轻度CAS和重度CAS患者年龄、MABP、糖尿病、透析时间、透析方式、TG、pADMA、cIMT、斑块发生率比较,差异均有统计学意义(P<0.05,见表3)。
2.4 ESRD患者CAS影响因素分析 以CAS为因变量(赋值:否=0,是=1),以性别[12](赋值:女=0,男=1)、年龄、BMI、MABP、糖尿病(赋值:无=0,有=1)、吸烟史(赋值:无=0,有=1)、透析时间、透析方式(赋值:CAPD=0,MHD=1)、TG、pADMA为自变量进行多因素Logistic回归分析,结果显示,年龄、透析方式和TG是ESRD患者CAS的独立危险因素(P<0.05,见表4)。
2.5 ESRD患者LVMI与临床指标的单因素及多因素分析 Spearman相关分析结果显示,ESRD患者LVMI与MABP、吸烟时间、Scr呈正相关(rs=0.264、0.215、0.382,P<0.05),与Hb、ALB呈负相关(rs=-0.219、-0.219,P<0.05),与性别、年龄、BMI、糖尿病、吸烟史、透析方式、透析时间、TG、TC、HDL-C、LDL-C、P、Ca、PTH、pADMA无直线相关性(rs=0.175、0.089、0.028、-0.102、0.110、0.123、-0.070、-0.051、-0.055、-0.055、-0.026、-0.960、-0.053、0.122、-0.089,P>0.05)。以LVMI为因变量,以单因素分析中有统计学意义的因素MABP、吸烟时间、Hb、Scr、ALB及临床可能有影响的危险因素如性别(赋值:女=0,男=1)、年龄、BMI、糖尿病(赋值:无=0,有=1)、透析方式(赋值:CAPD=0,MHD=1)、PTH、pADMA等为自变量进行多元线性回归分析,结果显示,Scr是ESRD患者LVMI的独立危险因素(P<0.05,见表5)。
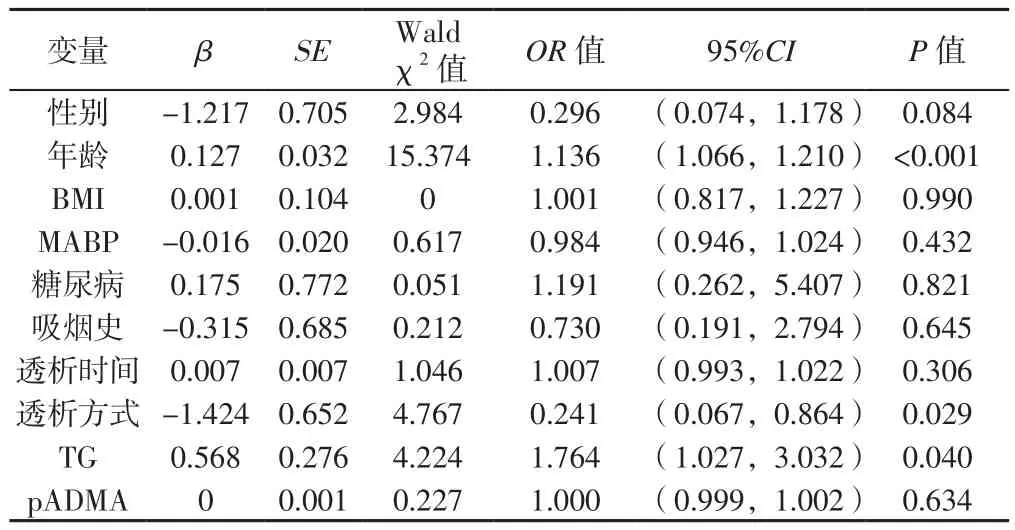
表4 ESRD患者CAS影响因素的多因素Logistic回归分析Table 4 Multivariate Logistic regression analysis of the influencing factors of CAS in ESRD patients

表1 各组临床资料比较Table 1 Comparison of clinical data among the control group,CKD group and ESRD group
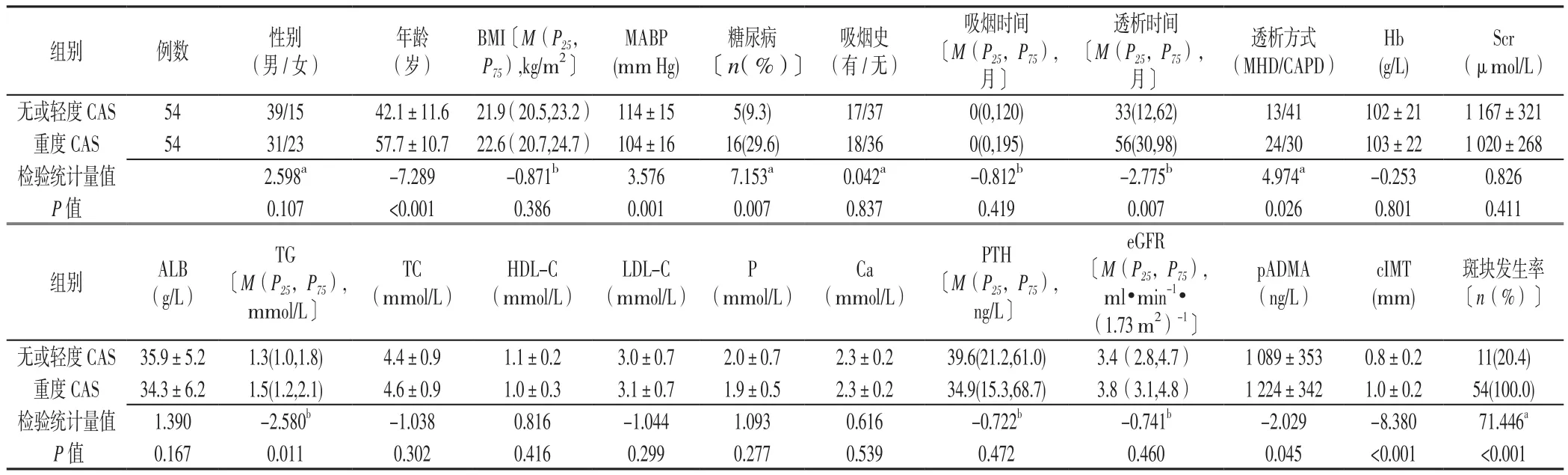
表3 不同CAS程度的ESRD患者临床资料比较Table 3 Comparison of clinical data of ESRD patients with no or mild CAS compared with those with severe CAS
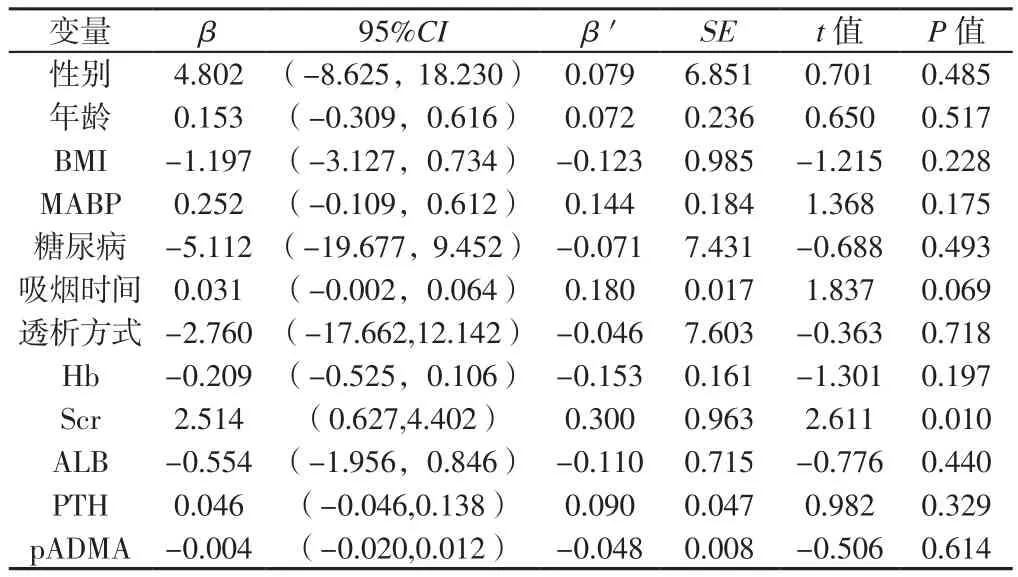
表5 ESRD患者LVMI影响因素的多元线性回归分析Table 5 Multiple linear regression analysis of the influencing factors of LVMI in ESRD patients
3 讨论
3.1 eGFR降低是pADMA水平升高的独立危险因素自1992年VALLANCE等[13]在血浆和尿液中检测出ADMA,与ADMA相关的研究不断涌现。有研究表明,并非所有CKD患者pADMA均与eGFR相关[14-15]。但近10年来,越来越多的研究表明,eGFR与pADMA密切相关。FLISER等[16]检测227例轻中度肾衰竭患者pADMA水平,发现eGFR降低伴随pADMA水平升高。ZHAO等[17]研究也显示,随肾功能减退,ADMA可潴留于体内。本研究Spearman相关分析结果显示,eGFR与pADMA呈负相关;多元线性回归分析结果显示,eGFR是影响pADMA的独立危险因素。eGFR是衡量肾功能的重要指标,其下降提示肾功能降低,而肾功能不全导致ADMA经肾脏排泄和代谢途径受阻[15],pADMA水平升高。
3.2 pADMA与CAS程度相关 有研究报道,肾功能下降与心血管意外及动脉粥样硬化程度密切相关[18],提示肾功能减退导致体内某些毒性物质如ADMA累积,可能参与其病理生理过程。有研究表明,pADMA水平升高与颈动脉IMT增厚、CAS密切相关[6,19]。本研究对ESRD组患者按照CAS程度进行分组比较后发现,重度CAS患者pADMA水平高于无或轻度CAS患者;多因素Logistic回归分析结果显示,年龄、透析方式和TG是CAS的独立危险因素。年龄和TG作为CVD的传统危险因子,可加速动脉粥样硬化发生与发展[20]。早有报道称MHD是CAS的独立危险因素[21],可能与MHD诱发加重氧化应激、干扰抗氧化酶作用[22]及行MHD患者微炎症状态、高血压等[23]有关。然而,本研究发现pADMA并非CAS的独立危险因素,推测ADMA可能通过复杂机制参与CAS发展过程,但并非发挥决定性作用。与JACOBI等[7]动物实验结果一致,ADMA在CAS过程中并未发挥特别重要作用。但近期MATHEW等[24]小鼠模型实验提示,pADMA协同炎症和氧化产物在加速动脉粥样硬化过程中发挥核心作用,阻断精氨酸甲基化可能在防治CKD相关性CAS过程中发挥重要作用。为探究pADMA水平升高对动脉粥样硬化发生和发展的作用,除动物实验外,应该需要更多的临床研究以验证和探讨。
3.3 pADMA与LVMI无相关性 ESRD患者中,LVH发生率较高。1995年FOLEY等[25]首次报道433例透析患者LVH发生率近75%。随后逐渐发现LVH是ESRD透析患者的重要并发症,相关研究逐步增多。新近的回顾性研究和纵向队列研究结果发现,在透析初期,LVH发生率高达85%和79%[5,26]。多种原因可导致LVH发生,一氧化氮(NO)系统调控紊乱,NO生物利用度减少,可诱导心肌肥厚[27]。ADMA除NO途径外,还可激活心肌成纤维细胞生成因子受体,或过度激活肾素-血管紧张素-醛固酮系统,从而导致心肌肥厚及心肌纤维化[28-29]。ADMA作为一氧化氮合酶(NOS)抑制剂,一种新型尿毒症毒素,其升高导致NO保护作用减弱,通过复杂机制,参与左心室结构和功能改变,最终发生致死性或非致死性心血管事件[17]。这些研究均表明,pADMA水平与LVH衡量指标LVMI[30]密切相关。
然而,本研究单因素和多因素分析结果均显示,pADMA与LVMI无相关性,与EL SHAHAWY等[15]研究结论相一致。值得注意的是,其在研究中也发现pADMA与HD患者左心室舒张功能下降密切相关,与AYERDEN EBINC等[31]以PD患者为研究对象的研究结论相一致,换言之,pADMA与透析患者左心室舒张功能呈负相关。而LIEB等[8]的一项1 919例社区大样本队列研究发现,在多变量模型中,pADMA与LVM、左心房大小及射血分数等心脏结构和功能指标均无相关性。这些相互不一致的结果提示,ADMA是一种非特异性NOS,心血管系统阻力和顺应性除受NO调节外,还受其他多种病理生理机制调控。因此,本研究结果不支持ESRD患者pADMA与LVMI密切相关,通过降低pADMA来防治ESRD维持性透析患者LVH的临床价值尚待进一步探讨。
3.4 Scr是ESRD患者LVH的独立危险因素 近20年来,越来越多报道发现在CKD透析前患者中,Scr影响LVMI、LVH发生率随着肾功能下降而增加[32-33]。1998年HA等[34]在CKD透析前患者中发现Scr与LVMI呈正相关,2009年YASUNO等[35]也报道高危高血压患者Scr与LVMI存在相关性,然而在CKD透析人群中却鲜有报道。本研究Spearman相关分析结果显示,Scr与LVMI呈正相关;多元线性回归分析结果显示,Scr是ESRD患者LVMI的独立危险因素,表明高水平Scr的ESRD人群心室重构和LVH高发生率密切相关。Scr是临床上评价透析充分性的重要指标,依据Scr调整提高透析充分性以降低ESRD患者LVH发生率,具有一定的临床价值。
综上所述,本研究主要结论如下:(1)CKD患者,尤其是达到ESRD时,其pADMA水平明显升高;eGFR降低是pADMA水平升高的独立危险因素;(2)pADMA和ESRD患者CAS密切相关,但并非CAS的独立危险因素;(3)对于ESRD患者无足够证据支持pADMA与LVMI有相关性,Scr是LVH的独立危险因素。通过控制pADMA以防治透析相关性CVD临床意义尚不确定;依据Scr调整提高透析充分性有助于降低透析相关性LVH,其临床应用价值可能成为未来研究方向。
作者贡献:梁榆英进行文章的构思与设计、数据收集、数据整理、统计学处理、结果的分析与解释、撰写论文、论文的修订;梁榆英、熊祖应、廖玉梅、熊子波进行研究的实施与可行性分析;熊祖应、熊子波负责文章的质量控制及审校;熊祖应、廖玉梅、熊子波对文章整体负责,监督管理。
本文无利益冲突。
[1]TONELLI M,WIEBE N,CULLETON B,et al.Chronic kidney disease and mortality risk:a systematic review[J].J Am Soc Nephrol,2006,17(7):2034-2047.DOI:10.1681/ASN.2005101085.
[2]ARORA N,DELLSPERGER K C.Heart failure and dialysis:new thoughts and trends[J].Adv Perit Dial,2007,23:72-76.
[3]COLLINS A J.US renal data system 2011 annual data report[J].Am J Kidney Dis,2015,45(1 Suppl 1):S1.
[4]COLLINS A J,FOLEY R N,CHAVERS B,et al.United States Renal Data System 2011 Annual Data Report:atlas of chronic kidney disease & end-stage renal disease in the United States[J].Am J Kidney Dis,2012,59(1 Suppl 1):A7,e1-420.DOI:10.1053/j.ajkd.2011.11.015.
[5]BANSAL N,KEANE M,DELAFONTAINE P,et al.A longitudinal study of left ventricular function and structure from CKD to ESRD:the CRIC study[J].Clin J Soc Nephrol,2013,8(3):355-362.DOI:10.2215/CJN.06020612.
[6]BAI Y,SUN L,DU L,et al.Association of circulating levels of asymmetric dimethylarginine (ADMA) with carotid intima-media thickness:evidence from 6168 participants[J].Ageing Res Rev,2013,12(2):699-707.DOI: 10.1016/j.arr.2012.02.003.
[7]JACOBI J,MAAS R,AREND M,et al.Effect of lowering asymmetric dimethylarginine (ADMA) on vascular pathology in atherosclerotic ApoE-deficient mice with reduced renal mass[J].Int J Mol Sci,2014,15(4):5522-5535.DOI: 10.3390/ijms15045522.
[8]LIEB W,BENNDORF R A,BENJAMIN E J,et al.Plasma asymmetric dimethylarginine,L-arginine and left ventricular structure and function in a community-based sample[J].Atherosclerosis,2009,204(1):282-287.DOI: 10.1016/j.atherosclerosis.2008.08.018.
[9]BENETOS A,RUDNICHI A,SAFAR M,et al.Pulse pressure and cardiovascular mortality in normotensive and hypertensive subjects[J].Hypertension,1998,32(3):560-564.
[10]GROBBEE D E,BOTS M L.Carotid artery intima-media thickness as an indicator of generalized atherosclerosis[J].J Intern Med,1994,236(5):567-573.
[11]SPENCE J D.Measurement of intima-media thickness vs.carotid plaque:uses in patient care,genetic research and evaluation of new therapies[J].Int J Stroke,2006,1(4):216-221.DOI:10.1111/j.1747-4949.2006.00068.x.
[12]FRENAY A R,VAN DEN BERG E,DE BORST M H,et al.Plasma ADMA associates with all-cause mortality in renal transplant recipients[J].Amino Acids,2015,47(9):1941-1949.DOI:10.1007/s00726-015-2023-0.
[13]VALLANCE P,LEONE A,CALVER A,et al.Accumulation of an endogenous inhibitor of nitric oxide synthesis in chronic renal failure[J].Lancet,1992,339(8793):572-575.
[14]FLECK C,SCHWEITZER F,KARGE E,et al.Serum concentrations of asymmetric(ADMA) and symmetric(SDMA)dimethylarginine in patients with chronic kidney diseases[J].Clin Chim Acta,2003,336(1/2):1-12.
[15]EL SHAHAWY Y,SOLIMAN Y,RIFAIE A,et al.Relationship between asymmetric dimethylarginine plasma level and left ventricular mass in hemodialysis patients[J].Saudi J Kidney Dis Transpl,2015,26(1):26-33.
[16]FLISER D,KRONENBERG F,KIELSTEIN J T,et al.Asymmetric dimethylarginine and progression of chronic kidney disease: the mild to moderate kidney disease study[J].J Am Soc Nephrol,2005,16(8):2456-2461.DOI:10.1681/ASN.2005020179.
[17]ZHAO J R,ZHANG D Y,SUN D Z.Correlation research on ADMA plasma levels and left ventricular function of peritoneal dialysis patients[J].Int J Clin Exp Med,2014,7(11):4455-4460.
[18]KOTTGEN A,RUSSELL S D,LOEHR L R,et al.Reduced kidney function as a risk factor for incident heart failure: the atherosclerosis risk in communities(ARIC) study[J].J Am Soc Nephrol,2007,18(4):1307-1315.DOI:10.1681/ASN.2006101159.
[19]ADESEUN G A,BONNEY C C,ROSAS S E.Health literacy associated with blood pressure but not other cardiovascular disease risk factors among dialysis patients[J].Am J Hypertens,2012,25(3):348-353.DOI: 10.1038/ajh.2011.252.
[20]SILAGHI C A,SILAGHI H,CRACIUN A E,et al.Age,abdominal obesity,and glycated hemoglobin are associated with carotid atherosclerosis in type 2 diabetes patients with nonalcoholic fatty liver disease[J].Med Ultrason,2015,17(3):300-307.DOI:10.11152/mu.2013.2066.173.cas.
[21]PAUL J,DASGUPTA S,GHOSH M K.Carotid artery intima media thickness as a surrogate marker of atherosclerosis in patient with chronic renal failure on hemodialysis[J].N Am J Med Sci,2012,4(2):77-80.DOI:10.4103/1947-2714.93379.
[22]DURSUN B,DURSUN E,SULEYMANLAR G,et al.The effect of hemodialysis on accelerated atherosclerosis in diabetic patients:correlation of carotid artery intima-media thickness with oxidative stress[J].J Diabetes Complications,2009,23(4):257-264.DOI:10.1016/j.jdiacomp.2007.12.007.
[23]REN H,ZHOU X,LUAN Z,et al.The relationship between carotid atherosclerosis,inflammatory cytokines,and oxidative stress in middle-aged and elderly hemodialysis patients[J].Int J Nephrol,2013,2013:835465.DOI: 10.1155/2013/835465.
[24]MATHEW A V,ZENG L,BYUN J,et al.Metabolomic profiling of arginine metabolome links altered methylation to chronic kidney disease accelerated atherosclerosis[J].J Proteomics Bioinform,2015(Suppl 14).pii:001.DOI:10.4172/jpb.S14-001.
[25]FOLEY R N,PARFREY P S,HARNETT J D,et al.Clinical and echocardiographic disease in patients starting end-stage renal disease therapy[J].Kidney Int,1995,47(1):186-192.
[26]HAYASHI T,KIMURA T,YASUDA K,et al.Prognostic significance of left ventricular hypertrophy observed at dialysis initiation depends on the pre-dialysis use of erythropoiesisstimulating agents[J].Clin Exp Nephrol,2013,17(2):294-303.DOI:10.1007/s10157-012-0705-4.
[27]VISSER M,PAULUS W J,VERMEULEN M A,et al.The role of asymmetric dimethylarginine and arginine in the failing heart and its vasculature[J].Eur J Heart Fail,2010,12(12):1274-1281.DOI:10.1093/eurjhf/hfq158.
[28]LUO Z,TEERLINK T,GRIENDLING K,et al.Angiotensin Ⅱand NADPH oxidase increase ADMA in vascular smooth muscle cells[J].Hypertension,2010,56(3):498-504.DOI:10.1161/HYPERTENSIONAHA.110.152959.
[29]VERESH Z,DEBRECZENI B,HAMAR J,et al.Asymmetric dimethylarginine reduces nitric oxide donor-mediated dilation of arterioles by activating the vascular renin-angiotensin system and reactive oxygen species[J].J Vasc Res,2012,49(4):363-372.DOI:10.1159/000337485.
[30]LANG R M,BIERIG M,DEVEREUX R B,et al.Recommendations for chamber quantification: a report from the American Society of Echocardiography's Guidelines and Standards Committee and the Chamber Quantification Writing Group,developed in conjunction with the European Association of Echocardiography,a branch of the European Society of Cardiology[J].J Am Soc Echocardiogr,2005,18(12):1440-1463.DOI:10.1016/j.echo.2005.10.005.
[31]AYERDEN EBINC F,HAKSUN E,ULVER D B,et al.The relationship between vascular endothelial growth factor (VEGF)and microalbuminuria in patients with essential hypertension[J].Intern Med,2008,47(17):1511-1516.
[32]LEVIN A,SINGER J,THOMPSON C R,et al.Prevalent left ventricular hypertrophy in the predialysis population: identifying opportunities for intervention[J].Am J Kidney Dis,1996,27(3):347-354.
[33]YILMAZ B A,METE T,DINCER I,et al.Predictors of left ventricular hypertrophy in patients with chronic kidney disease[J].Ren Fail,2007,29(3):303-307.DOI:10.1080/08860220601166529.
[34]HA S K,PARK H S,KIM S J,et al.Prevalence and patterns of left ventricular hypertrophy in patients with predialysis chronic renal failure[J].J Korean Med Sci,1998,13(5):488-494.DOI:10.3346/jkms.1998.13.5.488.
[35]YASUNO S,UESHIMA K,OBA K,et al.Clinical significance of left ventricular hypertrophy and changes in left ventricular mass in high-risk hypertensive patients: a subanalysis of the Candesartan Antihypertensive Survival Evaluation in Japan trial[J].J Hypertens,2009,27(8):1705-1712.DOI:10.1097/HJH.0b013e32832c6968.
