不同中药物料对丸剂溶出的影响及其体内外评价
2018-02-01陈天朝胡玉青刘瑞霞于兰兰马彦江常倩倩李瑞颖
陈天朝+胡玉青+刘瑞霞+于兰兰+马彦江+常倩倩+李瑞颖

摘要:目的 研究5类不同中药物料对丸剂溶出的影响,评价其体内外相关性,并对中药物料的辅料功能进行探索。方法 采用均匀设计法,自拟8个处方,用淀粉类、纤维类、蛋白类、油脂类、多糖类中药物料制备不同模型丸剂,HPLC测定丸剂中盐酸小檗碱体外累积释放度、家兔体内血药浓度,考察中药物料对丸剂体内外释药行为的影响,并进行丸剂体内外相关性评价。结果 淀粉、纤维类物料对丸剂溶出有促进作用,蛋白、油脂类物料对丸剂溶出有阻滞作用,多糖类物料对丸剂溶出无显著作用;丸剂体内外相关性显著。结论 中药物料具有“药辅统一”的性质,可通过调节处方中物料细粉比例控制丸剂溶出度及生物有效性;丸剂的体内外相关性良好。
关键词:中药物料;盐酸小檗碱;丸剂;溶出;体内外相关性
DOI:10.3969/j.issn.1005-5304.2018.02.019
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2018)02-0083-06
Effects of Different Chinese Medicine Materials on Dissolution of Pills
and Their in Vitro - in vivo Evaluation
CHEN Tian-chao1,2, HU Yu-qing1, LIU Rui-xia3, YU Lan-lan4, MA Yan-jiang2, CHANG Qian-qian1, LI Rui-ying1
1. Henan University of Traditional Chinese Medicine, Zhengzhou 450008, China; 2. The First Affiliated Hospital of Henan University of Traditional Chinese Medicine, Zhengzhou 450000, China; 3. Zhongmou County Hospital, Zhengzhou 451450, China; 4. Henan Province Third People's Hospital, Zhengzhou 450000, China
Abstract: Objective To study the effects of five different kinds of Chinese medicine materials on dissolution of pills; To evaluate their in vitro - in vivo correlation. Methods Five different types of traditional Chinese medicine materials, such as starch, fiber, protein, grease and polysaccharide materials, were selected by uniform design to the proposed 8 model formulation and preparation of pills, and the cumulative release rate and in vivo plasma concentration of berberine hydrochloride were determined by HPLC. The effects of Chinese medicine materials on the drug release behavior of pills in vitro - in vivo were investigated. And the in vitro - in vivo correlation of the pills was evaluated. Results Starch and fiber materials could promote the release of the pills, and protein and grease materials has a blocking effect on the pills dissolution. Polysaccharide materials have no significant effect on the dissolution of the pills. Pills in vitro - in vivo correlation was significant. Conclusion Chinese medicine materials have the characteristics of medicine-assisted unity, which can control the dissolution and bioavailability of pills by adjusting the proportion of powder in the prescription. And the pills have good correlation in vitro - in vivo.
Keywords: Chinese medicine materials; berberine hydrochloride; pill; dissolution; correlation in vivo - in vitro
中藥丸剂是指药材细粉或药材提取物加适宜粘合剂或其他辅料制成的球形或类球形制剂。研究表明,辅料是药物制剂的基础材料及重要的组成部分,在制剂剂型和生产中起着关键作用,它不仅赋予药物一定剂型,并且与提高药物疗效、降低毒副作用有很大的关系[1]。但长期以来,药用辅料导致的不良反应、药用辅料质量标准水平参差不齐等影响了药品质量、溶出度、生物利用度和工艺稳定性[2]。有研究显示,丸剂中所含中药物料(药物细粉)既是药物成分,又具有制剂辅料功能,即中药物料具有“药辅统一”性质[3]。发掘中药的“药辅统一”功能,可减少药用辅料的用量和不良反应,提高丸剂的载药量、稳定性和质量可控性[4],为丸剂处方及制备工艺的优化提供依据。本研究通过调整中药物料比例(药物细粉与提取物比例)制备不同模型丸剂,测定其体内外释放度,探讨中药物料是否具有辅料功能,能否改变中药丸剂溶出过程,实现速释或缓释,达到控制药效的目的。endprint
生物利用度能在一定程度上反映药物的有效性。药物的生物利用度试验操作过程复杂,在实际工作中,当一种制剂体内外特征具有相关性时,可通过体外释放曲线预测其体内情况[5],从而减少药物体内研究数量,一定程度上简化了处方筛选,对药物制剂的研究开发和质量控制具有重要意义[6]。本试验考察模型丸剂体内外溶出过程,评价其体内外相关性,为模型丸剂的处方筛选、质量控制提供依据。
1 仪器、试药与动物
1260高效液相色谱仪(安捷伦公司),AEC-200电子天平(日本岛津公司),GZX-9070MBE数显鼓风干燥箱(上海博讯仪器设备有限公司),20B万能粉碎机(江阴市盛田机械制造有限公司),ZB-1自动崩解时限检查仪(上海新诺仪器设备有限公司),303AB-1型隔水式恒温培养箱(上海申光仪器仪表有限公司),IKA-天才3涡旋混匀器(德国IKA公司)。
升麻、山药、茯苓、僵蚕、火麻仁均购自安徽人民中药饮片公司,经河南中医药大学第一附属医院药学部陈天朝主任药师鉴定,均符合2015年版《中华人民共和国药典》(一部)饮片项下各项规定。盐酸小檗碱(中国食品药品检定研究院,批号110713-201212,纯度≥98%),磷酸(北京迪马公司,色谱纯),乙腈、甲醇(Sigma试剂有限公司,色谱纯),氯化钠(天津永大化学试剂有限公司),一次性使用负压采血容器,一次性使用静脉血样采血针等。
普通级70 d龄家兔10只,雌雄各半,体质量2.5~3.0 kg,河南康大实验动物有限公司,动物合格证号SYXK(豫)2015-0005。家兔饲养于室温(20±1)℃、湿度60%~70%环境,自由饮水进食,适应性喂养3 d后进行实验。
2 方法与结果
2.1 不同模型丸剂的制备
2.1.1 模型丸剂的处方组成
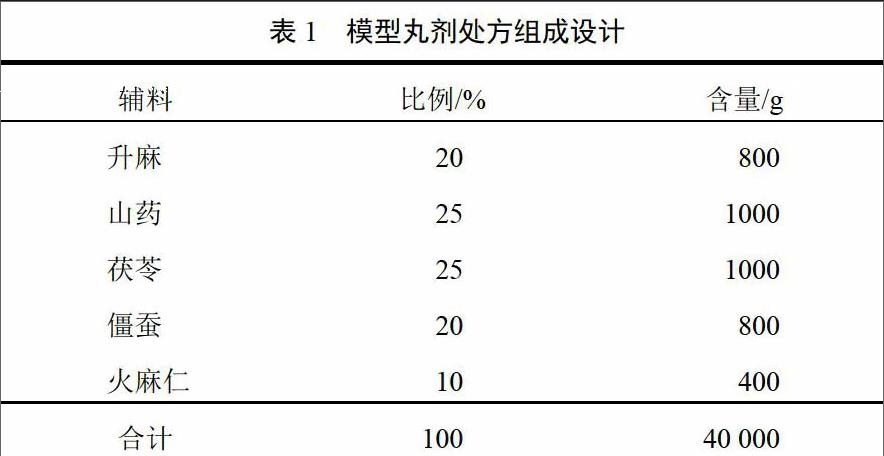
中药物料因其所富集的成分不同,可大体分为纤维类、淀粉类、蛋白类、多糖类、油脂类、树脂类、矿物类7种基本类型。根据前期试验所测饮片成分含量以及药典所载丸剂处方中饮片使用频率,选择具有代表性的中药物料:升麻(纤维类),山药(淀粉类),茯苓(多糖类),僵蚕(蛋白类),火麻仁(油脂类)。
黄连是中国传统中药之一,药理应用广泛,以黄连中含量最高的盐酸小檗碱作为丸剂溶出的指标物质。根据中医药传统经验及前期试验测得饮片成分含量,黄连药材具纤维性,为减少干扰因素,将黄连提取后再加入各处方中制丸。
根据药材自身性质及预试验结果,使该处方能泛制成水丸并确保每种药物在处方中所占比例尽量最大,结合预试验结果,处方量拟定4000 g,各药的处方比例见表1。
2.1.2 均匀设计法设计模型丸剂处方
采用U8*(85)设计表,以升麻(纤维类)、山药(淀粉类)、茯苓(多糖类)、僵蚕(蛋白类)、火麻仁(油脂类)5种物料为5个因素,模型丸剂设计总处方中各辅料粉碎成细粉(剩余为提取物加入),比例为8个水平均匀设计,得到8组处方。各处方中5 种物料的具体比例见表2。
2.1.3 不同物料比例模型丸剂的制备
各物料饮片干燥、粉碎,过80目筛,备用;黄连及各物料饮片制备提取物,备用。每组处方按表2比例,将各物料及其提取物相对含量相等的黄连提取物混匀,以泛制法[7-8]泛丸、干燥,制备8批规格为0.3 g的模型丸剂。另选择处方3物料比例,不加黄连提取物,同法制成阴性丸剂。
2.2 体外释放度试验
2.2.1 色谱条件
采用AgiLent SB-Aq色谱柱(4.6 mm×250 mm,5 ?m),流动相为乙腈-0.05 moL/L磷酸二氢钾溶液(50∶50,每100 mL中加十二烷基硫酸钠0.4 g,再以磷酸调节pH值为4.0),流速1.0 mL/min,檢测波长345 nm。
2.2.2 测定方法
按2015年版《中华人民共和国药典》溶出度测定法XC第二法(桨法)[9],溶出介质为脱气纯水900 mL,转速100 r/min,温度(37±0.5)℃。模型丸剂投入后的不同时间点每次取样10 mL,立即补充相同体积、温度的溶出介质。
2.2.3 方法特异性
按上述色谱条件,对盐酸小檗碱对照品溶液、模型丸剂及阴性丸剂4 h时溶出液进行测定,色谱图见图1。盐酸小檗碱保留时间约为10.5 min,无杂质峰干扰,且峰形良好。
2.2.4 标准曲线绘制
配制40.0 ?g/mL盐酸小檗碱对照品溶液,分别进样0.5、2、4、8、10、14 ?L测定,以药物浓度对峰面积进行线性回归,得回归方程Y=3800.9X+1.329 6(r?=0.999 9),线性范围为0.020~0.560 ?g/mL。
2.2.5 精密度试验
取任一处方模型丸剂4 h溶出液,于当日内连续5次进样测定,结果RSD=0.62%,表明本法精密度良好。
2.2.6 稳定性试验
取任一处方模型丸剂6 g,精密称定,按“2.2.2”项下方法取4 h溶出液,于处理后0、2、4、6、12、24 h进样测定,结果RSD=1.02%,表明供试品溶液在24 h内稳定。
2.2.7 重复性试验
取任一处方模型丸剂6 g,平行6份,精密称定,按“2.2.2”项下方法取4 h溶出液分别进样测定,结果RSD=1.18%,表明本法重复性良好。
2.2.8 加样回收率试验
取任一处方模型丸剂6 g,平行取6份,按“2.2.2”项下方法得6份溶出液,分别加入一定量对照品溶液,进样测定,结果平均回收率为98.1250%,RSD=1.54%,见表3。
2.2.9 丸剂释放度测定endprint
各处方模型丸剂按“2.2.2”项下方法分别在2、5、10、20、30、60、120、240、480 min取样液,进样测定,计算累积释药量,各丸剂体外释放曲线见图2。8组处方模型丸剂释放度均不同,说明不同中药物料对丸剂释放的影响不同;中药物料具有辅料功能,影响制剂释放速度。
2.3 不同中药物料与丸剂体外释放度关系模型
2.3.1 溶出参数的计算
根据Weibull分布模型F=1-exp(-(t-α)^m/β),拟合并估算出处方1~8模型丸剂中盐酸小檗碱的溶出参数T40分别为8.49、11.48、18.09、17.35、10.33、8.82、3.26、4.37 min。
2.3.2 线性模型拟合
为了解中药物料与丸剂释放度的定量关系,引入多元线性数学模型Y=α+β1X1+β2X2+β3X3+β4X4+β5X5。根据模型丸剂中盐酸小檗碱体外累积释放参数,通过SPSS20.0软件建立回归模型[10-12]。回归方程为YT40=5.696-0.014X12-0.159X2+0.029X1X4+0.623X5,其中,Y为8个处方的综合评价指标在不同时间点的溶出百分率,T40为样品累积溶出40%时的溶出时间,X1、X2、X4、X5分别为淀粉类、纤维类、油脂类、蛋白类的处方含量比例。
由该模型可以得出:X1、X2与Y呈负相关,说明淀粉类、纤维类物料对模型丸剂中盐酸小檗碱的溶出有促进作用;X4、X5与Y呈正相关,说明蛋白类、油脂类物料对模型丸剂中盐酸小檗碱的溶出有阻滞作用;多糖类物料对模型丸剂中盐酸小檗碱的溶出无显著影响。
2.4 家兔体内药动学研究
2.4.1 色谱条件
同“2.2.1”项下色谱条件。
2.4.2 试验方案
将家兔随机分为3个处方组,每组3只。给药前禁食24 h,自由饮水。在家兔胃与食管连接处开口实施插管手术[13-15],按40 mg/kg(以盐酸小檗碱计)剂量分别给予家兔处方3、处方6、处方7丸剂。分别于给药前(0 h)及给药后10、15、20、30、45、60、90、120、180、240、360、480 min经家兔耳缘静脉采血约1.5 mL于肝素化一次性使用负压采血容器中,4000 r/min离心25 min,吸取上层血浆,置于-20 ℃冰箱保存备用[16-17]。
2.4.3 溶液配制及血浆样品处理
精密称取9.98 mg盐酸小檗碱对照品于100 mL量瓶中,加甲醇定容至刻度,制成99.8 ?g/mL的盐酸小檗碱对照品溶液,备用。取家兔血浆500 ?L,加1.5 mL甲醇,超声处理(功率200 W,频率53 kHz)15 min,涡旋混合1 min,12 000 r/min离心15 min,取上清液于另一干净的离心管中,45 ℃水浴氮气流挥干,加100 ?L流动相溶解残渣,涡旋混合2 min,超聲处理(功率200 W,频率53 kHz)5 min,12 000 r/min离心15 min,吸取上清液[18],得血浆样品,进样80 ?L分析。
2.4.4 方法特异性
取家兔空白血浆、空白血浆加盐酸小檗碱对照品、家兔口服后血浆样品进样,色谱图见图3。血浆中盐酸小檗碱保留时间约为10.3 min,无杂峰干扰,且峰形良好。
2.4.5 标准曲线绘制
分别精密量取家兔空白血浆500 ?L,加入不同浓度的盐酸小檗碱对照品溶液100 ?L,配制成相当于盐酸小檗碱血浆浓度分别为0.003 1、0.006 2、0.012 5、0.025 0、0.049 9、0.099 8、0.199 6 ?g/mL的血浆样品,按“2.4.3”项下血浆样品处理方法操作,记录峰面积。以药物质量浓度对药物峰面积进行线性回归,得线性方程Y=2672.2X+4.887 6(r2=0.999 8),线性范围为0.003 1~0.199 6 ?g/mL。
2.4.6 精密度试验
分别用家兔空白血浆配制成低、中、高浓度(0.006 2、0.025 0、0.149 7 μg/mL)的含盐酸小檗碱对照品溶液。1 d内测定5次,计算日内精密度;每日测定1次,连续5 d,计算日间精密度。结果低、中、高浓度溶液的日内精密度RSD分别为4.07%、2.60%、2.33%,日间精密度RSD分别为4.87%、4.40%、3.37%,表明精密度良好,可满足生物样品分析方法要求。
2.4.7 稳定性试验
配制“2.4.6”项下高、中、低3种浓度对照品溶液,室温放置0、2、6、12、24 h,进样测定,结果RSD分别为2.84%、4.87%、4.53%,表明此样品在室温条件下24 h内稳定。同法配制上述3种浓度对照品溶液,置于-20 ℃冰箱中24 h,取出,40 ℃加速条件下至完全融化后再次放入-20 ℃冰箱中,循环3次,进样测定,结果平均RSD分别为2.84%、4.43%、4.75%,表明血浆样品冻融3次后稳定性良好。
2.4.8 加样回收率试验
配制“2.4.6”项下高、中、低3种浓度对照品溶液,进样测定,记录峰面积A测。另用纯品溶剂溶解并稀释,使其浓度与前者处理后浓度一致,进样测定并记录峰面积A实。提取回收率(%)=A测÷A实×100%。结果平均回收率分别为85.75%、85.80%、89.28%,RSD均小于5%,符合生物样品分析方法的提取回收率标准,见表4~表6。
2.4.9 血药浓度测定
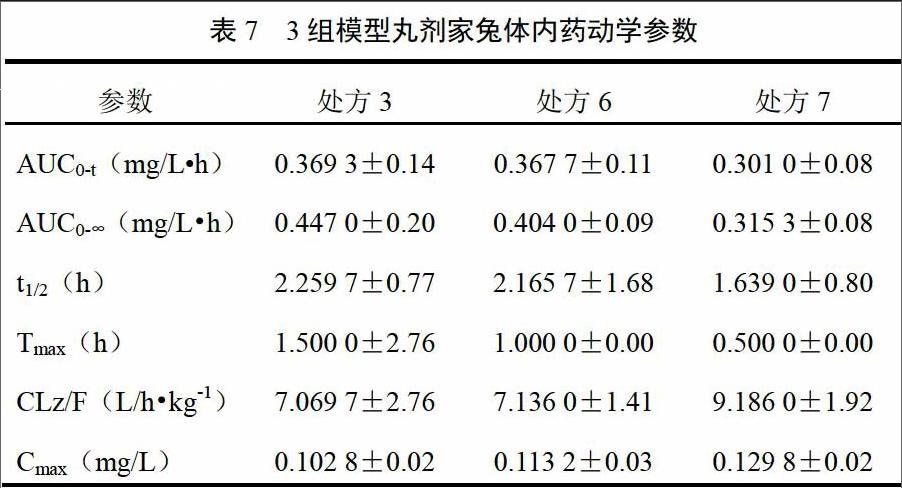
取“2.4.2”项下血浆样品,按“2.4.3”项下方法处理,进样测定,得处方3、6、7模型丸剂家兔体内的平均药时曲线,见图4。对血药浓度-时间数据采用DAS3.1.4药动学软件进行房室模型拟合并计算主要药动学参数[19]。经拟合,模型丸剂的家兔体内药动学为非房室模型,药动学参数见表7。处方3、6、7在家兔体内血药浓度的平均达峰时间分别为90、60、30 min,存在较大差异,且与对应处方体外溶出速度具有一致性。endprint
2.5 体外释放与体内吸收的相关性
采用反卷积分法处理家兔口服丸剂后不同时间点的血药浓度数据,得丸剂不同时间点药物体内吸收分数(Fa)。以体外累积释放百分率(Q)为自变量,Fa为因变量,进行线性回归,求得线性方程和相关系数,判定体外释放与体内吸收的相关性[19-20],结果见表8。根据相关系数临界值表,r0.01,8=0.765,可知r值均大于临界值(P<0.01)[21],表明3组模型丸剂体内外相关性显著。
3 讨论
本试验中模型丸剂在相同时间点下的释放度均不同,说明中药物料具有制剂辅料的功能,直接影响丸剂的崩解、释药,使丸剂速释或缓释,得到的中药物料与丸剂溶出度关系可为丸剂处方及制备工艺的优化提供参考。如希望达到缓释药效,可将制剂处方中具有促进丸剂溶出作用的淀粉类、纤维类中药以一定比例的提取物而非物料粉末的形式制备丸剂,则中药物料促进丸剂溶出作用被减弱,无需外用辅料就能达到缓释药效;另一方面也可提高药物载药量,增强用药顺应性。其在中药固体制剂处方及制备工艺优化上的具体应用还需深入探究。
在丸剂体内药动学试验中,前期试验对象为鼠,只能将丸剂制成混悬液灌胃,不符合制剂原型口服给药的原则,故本研究将试验对象改为家兔,在家兔食管与胃口连接处进行插管手术,模型丸剂整粒给药,完全模拟丸剂在体内吸收、代谢过程。使体内试验数据更加真实可靠,体外释放结果对体内行为的预测更加精准,为控制丸剂生物利用度提供了保证。
本研究表明,调节中药物料性质及比例可改变中药丸剂的溶出,其机制可能是:中药物料中大量存在的亲水性淀粉、膨胀性较好的纤维素,形成无数个不规则的毛细管和孔隙,使水分迅速进入丸粒内部,丸粒疏松破裂而溶散[22];大量不溶性纤维素形成溶蚀型骨架,使丸剂具有缓释作用;蛋白类、黏液质、油脂等,可以增加疏水性、黏性等,阻滞有效成分溶出或妨碍药物向消化管壁扩张。其具体机制有待进一步研究。如将中药物料性质这一因素细化为具体参数(吸水率、吸水膨胀率、比黏度等),探究这些参数对丸剂溶出的影响,将为揭示中药丸剂的释药机制、实现丸剂质量控制、发掘中药辅料功能提供依据。
参考文献:
[1] 汤丽芝,史亚军,年娟娟,等.中药传统丸剂研究进展[J].陕西中医药大学学报,2016,39(3):107-109.
[2] 薛晶,许鸣镝,南楠,等.原辅料及制剂处方工艺对口服固体制剂溶出行为的影响[J].中国新药杂志,2017,26(12):1370-1375.
[3] 裴勇,马彦江.影响中药丸剂体外溶出因素探讨[J].中国卫生产业, 2016,13(32):193-195.
[4] 魏农农,王霞,苏敏.药物溶出度试验方法研究进展[J].中国新药杂志, 2013,22(10):1119-1124.
[5] 黄钦,马玉楠.从技术审评角度看药品的体内外相关性研究[J].中國临床药理学与治疗学,2007,12(9):961-964.
[6] 钟萌,冯悦,孙全,等.阿奇霉素泡囊体外释放与体内吸收的相关性[J].第二军医大学学报,2014,35(9):1034-1037.
[7] 王炯,刘高宏,杨小源,等.浅谈京帮水泛丸的传统制备工具与方法[J].西部中医药,2014,27(5):25-26.
[8] 周顺,郑琪,刘丰贤.中风通络丸的制备工艺研究[J].湖南中医杂志, 2016,32(7):176-178.
[9] 国家药典委员会.中华人民共和国药典:四部[M].北京:中国医药科技出版社,2015:38-40,121-124,374-378.
[10] 史春薇,田强,葛骞,等.基于SPSS统计软件在多元线性回归校验数据中的应用[J].当代化工,2014,43(6):1112-1113.
[11] 常盛,朱亚玲.基于spss的多元线性回归算法建模的实例研究[J].数字技术与应用,2011(10):120.
[12] 施海柳.Excel与SPSS在线性回归预测中的比较分析[J].福建金融管理干部学院学报,2010(6):53-57.
[13] 耿玉梅,王苏网,陈丹萍,等.西罗莫司洗脱支架对气管支架内再狭窄的作用[J].中山大学学报(医学科学版),2016,37(1):54-60.
[14] 王青,尤庆生,张天一,等.细菌纤维素补片修复重建兔颈段气管部分缺损的实验研究[J].中国修复重建外科杂志,2016,30(6):748-753.
[15] 刘为萍.0.7%戊巴比妥钠在家兔实验手术麻醉中追加剂量的探讨[J].中国医疗前沿,2013,8(1):13-14.
[16] 韩文莉,陆巍,何东平,等.盐酸小檗碱磷脂复合物在兔体内的药动学及相对生物利用度研究[J].中国药房,2011,22(17):1564-1566.
[17] 解海,郑艳超,张振秋,等.黄连-吴茱萸配伍中盐酸小檗碱在大鼠体内的药动学研究[J].华西药学杂志,2013,28(4):388-391.
[18] 赵引利,杨冬丽,何燕宁,等.腰痛宁胶囊中士的宁在家兔体内的药动学研究[J].亚太传统医药,2016,12(15):33-37.
[19] 胡佳,张涛,黄华,等.盐酸坦洛新肠溶缓释微丸的制备及其体内外评价[J].中国新药杂志,2015,24(2):221-227.
[20] 蒋秋冬,吴叶鸣,张会,等.中药挥发油透皮促渗布洛芬的药动学及体内外相关性研究[J].中国中药杂志,2016,41(23):4362-4367.
[21] 吕立勋,李唐棣,赵琳琳,等.三清降糖方总苷缓释片的制备及其体内外相关性分析[J].中国实验方剂学杂志,2013,19(22):23-26.
[22] 王娟,狄留庆,单进军.中药传统丸剂的释药特点与机制分析[J].中成药,2012,34(4):723-725,730.endprint
