应用基质辅助激光解吸电离飞行时间质谱研究白色念珠菌血流感染的血清多肽指纹图谱
2018-02-01麻雅婷杨明何赏陈琛王成彬
麻雅婷,杨明,何赏,陈琛,王成彬
近年来,由于大量有创诊疗技术的开展、免疫抑制剂的应用以及广谱抗菌药物的滥用等,真菌性血流感染和深部真菌感染的检出率日益增高[1-2]。在真菌性血流感染的病原微生物分布中,主要以白色念珠菌为主[3-4],由于其诊断主要依靠血培养,阳性率低,培养时间长,因此常难以早期做出临床诊断。目前质谱技术已广泛应用于蛋白组学研究,在肿瘤性疾病及病原微生物鉴定方面发挥了巨大作用,但应用于血流感染血清多肽方面的研究罕见报道[5]。笔者前期研究了大肠埃希菌和金黄色葡萄球菌所致血流感染的血清多肽,通过比较差异多肽峰建立了相应的诊断模型[6]。为了解真菌性血流感染血清差异多肽有何不同,同时考虑到临床真菌血流感染标本收集复杂,本研究通过建立白色念珠菌血流感染小鼠模型,应用基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionizationtime of flight mass spectrometry,MALDI-TOF MS)联合弱阳离子交换磁珠(weak cation exchange,WCX)提取多肽技术,研究其血清多肽,并通过分析比较差异多肽峰建立相应的诊断模型,以辅助诊断真菌性血流感染。
1 材料与方法
1.1 菌株来源及实验动物 白色念珠菌标准菌株ATCC10231由解放军总医院微生物科惠赠。SPF级雄性ICR小鼠115只,体重25~27g,其中25只用于计算白色念珠菌半数致死量(LD50),90只用于后续建立白色念珠菌血流感染模型,均购自北京维通利华实验动物科技有限公司。小鼠饲养在ABSL2级动物室,在实验前适应性喂养1周。
1.2 仪器及试剂 MALDI-TOF MS质谱仪、α-氰基-4羟基肉桂酸(α-cyano-4-hydroxycinnamic acid,HCCA)及WCX磁珠均购自北京毅新博创生物科技有限公司,三氟乙酸(trifluoroacetic acid,TFA)、分析级乙腈购自北京化学试剂公司,实验用水为Milli-Q纯水器制备的去离子水。
1.3 菌液配制 对白色念珠菌标准菌株进行沙保弱培养基平板分纯,之后进行LB液体培养基增菌培养,将重悬的菌液配成4麦氏浊度,倍比稀释为5个浓度梯度,用稀释的白色念珠菌悬液经尾静脉注射小鼠,共5组(分别为麦氏浊度4.0、3.5、3.0、2.5和2.0),每组5只,注射量为0.1ml/10g,连续观察7d,每天观察并记录小鼠的精神状态和死亡情况。之后,按Karber法计算白色念珠菌的半数致死量(LD50)。通过前期实验所得,白色念珠菌的LD50为6.6×108CFU/ml,在建立白色念珠菌性血流感染模型时均以1/2 LD50浓度菌液感染小鼠。
1.4 动物模型的建立 小鼠随机分为白色念珠菌感染组80只和正常对照组10只。白色念珠菌感染组注射白色念珠菌菌液,正常对照组注射无菌PBS(注射量均为0.1ml/10g)。白色念珠菌感染组分别于感染后1、3、6、12、24、48、96、168h眼球取血法收集其血液标本,5000r/min离心20min,分装血清,每个时间点10只,–80℃储存。
1.5 血清多肽提取 操作步骤参考多肽提取试剂盒说明书,包括结合、清洗、洗脱。具体步骤如下:①涡旋混匀WCX磁珠,将10μl血清样品、10μl磁珠、95μl磁珠结合缓冲液混匀于0.2ml的PCR管中,室温静置5min后置于磁珠分离器内,静置1min;②小心移去上清,加入100μl磁珠清洗缓冲液,充分混匀后将PCR管置于磁珠分离器内,静置1min,小心移去上清;③重复步骤②2次;④向移去上清含磁珠的管中加入10μl磁珠洗脱缓冲液,混匀后静置1min,将管置于磁珠分离器内,静置1min,使磁珠吸附至管壁,吸出含有多肽的洗脱液并转移至新的0.2ml PCR管中,–20℃低温储存。
1.6 MALDI-TOF MS质谱分析及数据处理 ①将1μl洗脱的多肽样品点在ClinTOF-2靶板上,室温干燥后将1μl基质(0.8% HCCA)覆盖于样品上,室温干燥。②将靶板放入MALDI-TOF质谱仪,设置激光频率为10Hz,能量为80mV。③用标准品校正仪器后,检测样品,获得由不同质荷比(mass charge ratio,m/z)多肽峰构成的质谱图。所得多肽指纹图谱使用BioexplorerTM软件分析(Bioyong科技有限公司,中国北京)。所有谱图均经过归一化、基线校正和平滑处理。采用秩和检验比较两组峰值强度。采用径向基函数(RBF)神经网络算法建立区分白色念珠菌感染组和正常对照组之间的诊断模型。
2 结 果
2.1 小鼠感染后体征 小鼠在感染白色念珠菌后24h出现精神萎靡、活动减少等体征。小鼠在感染前体重为25~27g,感染后体重减轻为20~23g,表明小鼠白色念珠菌血流感染模型基本建立成功。
2.2 血清多肽质谱图的检测及对其差异多肽的分析 BioExplorerTM软件分析白色念珠菌感染组与正常对照组的血清多肽质谱图,共得到135个多肽峰,如图1所示。其中有5个多肽峰随感染时间延长呈上升趋势,6个多肽峰随感染时间延长呈下降趋势,7个多肽峰随感染时间延长呈现先上升后下降的趋势(图2)。组合m/z 1610.9、1742.3、2666.4、2778.0、3345.1、4528.8这6个峰建立诊断模型,该模型区分30例白色念珠菌感染小鼠有24例正确分类,正确率为80.0%。

图1 白色念珠菌感染组与正常对照组质谱图Fig.1 Serum peptide fingerprints of C. albicans infection group and normal control group

图2 白色念珠菌不同时间段感染血清多肽分析Fig.2 Serum peptide expressed in C. albicans infection group
2.3 大肠埃希菌、金黄色葡萄球菌和白色念珠菌差异多肽分析 分析比较白色念珠菌感染组和大肠埃希菌感染组的差异多肽发现,有9个峰在两种感染中共同出现,除了在3种感染中共同出现的5个峰(m/z 1513.8、2910.8、3538.1、3884.9和5007.3)外,其余4个分别为m/z 2951.3、7506.1、7516.2和8200.5,其中m/z 2951.3和8200.5在大肠埃希菌感染组中高于白色念珠菌感染组,m/z 7506.1和7516.2在白色念珠菌感染组中高于大肠埃希菌感染组(表1)。分析比较白色念珠菌感染和金黄色葡萄球菌感染的差异多肽发现,有8个峰在两种感染中共同出现,除了3种感染共同出现的5个峰(m/z 1513.8、2910.8、3538.1、3884.9和5007.3)外,其余3个分别为m/z 1646.8、2794.3和4106.2,且在金黄色葡萄球菌感染组中均高于白色念珠菌感染组(表2)。
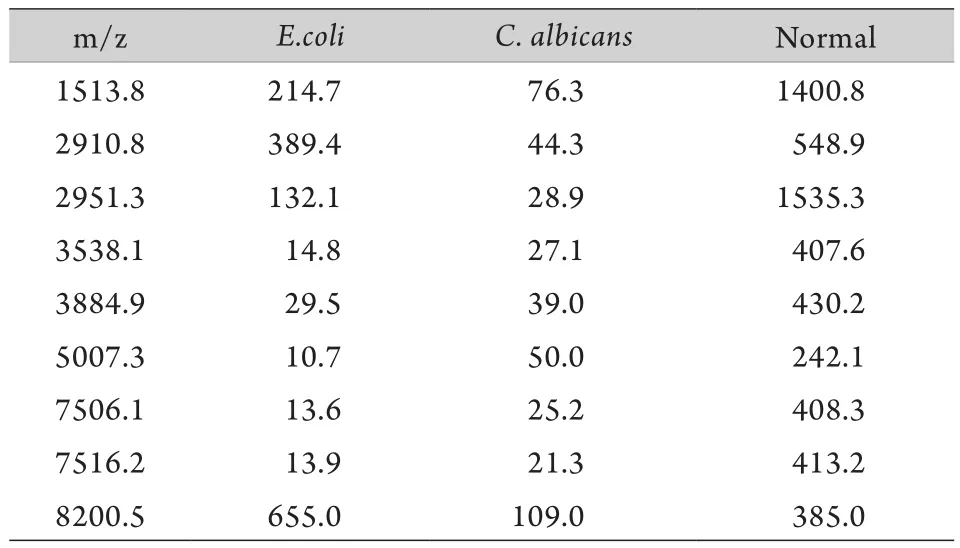
表1 白色念珠菌和大肠埃希菌感染血清多肽的比较Tab.1 Comparison of serum peptide between C. albicans infection group and E. coli infection group
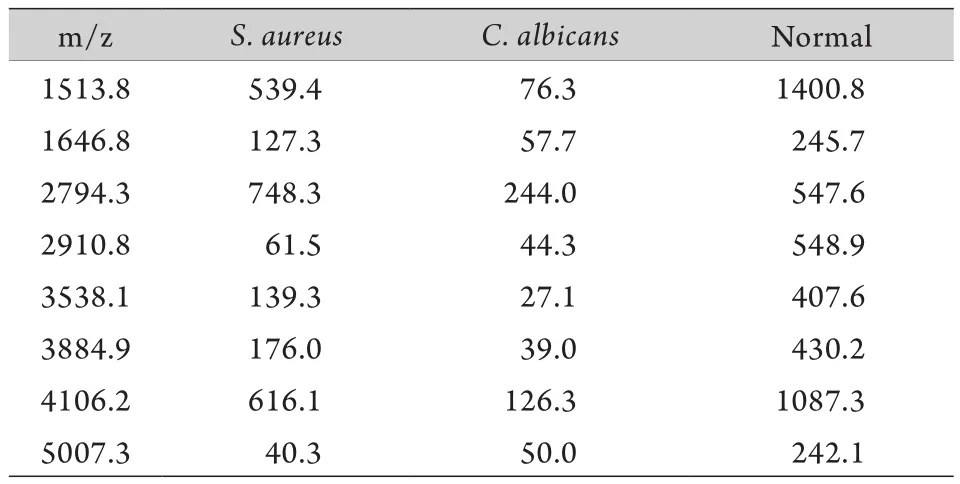
表2 白色念珠菌和金黄色葡萄球菌感染血清多肽的比较Tab.2 Comparison of Serum peptide between C. albicans infection group and S. aureus infection group
3 讨 论
近年来,由于激素的广泛应用及有创诊疗技术的开展,新型广谱抗生素的使用不断更新,免疫力低下受损的人群越来越多,使真菌性血流感染的发病率呈逐年上升趋势[7-8],已跃居医院获得性感染的第4位[2,9],其中最常见的真菌为白色念珠菌。真菌性血流感染缺乏良好的诊断方法,目前主要依靠血培养,但耗时长、阳性率低,导致临床上常难以早期诊断,因此,迫切需要一种快速、敏感、高效的方法来进行辅助诊断。MALDI-TOF MS是近几年研究蛋白组学常用的实验方法,常用于寻找有潜在价值的生物标志物,现已广泛应用于微生物鉴定、非小细胞肺癌、卵巢癌、肾脏疾病和糖尿病等方面的研究[5,10-12],而对于血流感染引起的血清蛋白组学变化罕见报道。前期本课题组已研究了大肠埃希菌和金黄色葡萄球菌造成的血流感染的血清多肽变化[6],本研究又增加并建立了白色念珠菌引起的血流感染模型,对三者之间的差异多肽峰进行比较。
本研究分析比较了白色念珠菌感染组在不同时间段的血清多肽,发现随着感染时间延长呈上升趋势的多肽有5个,以m/z 4528.8和m/z 5457.5为例,在感染第7天时其含量为前期感染的5倍之多,提示这几个峰可能是机体在对抗白色念珠菌感染时而产生的差异多肽,有望成为后续监测和辅助诊断真菌性血流感染的指标。随着感染时间延长呈下降趋势的多肽有6个,以m/z 7965.9和m/z 8107.9为例,在感染初期时其含量呈高水平状态,在感染3h时下降,在感染6~12h时其含量又上升,之后随着感染时间不断延长其含量呈下降趋势,这几个多肽峰虽然中间经历了短暂的小幅度变化,但从感染初期至感染7d其整体含量呈下降趋势,提示其有望成为早期辅助诊断白色念珠菌血流感染的指标。随着感染时间延长呈现先上升后下降趋势的多肽有7个,以m/z 1742.3和m/z 2666.4为例,在感染前24h内呈阶梯式上升,但到达峰值的时间基本上都在感染24h内,在感染24h后其含量呈下降趋势,提示机体先是在感染初期有相应的蛋白产生,随着机体免疫反应的出现,体内真菌的含量有可能下降,因此,这部分蛋白随着感染的不断恢复其含量也在不断下降,可作为今后治疗的监测指标。
大肠埃希菌、金黄色葡萄球菌[6]和白色念珠菌3种病原微生物感染小鼠后,有5个峰出现了统一的趋势,即在感染组中降低,在正常对照组中含量呈升高趋势,这5个峰分别为m/z1513.8、2910.8、3538.1、3884.9和5007.3,这几个峰的共同出现提示在病原微生物引起的血流感染过程中,虽然病原微生物不同,但有相似的免疫途径被激活,而且其各自激活的程度不同,这种不同可能与病原微生物本身有一定的关系(图3)。大肠埃希菌、金黄色葡萄球菌和白色念珠菌分别为血流感染中革兰阴性菌、革兰阳性菌和真菌的常见代表菌种,其各自的组成成分有很大不同[13-14]。革兰阴性菌和革兰阳性菌虽然都为原核细胞性微生物,但其细胞壁组成有很大差别,笔者已在文献[6]中予以阐述。真菌是真核细胞性微生物,首先菌体大小比原核细胞性微生物大。其次白色念珠菌是正常菌群之一,广泛存在于人体的口腔、皮肤、黏膜、消化道、阴道和脏器中,平时不致病,在人体抵抗力和免疫力低下时成为致病菌,常见的情况包括妊娠、糖尿病、口服避孕药、长期应用广谱抗生素、免疫抑制剂及糖皮质激素的使用,因此,随着有创诊疗技术的开展,真菌性血流感染的发病率日益增高[15-17]。念珠菌的致病力与以下因素有关:①黏附力:黏附力与毒力成正比,在念珠菌属中白色念珠菌黏附力最强;②两型性形态:当感染时,白色念珠菌常呈菌丝型,菌丝型的毒力比酵母型的毒力强;③毒素:菌细胞表面的多糖毒素和另一种被称为“念珠菌毒素”的特殊毒素可能是致病的因素;④细胞外酶:白色念珠菌可产生分泌一些酶,如溶血磷脂酶、磷脂酶和细胞外酸性蛋白酶(CAP)等,其中以CAP最为重要,CAP不仅能水解蛋白质,并能水解角蛋白及胶原,具有促进白色念珠菌黏附的功能[16-18]。
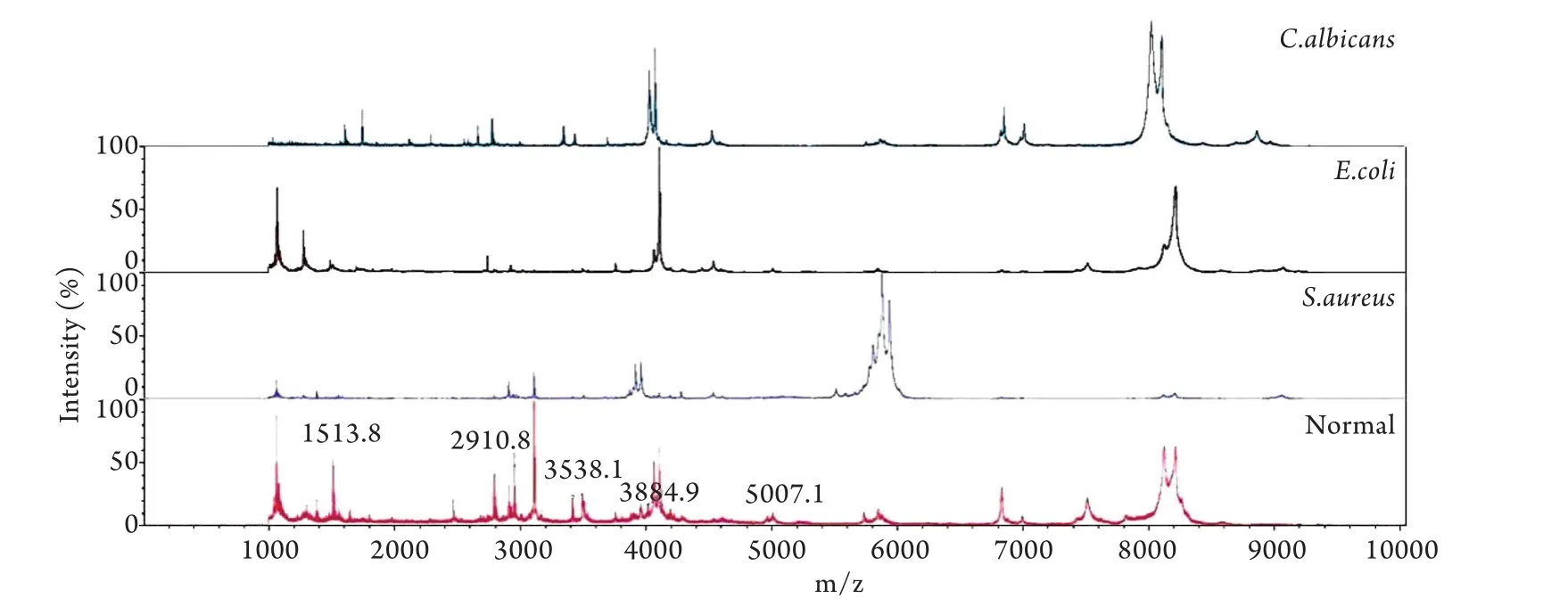
图3 感染组和正常组共有多肽峰比较Fig.3 The community of peptide expressed in infection groups and normal control group
综上所述,本研究通过建立细菌性和真菌性血流感染模型,收集不同时期血流感染血清,应用弱阳离子交换磁珠提取多肽,MALDI-TOF MS检测,BioExplorer软件分析寻找差异多肽峰,建立了相应的诊断模型,为血流感染的早期诊断和潜在标志物的寻找奠定了相应的基础,之后将继续建立不同种类细菌的血流感染模型并收集相应的临床标本进行验证。
[1]Da Y, Shi H, Liu WJ,et al. Analysis on the characteristics ofCandidainfection[J]. Lab Med Clin, 2017, 14(4): 458-460. [答嵘, 石红, 刘万静, 等. 念珠菌血流感染特点分析[J]. 检验医学与临床, 2017, 14(4): 458-460.]
[2]Wei L, Xia WY, Wang Y,et al. Distribution and drug sensitivity analysis of pathogenic fungi of fungal blood flow infection in 2013-2015[J]. Chin J Infect Chemoth, 2017, 17(3): 256-259.[魏凌, 夏文颖, 王珏, 等. 2013-2015年真菌血流感染病原真菌分布及药敏分析[J]. 中国感染与化疗杂志, 2017, 17(3):256-259.]
[3]Ling Y, Hou TY, Chen LQ,et al. Clinical analysis of 250 cases of fungal bloodstream infection[J]. Chin J Nosocomiol, 2016,26(21): 4876-4878, 4881. [凌勇, 侯铁英, 陈柳勤, 等. 250例真菌性血流感染的临床特点分析[J]. 中华医院感染学杂志,2016, 26(21): 4876-4878, 4881.]
[4]Liu Y. Incidence and nursing measures of 40 cases with fungal infection in ICU[J]. J Logist Univ PAP (Med Sci), 2015, 24(6):472-473. [刘颖. 重症监护病房40例真菌感染患者发病情况及护理措施[J]. 武警后勤学院学报(医学版), 2015, 24(6):472-473.]
[5]Kitamura Y, Usami R, Ichihara S,et al. Plasma protein profiling for potential biomarkers in the early diagnosis of Alzheimer's disease[J]. Neurol Res, 2017, 39(3): 231-238.
[6]Ma YT, Yang M, He S,et al. Study on the serum peptide map of bacterial bloodstream infection by matrix assisted laser desorption ionization time of flight mass spectrometry[J]. Med J Chin PLA, 2017, 42(5): 402-406. [麻雅婷, 杨明, 何赏, 等. 应用基质辅助激光解吸电离飞行时间质谱研究细菌性血流感染的血清多肽指纹图谱[J]. 解放军医学杂志, 2017, 42(5):402-406.]
[7]Mandelblat M, Frenkel M, Abbey D,et al. Phenotypic and genotypic characteristics ofCandida albicansisolates from bloodstream and mucosal infections[J]. Mycoses, 2017, 60(8):534-545.
[8]Piening BC, Geffers C, Gastmeier P,et al. Pathogen-specific mortality in very low birth weight infants with primary bloodstream infection[J]. PLoS One, 2017, 12(6): e0180134.
[9]Rodriguez L, Bustamante B, Huaroto L,et al. A multi-centric study ofCandidabloodstream infection in Lima-Callao,Peru: Species distribution, antifungal resistance and clinical outcomes[J]. PLoS One, 2017, 12(4): e0175172.
[10]Intelicato-Young J, Fox A. Mass spectrometry and tandem mass spectrometry characterization of protein patterns, protein markers and whole proteomes for pathogenic bacteria[J]. J Microbiol Methods, 2013, 92(3): 381-386.
[11]Zhang X, Yuan Z, Shen B,et al. Discovery of serum protein biomarkers in rheumatoid arthritis using MALDI-TOF-MS combined with magnetic beads[J]. Clin Exp Med, 2012, 12(3):145-151.
[12]Chu L, Fu GZ, Meng Q,et al. Identification of urinary biomarkers for type 2 diabetes using bead-based proteomic approach[J]. Diabetes Res Clin Pract, 2013, 101(2): 187-193.
[13]Duan J, Xie Y, Yang J,et al. Variation of circulating inflammatory mediators inStaphylococcus aureusandEscherichia colibloodstream infection[J]. Med Sci Monit, 2016, 22: 161-171.
[14]Richer L, Potula HH, Melo R,et al. Mouse model for sublethalLeptospira interrogansinfection[J]. Infect Immun, 2015, 83(12):4693-4700.
[15]Guo P, Qiao Y, Zhang HT,et al. Distribution and drug resistance analysis of 76 strains ofCandidainfection[J]. J Bengbu Med Coll, 2016, 41(5): 661-663. [郭普, 乔艳, 张海涛, 等. 76株念珠菌血流感染的菌群分布及耐药分析[J]. 蚌埠医学院学报,2016, 41(5): 661-663.]
[16]Liu R, Qiao L, Zhang JS, Analysis of the risk factors and prognosis ofCandidabloodstream infection[J]. J Clin Emerg Call, 2015, 16(1): 5-8. [刘蓉, 乔莉, 张劲松. 念珠菌血流感染病原学及影响预后的危险因素分析[J]. 临床急诊杂志,2015, 16(1): 5-8.]
[17]Zhang M, Zhou H, Yang Q,et al. Analysis of the risk factors and prognosis of candidiasis[J]. Chin J Microecol, 2014, 26(11):1282-1287. [张明, 周华, 杨青, 等. 念珠菌血症的危险因素和预后分析[J]. 中国微生态学杂志, 2014, 26(11): 1282-1287.]
[18]Li GH, Zhu DM, Wang F,et al. Distribution and drug resistance of clinical isolates of CHINET blood culture in China in 2012[J]. Chin J Infec Chemoth, 2014, 14(6): 474-481. [李光辉,朱德妹, 汪复, 等. 2012年中国CHINET血培养临床分离菌的分布及耐药性[J]. 中国感染与化疗杂志, 2014, 14(6): 474-481.]
