基于基质辅助激光解吸电离飞行时间质谱系统的血流感染致病菌早期检测
2018-02-01张可昕胡翀陈琛何赏杨明王成彬
张可昕,胡翀,陈琛,何赏,杨明,王成彬
由病原微生物引起的感染性疾病严重地威胁着人类的健康,其中以细菌感染最为常见,细菌性血流感染起病急、病情重、病死率高。近年来随着各项临床诊疗新技术的开展,侵入性治疗手段显著增多,患者接触病原菌的机会大大增加,加之患者自身免疫力已受损,感染更容易发生,严重者会诱发多器官功能障碍综合征,有极高的病死率[1]。目前,血流感染的诊断主要依赖血培养,但血培养鉴定周期过长,且标本采集、送检、培养过程中易受到众多因素的干扰,易污染且阳性率不高[2]。因此,临床亟须快速、敏感、准确的血流感染诊断方法和技术。核酸质谱技术在基因分型、核酸多态性研究、细菌耐药性分析等方面已有广泛研究与应用[3],现已成为快速检测、鉴定微生物的新型生物技术[4]。基质辅助激光解吸电离(matrixassisted laser desorption/ionization,MALDI)是质谱的一种高效电离方式[5],本研究通过综合解放军总医院检验科信息系统(laboratory information system,LIS)及国内相关文献,统计血培养结果,筛选出10种常见病原菌,针对这10种常见病原菌建立基于基质辅助激光解吸电离飞行时间质谱(matrixassisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)的检测体系,并测定其灵敏度,以期指导感染性疾病的精准诊断、精准治疗与精准用药。
1 材料与方法
1.1 试剂与仪器 多重PCR、虾碱性磷酸酶(shrimp alkaline phosphatase,SAP)消化、单碱基延伸过程采用的试剂盒MALDI-TOF-MS均购自Agena Bioscience公司(美国);DNA提取试剂盒购自Qiagen公司(德国)。引物由上海生工生物工程公司合成。
1.2 标本 实验所涉及的标准菌株包括金黄色葡萄球菌Staphylococcus aureusATCC25923、表皮葡萄球菌Staphylococcus epidermidisATCC12228、大肠埃希菌Escherichia coliATCC25922、变形杆菌Proteus mirabilisATCC29245、铜绿假单胞菌Pseudomonas aeruginosaATCC27853、肺炎克雷伯杆菌Klebsiella pneumoniaeATCC1144、鲍曼不动杆菌Acinetobacter baumanmiiATCC19606、肺炎链球菌Streptococcus pneumoniaeATCC49619、屎肠球菌Enterococcus faeciumATCC35667、粪肠球菌Enterococcus faecalisATCC29212,所有菌株均由解放军302医院检验科惠赠。
1.3 10种细菌血液感染模拟样本 取新鲜培养12h的各菌株,分别配制0.5麦氏单位(约3×108CFU/ml)的菌液100μl,加入200μl纯水中,得到约108CFU/ml的菌液,10倍梯度序列稀释至10~108CFU/ml。将10种菌株随机分为两组,每组取5种上述制备的浓度梯度细菌悬液各100μl与500μl新鲜人EDTA抗凝血等体积混匀于1.5ml无菌Eppendorf管中。室温放置30min后作为两组模拟梯度浓度5重感染全血标本用于后续实验,同时以不加细菌的血液作为阴性对照。
1.4 菌血症患者临床血浆样本 选取2017年3-5月解放军总医院急诊科收治的疑似脓毒症患者[发热(体温>38℃)或低体温(体温<36℃),可伴有寒战等全身中毒症状或中性粒细胞增多伴核左移等]33例,无菌操作采集患者外周静脉血12ml,其中2ml注入EDTA抗凝管,混匀,低速离心取血浆1.5ml待检;10ml注入血培养瓶(5ml/瓶),送微生物科全自动血培养仪(自BioMeriuex生物公司,法国)进行培养鉴定。
1.5 细菌基因组DNA提取及特异性引物设计 细菌基因组DNA提取按照试剂盒说明书进行。采用DNAMAN软件对各细菌毒力因子的基因序列进行比对,找到每种细菌毒力因子序列的相对保守区,用Primer Premier 5.0软件设计扩增引物,在NCBI数据库中比对引物的特异性和准确性,在目标位置设计单碱基延伸引物(表1)。
1.6 MALDI-TOF MS检测 ①PCR反应:反应体系5μl,包括10×Buffer 0.5μl,25mmol/L dNTP 0.1μl,25mmol/L MgCl20.4μl,0.5μmol/L混合引物1μl,5U/μlTaq酶0.2μl,DNA模板1μl,ddH2O 1.8μl;反应程序:95℃预变性2min,95℃变性30s、59℃退火30s、72℃延伸1min,共35个循环,最后72℃延伸5min。②SAP消化反应:共7μl体系,其中SAP酶混合液2μl(10×缓冲液0.17μl,1.7U/μl SAP酶0.3μl,无菌超纯水1.53μl),原PCR反应产物5μl;PCR仪上37℃反应40min,85℃孵育5min。③单碱基延伸反应:总体积9μl,上一步反应产物7μl,加入延伸混合引物2μl(延伸引物1μl,iPLEX缓冲液0.2μl,iPLEX终止液0.2μl,iPLEX酶0.041μl,无菌超纯水0.559μl);反应条件为94℃预变性30s、95℃变性5s、58℃退火5s、80℃延伸5s,内部循环5次,共40个外部循环,72℃延伸3min。反应完成后,反应产物中加入16μl超纯水,振荡混匀,短时离心,将25μl体积混合液全部转入384孔板中。加入6mg树脂,纯化反应30min,样品点靶,质谱检测,应用Typer 4.0软件检测质谱峰,根据质谱峰图判读样本感染细菌类型。

表1 各菌种单碱基延伸引物及延伸碱基Tab.1 Single base extension primers and extended bases for different bacterial strains
1.7 系统灵敏度检测 同1.3所示,分别建立10种细菌模拟梯度浓度单重感染全血样本,依次用本系统进行检测。细菌基因组DNA提取、检测反应体系及条件同上。
2 结 果
2.1 10种细菌感染菌血症模拟样本质谱检测 采用MALDI-TOF MS对模拟10种细菌感染的血液样本进行质谱检测,可同时检测到两组的10种细菌。第1组与第2组5种细菌脓毒症感染样本检测结果如图1A、图2A所示,5个靶点均有延伸峰,其阴性对照样本质谱图5个靶点均无延伸峰(图1B、图2B)。10种细菌脓毒症感染模拟样本经MALDI-TOF MS分析鉴定成功。
2.2 系统灵敏度检测 两组MALDI-TOF核酸质谱系统均能检测到每毫升血液中100个菌落的单一细菌(图3、4),两图中所有菌株的延伸引物均被消耗,无引物峰出现。该系统检测灵敏度为100CFU/ml。
2.3 临床样本MALDI-TOF MS检测及其与血培养法的比较 33例临床脓毒症样本中,血培养检测阳性样本有6例,分别为大肠埃希菌、粪肠球菌、摩氏摩根菌、人葡萄球菌、铜绿假单胞菌和鲍曼不动杆菌,阳性率18.2%(6/33),用时72~96h。核酸质谱系统检测阳性4例,分别是大肠埃希菌、粪肠球菌、铜绿假单胞菌和鲍曼不动杆菌,阳性率12.1%(4/33),用时9.5h;有2例病原菌(摩氏摩根菌、人葡萄球菌)不包含在该检测系统内,故未检出。

图1 第1组5种细菌多重感染脓毒症模拟样本质谱图Fig.1 MALDI-TOF MS of mimic sepsis infected with 5 kinds of bacteria in group 1

图2 第2组5种细菌多重感染脓毒症模拟样本质谱图Fig.2 MALDI-TOF MS of mimic sepsis infected with 5 kinds of bacteria in group 2
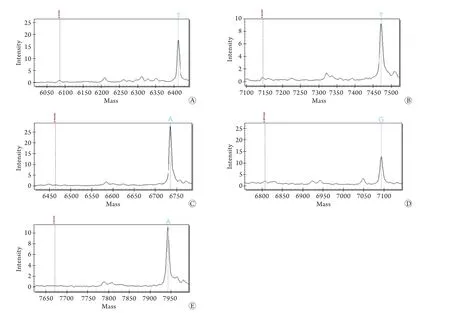
图3 第1组5种细菌MALDI-TOF MS检测灵敏度分析Fig.3 Sensitivity of 5 kinds of bacteria in group 1 detected by MALDI-TOF MS
3 讨 论
血流感染的早期诊断是国内外学者一直努力的目标,目前病原微生物诊断的金标准是血培养法[2],但是其操作过程复杂、耗时长,通常需要2d以上才能观察到结果,不能满足临床早期诊断的要求,尤其对营养要求较高的病原菌缺乏敏感性,很难培养出阳性结果[2],严重影响了患者的治疗和预后。血流感染致病菌的其他传统检测方法依据细菌形态学、染色特征及代谢特征进行鉴定,分度低,操作繁琐,不能准确区分到细菌种属,无法完全准确地指导临床进行抗生素的合理使用。
在基于分子生物学技术的细菌分类鉴定方法中,普通PCR法需要琼脂糖凝胶电泳进行产物鉴定,不仅操作繁琐,扩增的产物还会造成气溶胶污染,导致检测结果出现假阳性[4];另外琼脂糖凝胶电泳分辨率有限,对于低浓度的扩增产物容易导致假阴性结果。实时荧光定量的多重PCR技术受检测仪器通道数的限制,每次只能检测2~3种细菌[6],而患者感染的发生往往不是由单一细菌引起,而是1~2种细菌的混合感染[7],因此实时荧光定量PCR技术无法准确地反映菌群的组成和多样性。其他方法还包括DNA测序和病原体蛋白多肽特征指纹图谱法。DNA测序操作复杂,成本昂贵且费时;病原体蛋白多肽特征指纹图谱法通过MALDI-TOF MS对病原体中的蛋白多肽进行检测,但蛋白质谱检测需要不断增加质谱的细菌数据库,建立每种细菌的特征指纹多肽图谱,而且不同质谱系统对同一类型细菌的鉴定正确率存在一定差异[8]。

图4 第2组5种细菌MALDI-TOF MS检测灵敏度分析Fig.4 Sensitivity of 5 kinds of bacteria in group 2 detected by MALDI-TOF MS
本研究建立的核酸质谱检测系统,结合了简单、可靠的多重PCR技术和先进的Mass ARRAY iPLEX单碱基延伸技术、MALDI-TOF MS技术,通过判断分子量的差异进行感染细菌的基因检测,只需在明确检测目标的碱基差异后,通过引物设计自动获取并记录不同检测位点的分子量,随后在检测结果中根据各检测位点分子量位置的出峰情况鉴别被检样品中病原微生物的种类,特异性极高。如果为多重感染,则能同时获得多个对应的延伸峰(如图2所示),清晰客观地获得检测结果。与单纯PCR扩增和荧光定量PCR相比,核酸质谱技术进一步提高了检测的通量及灵敏度,一次可同时检测384个样本[9],本实验中每个样本可一次检测5个延伸位点;灵敏度高,能够直接检测到2个拷贝数的病原体[9],本实验检测灵敏度为100CFU/ml;检测时间短,一次检测只需9~10h即可完成。
目前分子生物学技术直接用于临床菌血症样本检测的难点在于菌血症患者血液中细菌数量少,细菌基因组难以获得[10],尤其以金黄色葡萄球菌为代表的革兰阳性球菌,细菌细胞壁厚,难以破壁[11],在全血中提取尤为困难。本实验摸索出全血样品细菌基因组DNA的提取方法,在使用Qiagen试剂盒提取前,首先低速离心得到富含菌体的血浆,物理振荡破碎菌体,该处理稳定了全血样品细菌基因组DNA提取技术,实现了无需血培养,对血流感染病原微生物直接、灵敏、准确的鉴定,大大缩短了检测时间。同时该检测体系已通过少量临床菌血症患者血液标本检测,有望为临床早期诊断提供一种新方法,下一步研究将收集大样本的临床标本对该检测系统的准确性和效能进行验证。
[1]Hina H, McDowell J. Minimising central line associated bloodstream infections'(CLABSIs) rate in inserting central venous catheters(CVCs) in the Adult Intensive Care Units(AICUs)[J]. J Clin Nurs, 2017, DOI: 10.1111/jocn.13824.
[2]Shachor-Meyouhas Y, Sprecher H, Moscoviz D,et al. Molecularbased diagnosis of bacteremia in the setting of fever with or without neutropenia in pediatric hematology-oncology patients[J]. J Pediatr Hematol Oncol, 2013, 35(7): 500-503.
[3]Xu F, Wang J, Wang J,et al. Correlation between TCM syndrome types of HBV-related hepatic cirrhosis and the polymorphism of IL-28B gene[J]. J Logist Univ PAP (Med Sci), 2017, 26(2): 104-108. [徐峰, 王娟, 王静, 等. 乙肝后肝硬化中医证型与白介素-28B基因多态性的相关性研究[J]. 武警后勤学院学报(医学版), 2017, 26(2): 104-108.]
[4]Boom D Van Den, Beaulieu M, Oeth P,et al. MALDI-TOF MS:A platform technology for genetic discovery[J]. Int J Mass Spectrom, 2004, 238(2): 173-188.
[5]Ma YT, Yang M, He S,et al. Studies on the serum peptide fingerprint of bacterial bloodstream infection by matrix-assisted laser desorption ionization time of flight mass spectrometry[J].Med J Chin PLA, 2017, 42(5): 402-406. [麻雅婷, 杨明, 何赏,等. 应用基质辅助激光解吸电离飞行时间质谱研究细菌性血流感染的血清多肽指纹图谱[J]. 解放军医学杂志, 2017,42(5): 402-406.]
[6]Meng FL, He LH, Gu YX,et al. Detection of mycoplasma pneumoniae by real-time fluorescence quantitative polymerase chain reaction[J]. Dis Surveillance, 2013, 28(3): 209-212. [孟凡亮, 何利华, 顾一心, 等. 实时荧光定量聚合酶链反应方法检测肺炎支原体[J]. 疾病监测, 2013, 28(3): 209-212.]
[7]Krzyzanski W, Rao GG. Multi-scale model of drug induced adaptive resistance of Gram-negative bacteria to polymyxin B[J].PLoS One, 2017, 12(3): e0171834.
[8]Smole SC, King LA, Leopold PE,et al. Sample preparation of Gram-positive bacteria for identification by matrix assisted laser desorption/ionization time-of-flight[J]. J Microbiol Methods,2002, 48(2-3): 107-115.
[9]Tost J, Gut IG. Genotyping single nucleotide polymorphisms by MALDI mass spectrometry in clinical applications[J]. Clin Biochem, 2005, 38(4): 335-350.
[10]Yu DJ, Tong WJ, Chen YM,et al. Study on extraction of bacterial genomic DNA from clinical specimens[J]. Chin J Microecol,2007, 19(6): 519-520, 523. [余道军, 童文娟, 陈岳明, 等. 临床标本细菌基因组DNA提取方法探讨[J]. 中国微生态学杂志,2007, 19(6): 519-520, 523.]
[11]Cheng S, Liu WL, Shu P,et al. Comparison and optimization of extraction methods of bacterial genomic DNA[J]. Lett Biotechnol, 2016, 27(3): 412-415. [程实, 刘文丽, 舒鹏, 等. 难提取细菌基因组DNA提取方法的比较与优化[J]. 生物技术通讯, 2016, 27(3): 412-415.]
