单形性嗜上皮性肠道T细胞淋巴瘤3例报道与文献复习
2018-02-01王莉黄德鸿肖春燕李昱张文军郭冰凌龚奕杨涛李启英南映瑜张军项颖
王莉,黄德鸿,肖春燕,李昱,张文军,郭冰凌,龚奕,杨涛,李启英,南映瑜,张军,项颖
肠病相关T细胞淋巴瘤(enteropathy-associated T cell lymphoma,EATL)是起源于肠道上皮内T淋巴细胞的淋巴瘤,占非霍奇金淋巴瘤(NHL)的近1%[1]。EATL分为两型(Ⅰ和Ⅱ型),其中Ⅱ型占10%~20%,2016年版WHO淋巴瘤分类中认为两种亚型是完全不同的两种疾病,并将Ⅱ型EATL正式命名为单形性嗜上皮性肠道T细胞淋巴瘤(monomorphic epitheliotropic intestinal T-cell lymphoma,MEITL),而Ⅰ型EATL成为EATL[1]。MEITL发病率低且诊断困难,本文总结了3例MEITL的临床表现、病理特点、分子生物学特征及诊治过程,并进行文献回顾,以期提高对MEITL的认识。
1 资料与方法
1.1 研究对象及方法 根据2016年版WHO淋巴瘤分类标准,回顾性地对2010-2016年在重庆市肿瘤医院和重庆医科大学附属第一医院诊治的非霍奇金淋巴瘤患者共3780例的病理资料进行筛选,共获得MEITL 3例,占同期治疗的NHL患者的0.08%。
3例患者的手术标本经4%多聚甲醛固定并石蜡包埋,进行HE染色和多种抗体免疫组化染色。免疫组化染色采用En vision两步法,所用第一抗体包括CD3、CD5、CD4、CD8、CD20、CD56、TIA1、CD30、髓过氧化物酶、Ki-67抗体,均购自福州迈新生物技术开发有限公司。Ki-67的阳性指数计算方法为:选择至少10个高倍视野,计算视野内淋巴瘤细胞中阳性细胞的平均值。3例均采用DNA-RNA原位杂交方法进行EB病毒编码的RNA(Epsein-Barr virus encoded RNA,EBER)检测。
1.2 文献检索 检索PubMed及中国知网、万方、维普网数据库,时间2007-2017年,检索英文关键词:“enteropathy associated T-cell lymphoma”“Monomorphic epitheliotropic intestinal T-cell lymphoma”,中文关键词“肠病相关T细胞淋巴瘤”“单形性嗜上皮性肠道T细胞淋巴瘤”。共检索得到英文文献377篇,中文文献50篇,经过手动筛查共获得MEITL的英文病例报道16篇共262例,中文病例报道4篇共54例。
2 结 果
2.1 病例1 男,62岁,因“腹胀3个月,黑便1个月”行电子计算机断层扫描(CT)发现腹部肿物,予以“回肠切除吻合术”,行CHOP方案(环磷酰胺+多柔比星+长春新碱+泼尼松)化疗1个疗程后中断治疗,半年后因腹胀伴排便困难再次手术,术中发现回肠穿孔,穿孔处3cm可触及肿物。继续CHOP方案化疗2个疗程后病情进展,改用GDP方案(吉西他滨+顺铂+地塞米松)化疗7个疗程,6个疗程后评价部分缓解(PR)。病情进展后给予DICE方案(地塞米松+异环磷酰胺+顺铂+足叶乙甙)化疗1个疗程,其后未进一步治疗,随访3个月后死亡。患者从发病到死亡时间约2年。
2.2 病例2 女,39岁,因“腹痛1个月,加重1d”入院,白细胞0.90×109个/L,X线片示双膈下游离气体,行“肠切除吻合术”后出现感染性休克、多器官功能障碍综合征,给予抗感染对症支持治疗后病情好转。CT示全身浅表、胸腹腔多个淋巴结肿大,肾有可疑浸润,双侧乳腺多个明显强化结节。左乳肿物、右乳肿物针吸检查结果见非霍奇金淋巴瘤细胞。给予CHOP方案化疗1个疗程,双乳腺结节较前明显缩小。患者粒细胞缺乏但拒绝继续治疗并出院,2d后死亡。
2.3 病例3 男,45岁,因“腹痛、腹胀1个多月”行CT检查,考虑为“小肠肿瘤性病变”。患者有多个淋巴结肿大及腹腔积液。肠镜检查示横结肠多发溃疡,病理检查提示“横结肠慢性溃疡病”。入院后因麻醉原因未能行小肠镜检查,患者和家属拒绝行淋巴结活检。随后患者右下腹痛加重,CT检查考虑腹腔空腔脏器穿孔伴腹膜炎可能性大,伴小肠不全性梗阻。给予“小肠肿瘤切除吻合术”,患者放弃化疗出院后失访。
2.4 病理检查结果
2.4.1 巨检特点 3例患者均为局限性肿块,肿瘤浸及肠壁全层,肠系膜见肿大淋巴结,病变肠管与周围肠管粘连,伴肠穿孔及肠梗阻。
2.4.2 组织病理学特征 3例患者小肠壁均可见异型淋巴样细胞弥漫增生、浸润,累及全层肠壁。病例1肠管全层见中等偏小淋巴样细胞浸润(图1A),黏膜表面溃疡形成,部分小肠绒毛上皮中见淋巴样细胞浸润,局部见坏死。病例2小肠黏膜广泛糜烂,肠壁全层慢性化脓性炎症伴弥漫异型淋巴样细胞浸润。肠系膜结节亦见大量异型淋巴样细胞浸润伴坏死。病例3肠壁全层见均匀、小而圆的肿瘤细胞,炎性细胞较少且单一,可见灶区小片状坏死。肠绒毛萎缩而肠隐窝增生,上皮内淋巴细胞增多(图1B)。
2.4.3 免疫组织化学和EBER原位杂交检测结果 3例METIL瘤细胞均表达CD3(图2A)、CD8(图2B)、CD56(图2C)、TIA-1,CD4、CD5部分瘤细胞阳性,CD20、CD79a、CD30、髓过氧化物酶阴性。Ki-67阳性指数50%~70%(图2D)。此外,原位杂交检测显示3例患者肿瘤组织EBER阴性,提示均无EB病毒感染。
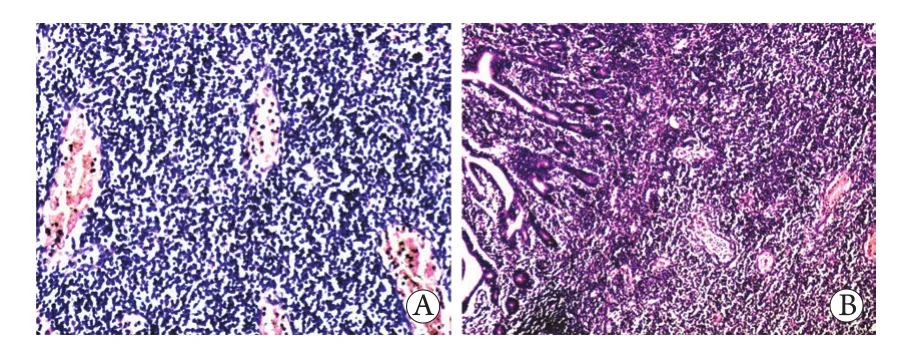
图1 MEITL病例的组织病理学结果(HE ×100)Fig. 1 Histopathological observations of MEITL tissue (HE ×100)

图2 MEITL病例的免疫组化结果(En vision ×100)Fig. 2 Immunohistochemistry observations of MEITL tissue (En vision ×100)
3 讨 论
与EATL好发于具有高乳糜泻发病率的地区如北欧、荷兰等的特点不同,MEITL常发生于亚洲和西班牙裔人群,且与乳糜泻无关。此外,两种疾病在临床特点、细胞形态、免疫表型和遗传学方面各具特点,2016年WHO正式将这两种疾病完全分开[1](图3)。
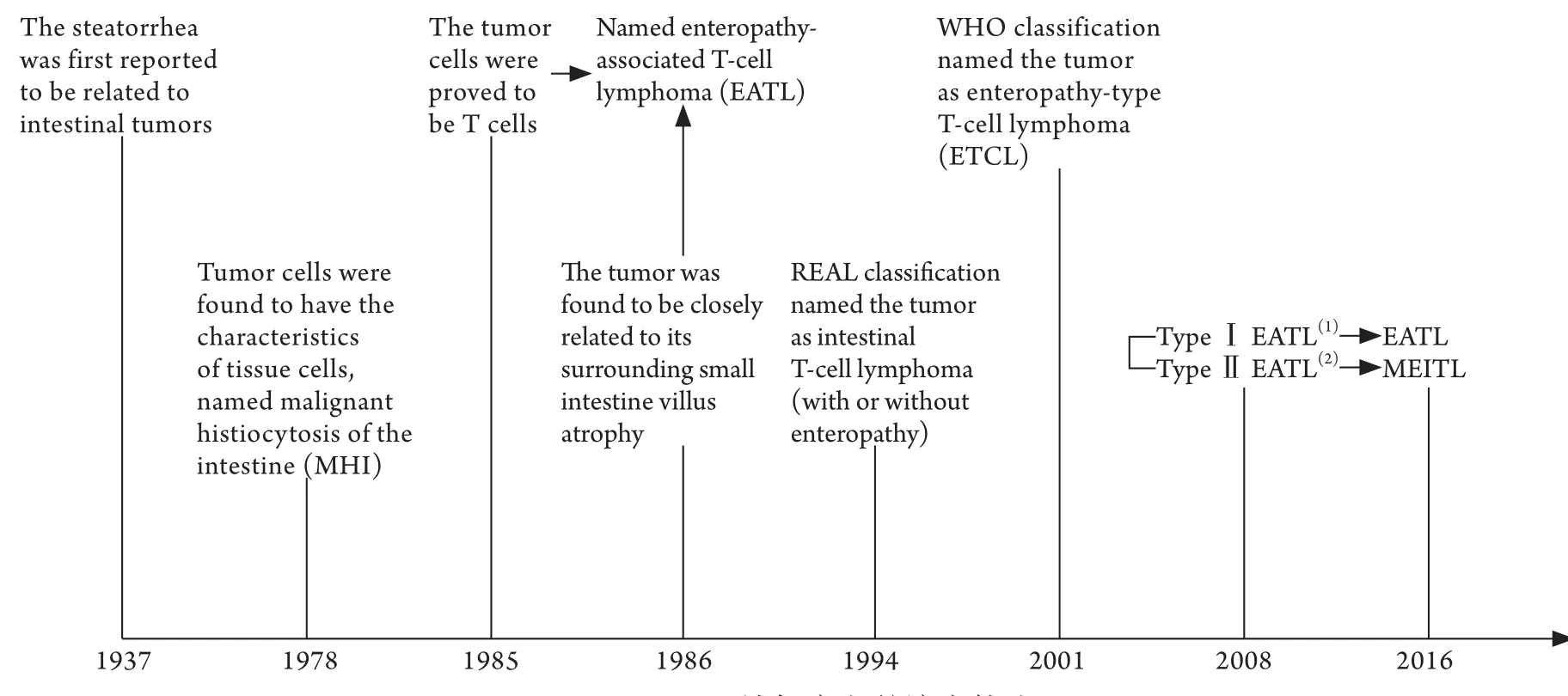
图3 MEITL认知定义的演变轨迹Fig. 3 The evolution of definitions for MEITL
既往发表的有关MEITL的英文文献显示病例主要来自韩国、日本、新加坡等国家,其次是美国、瑞士等欧美国家(表1)[2-14],而中文文献显示中国病例主要来自北京和南京两地[15-18],考虑与当地会诊病例较多,且医生比较关注此类疾病有关。由于我国大部分病例以单中心、个案报道的形式在中文期刊发表,有可能存在已知发病率低于真实发病率的情况。
3.1 临床特点 MEITL以男性多见,中位发病年龄约50岁。MEITL好发部位依次为小肠、大肠和胃。偶见发生于皮肤、卵巢等肠道外器官[14]。在本文中病例2不仅累及皮肤,同时还累及乳腺,其中乳腺受累为首次报道。MEITL的临床表现无特异性,可有腹痛、腹泻、腹部肿物、黑便、排便规律改变和便秘等表现[15-18];也可表现为不伴腹痛的大量腹水。全身症状可呈现疲乏、厌食、体重下降等,少见全身淋巴结肿大和骨髓侵犯。患者在病程中易出现肠穿孔、肠梗阻等并发症,其中以肠穿孔常见,如本文病例1在治疗过程中、病例2和3在诊断过程中均发生肠穿孔。该病进展快,预后差,中位总生存期仅11个月[13],5年生存率低于20%。本文报道的病例1因手术和确诊及时且治疗积极,所以存活时间长(在确诊2年后死亡);而病例2在发病后1个月即出现肠穿孔,术后化疗1个疗程后即放弃治疗死亡;病例3多次行肠镜活检未能确诊,肠道穿孔后行急诊手术得以确诊,其后放弃治疗失访。
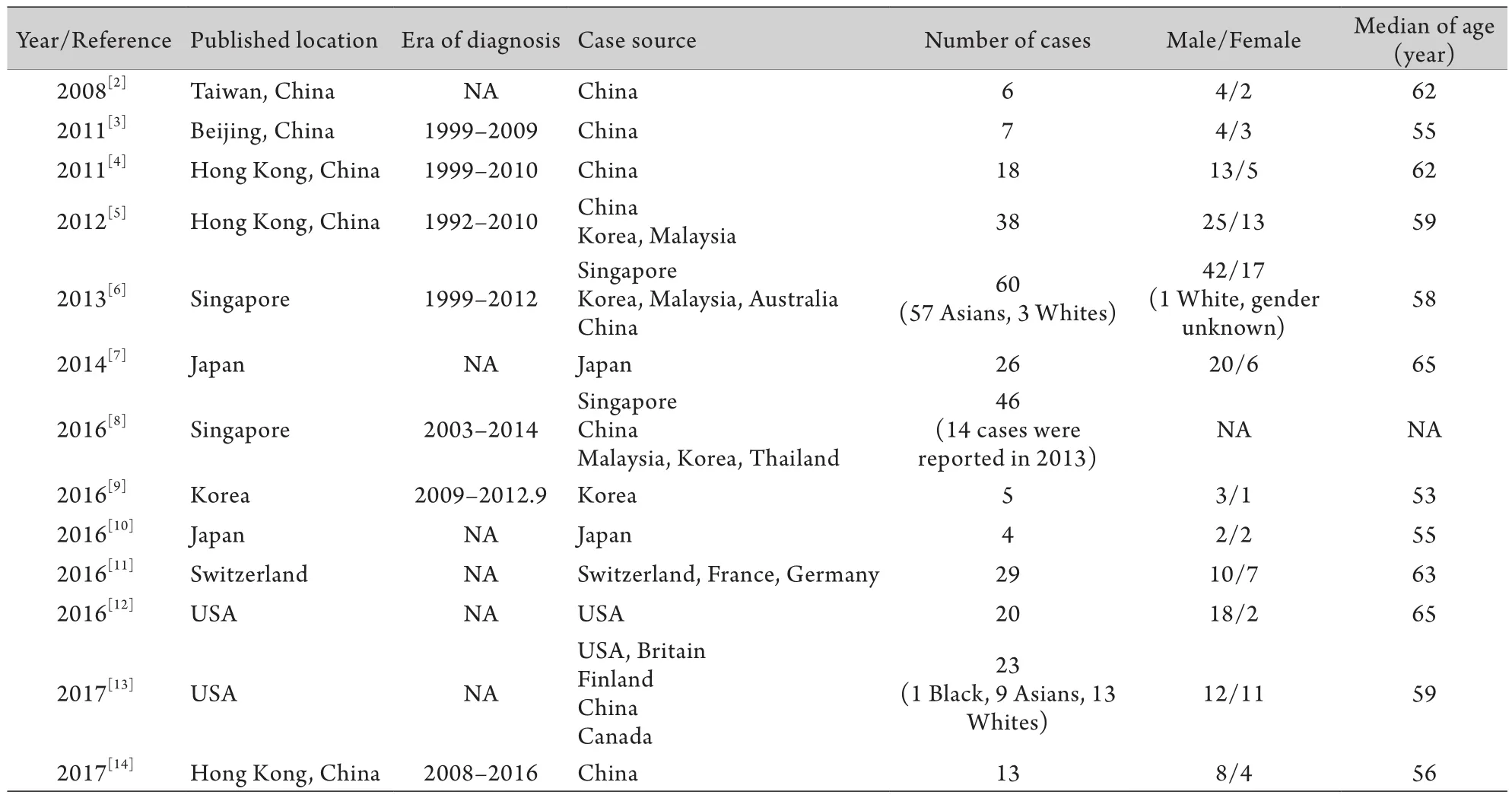
表1 既往文献报道的MEITL的全球发病情况Tab. 1 Global occurrence of MEITL reported in literatures
3.2 病理学及其他特征 ①镜下见肠道组织(包括隐窝和肠上皮)有一致的小圆形淋巴样细胞弥漫增生、浸润。②病变附近上皮萎缩,隐窝上皮增生[10]。③大多表达CD8、CD56、巨核细胞相关酪氨酸激酶(MATK)。④T细胞受体(TCR)基因重排,常见8q24(c-myc)扩增。⑤大多数MEITL来自γδ T细胞,某些病例会出现TCR沉默,某些表达TCRαβ。⑥在TCRαβ和TCRγδ起源的MEITL肿瘤中均发现存在STAT5B激活突变[12]。
在以上特征中,MATK核染色是区分MEITL与经典EATL和其他NK/T或T细胞淋巴瘤非常有用的工具[19],但是目前国内尚无商用抗体可购买。但经典EATL显示肿瘤细胞大小不一,与MEITL有较为明显的差异。
3.3 诊断与鉴别诊断 由于免疫标志物并非绝对特异性指标,所以MEITL尚缺乏特异性诊断标准,需要结合患者的临床表现、组织学特征及免疫组化检测结果进行综合分析[3-4]。MEITL的诊断要点如下:①中老年常见,以腹痛、腹泻为主要表现,常因肠道穿孔及腹部肿块就诊,进展快。②病理可见形态和种类较为单一的异型肿瘤细胞浸润肠壁全层,细胞中等偏小。多处肠道受累。③肿瘤细胞表达T细胞免疫表型(CD3、CD56)。④肿瘤及周围肠黏膜可见肠绒毛萎缩、隐窝加深,上皮内淋巴细胞增多等肠病表现。
病变组织的病理学检查是确诊此病的重要依据,但MEITL好发于小肠,因此普通肠镜检查无法获取癌变组织,本文病例3两次肠镜均未发现肿瘤。这类患者应采用胶囊内镜及双气囊小肠镜检查,可发现小肠弥漫性黏膜增厚和水肿,多种浅层溃疡、结节或马赛克黏膜模式。这种典型的内窥镜特征可为不明原因的腹痛、腹泻或肠梗阻患者诊断MEITL提供线索[9]。内镜活检取材时应在疑似溃疡区域和临近的非溃疡区域分别取材,且取材要足够深,以获取肿瘤组织。在不可能进行组织学检查的情况下,采用流式细胞术和细胞块技术对腹水进行检测获取肿瘤细胞是诊断MEITL的有用手段[20]。此外,正电子发射计算机断层显像(PET-CT)检查时若肿瘤组织异常高度摄取氟代脱氧葡萄糖(18F-FDG)将有助于诊断淋巴瘤。例如EATL病变仅局限于小肠,而MEITL病变可累及肠道的任何部位,并累及肠外组织[14]。个别伴有浅表淋巴结肿大的患者可行淋巴结活检明确诊断。病例3由于麻醉原因未能施行小肠镜检查,拒绝行浅表淋巴结活检,病情进展出现肠道穿孔行急诊手术才最后确诊。因此在病程中应严密观察病情变化,尤其是腹部体征,对于长期保守治疗无效又高度怀疑是小肠MEITL的患者有必要尽早行手术探查和治疗,在切除病灶的同时明确诊断。
MEITL在病理学上需与以下类型的淋巴瘤进行鉴别:①结外NK/T细胞淋巴瘤(鼻型)。该病通常缺乏TCR基因重排,EBER+,往往具有血管破坏性,NK/T细胞淋巴瘤最常见于呼吸系统,但也可累及胃肠道[21];②边缘区淋巴瘤具有B细胞的免疫表型;③间变性大细胞淋巴瘤(ALCL)。当ALCL表现为小细胞型时不易与MEITL鉴别,只能注意ALCL的特征是CD30+,CD3–。ALCL可发生于淋巴结或结外部位,结外可发生在胃肠道,其他更常见的部位有皮肤、骨骼、软组织和肺。
3.4 治疗 目前尚无标准化的治疗方案。采用吉西他滨替代蒽环类药物治疗其他类型的T细胞淋巴瘤备受关注。本文中病例1采用了2个疗程的CHOP方案后疾病进展,换用GDP方案治疗后获得了短暂的部分缓解。其他可选择的多药化疗方案包括hyper-CVAD方案(环磷酰胺+多柔比星+长春新碱+地塞米松/甲氨蝶呤+阿糖胞苷)等,但疗效尚有待更多病例证实。
综上,MEITL发病率低,及时的确诊和治疗均较难。MEITL具有高度侵袭性,对目前的治疗反应差,导致预后差。对于长期保守治疗无效又高度怀疑为小肠MEITL的患者有必要尽早行手术探查,结合免疫组织化学检查结果进行综合判断,避免漏诊或误诊。
[1]Swerdlow S H, Campo E, Pileri S A,et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms[J]. Blood, 2016, 127(20): 2375.
[2]Tung CL, Hsieh PP, Chang JH,et al. Intestinal T-cell and natural killer-cell lymphomas in Taiwan with special emphasis on 2 distinct cellular types: natural killer-like cytotoxic T cell and true natural killer cell[J]. Hum Pathol, 2008, 39(7): 1018-1025.
[3]Sun J, Lu Z, Yang D,et al. Primary intestinal T-cell and NK-cell lymphomas: a clinicopathological and molecular study from China focused on type Ⅱ enteropathy-associated T-cell lymphoma and primary intestinal NK-cell lymphoma[J]. Mod Pathol, 2011, 24(7): 983-992.
[4]Chan JK, Chan AC, Cheuk W,et al. Type Ⅱ enteropathyassociated T-cell lymphoma: a distinct aggressive lymphoma with frequent γδ T-cell receptor expression[J]. Am J Surg Pathol, 2011, 35(10): 1557-1569.
[5]Tse E, Gill H, Loong F,et al. Type Ⅱ enteropathy-associated T-cell lymphoma: a multicenter analysis from the Asia Lymphoma Study Group[J]. Am J Hematol, 2012, 87(7): 663-668.
[6]Tan SY, Chaung SS, Tang T,et al. Type Ⅱ EATL(epitheliotropic intestinal T-cell lymphoma): a neoplasm of intra-epithelial T-cells with predominant CD8αα phenotype[J]. Leukemia,2013, 27(8): 1688-1696.
[7]Kikuma K, Yamada K, Nakamura S,et al. Detailed clinicopathological characteristics and possible lymphomagenesis of type Ⅱ intestinal enteropathy-associated T-cell lymphoma in Japan[J]. Hum Pathol, 2014, 45(6): 1276-1284.
[8]Nairismägi ML, Tan J, Lim JQ,et al. JAK-STAT and G-proteincoupled receptor signaling pathways are frequently altered in epitheliotropic intestinal T-cell lymphoma[J]. Leukemia, 2016,30(6): 1311-1319.
[9]Hong YS, Woo YS, Park G,et al. Endoscopic findings of enteropathy-associated t-cell lymphoma type ii: a case series[J].Gut Liver, 2016, 10(1): 147-151.
[10]Ishibashi H, Nimura S, Kayashima Y,et al. Multiple lesions of gastrointestinaltract invasion by monomorphic epitheliotropic intestinal T-cell lymphoma, accompanied by duodenal and intestinal enteropathy-like lesions and microscopic lymphocytic proctocolitis: a case series[J]. Diagn Pathol, 2016, 11(1): 66.
[11]Roberti A, Dobay MP, Bisig B,et al. Type Ⅱ enteropathyassociated T-cell lymphoma features a unique genomic profile with highly recurrent SETD2 alterations[J]. Nat Commun, 2016,7: 12602.
[12]Nicolae A, Xi L, Pham TH,et al. Mutations in the JAK/STAT and RAS signaling pathways are common in intestinal T-cell lymphomas[J]. Leukemia, 2016, 30(11): 2245-2247.
[13]Moffitt AB, Ondrejka SL, McKinney M,et al. Enteropathyassociated T cell lymphoma subtypes are characterized by loss of function of SETD2[J]. J Exp Med, 2017, 214(5): 1371-1386.
[14]Chan TSY, Lee E, Khong PL,et al. Positron emission tomography computed tomography features of monomorphic epitheliotropicintestinal T-cell lymphoma[J]. Hematology,2018, 23(1): 10-17.
[15]Zhou J, Shen Q, Ma J,et al. Type Ⅱ enteropathy-associated T-cell lymphoma: A clinicopathologic study[J]. Chin J Pathol, 2013,42(1): 26-31. [周军, 沈勤, 马捷, 等. Ⅱ型肠病相关性T细胞淋巴瘤的临床病理观察[J]. 中华病理学杂志, 2013, 42(1):26-31.]
[16]Zhang JH, Li M, Huang X,et al. Clinicopathological analysis of 273 cases of primary intestinal non-Hodgkin's lymphoma[J].Chin J Hematol, 2014, 35(6): 499-504. [张景航, 李敏, 黄欣,等. 273例肠道原发性非霍奇金淋巴瘤临床病理学研究[J].中华血液学杂志, 2014, 35(6): 499-504.]
[17]Yang YQ, Wang L, Fan L,et al. Analysis of clincal characteristics of 7 cases of enteropathy-associated T-cell lymphoma[J]. Chin J Pract Intern Med, 2015, 35(2): 155-158. [杨玉琼, 王莉, 范磊,等. 肠病相T细胞淋巴瘤7例临床特征分析[J]. 中国实用内科杂志, 2015, 35(2): 155-158.]
[18]Da WZM, Gao ZF, Lin M,et al. Analysis of clinicopathological features of 21 patients with enteropathy-associated T-cell lymphoma[J]. Cancer Res Clinic, 2016, 28(5): 300-303. [达娃卓玛, 高子芬, 林梦, 等. 肠病相关T细胞淋巴瘤21例临床病理特征分析[J]. 肿瘤研究与临床, 2016, 28(5): 300-303.]
[19]Chen Y, Tan SY, Petersson BF,et al. Occult recurrence of monomorphic epitheliotropic intestinal T-cell lymphoma and the role of MATK gene expression in diagnosis[J]. Hematol Oncol, 2016. doi: 10.1002/hon.2288. [Epub ahead of print].
[20]Tanaka H, Ambiru S, Nakamura S,et al. Successful diagnosis of type Ⅱ enteropathy-associated T-cell lymphoma using flow cytometry and the cell block technique of coelomic fluid manifesting as massive pyoid ascites that could not be diagnosedviaemergency laparotomy[J]. Intern Med, 2014, 53(2): 129-133.
[21]Qin BB, Li YQ, Li XL,et al. Expressions of key molecules of Wnt/β-catenin signal pathway in NK/T-cell lymphoma tissue and their significances[J]. J Jilin Univ (Med Ed), 2015, 41(2):230-234, 438. [秦贝贝, 李亚青, 李小丽, 等. Wnt/β-catenin通路关键分子在NK/T细胞淋巴瘤组织中的表达及其临床意义[J]. 吉林大学学报(医学版), 2015, 41(2): 230-234, 438.]
