Del-1对特异性过敏患儿嗜酸性粒细胞表面ICAM-1表达的影响
2018-02-01阎淑,张泓
阎 淑, 张 泓
(上海交通大学附属儿童医院检验科,上海 200040)
特异性过敏是儿科常见的变态反应性疾病,可严重影响患儿的生活和学习质量,其重要特征是特异性IgE增加及嗜酸性粒细胞浸润[1]。炎症部位嗜酸性粒细胞增多与嗜酸性粒细胞和内皮细胞之间的黏附密切相关。细胞间黏附分子1(intercellular cell adhesion molecule-1,ICAM-1)是一种重要的黏附分子,其受体为淋巴细胞功能抗原(lymphocyte function-associated antigen-1,LFA-1)。当ICAM-1与LFA-1结合后可使白细胞与内皮细胞之间形成牢固结合,从而趋化白细胞到炎症局部。在特异性过敏性炎症中, ICAM-1可趋化嗜酸性粒细胞到炎症部位[2]。此外,有研究还表明,在炎症性疾病中,白细胞介素17(interleukin 17,IL-17)可诱导ICAM-1的表达,促进炎症细胞趋化到炎症部位从而加重炎症[3]。
发育内皮基因1(developmental endothelial locus-1,Del-1)是组织内血管内皮细胞合成的糖蛋白,由Edil3基因编码。Del-1是一种功能强大的内源性免疫负调控因子,可与LFA-1结合抑制ICAM-1介导的炎症细胞黏附。最近有研究报道,Del-1参与了IL-17的炎症调控,表现为正常牙周组织中Del-1拮抗IL-17的产生及抑制炎症反应[4]。但在特异性过敏中,Del-1对ICAM-1介导的细胞间黏附的作用尚不清楚。我们的前期研究发现,在特异性过敏中,当嗜酸性粒细胞阳离子蛋白(eosinophil cationic protein,ECP)表达上升时,Del-1表达下降,提示在特异性过敏中Del-1可能与嗜酸性粒细胞相关[5]。为此,本研究拟通过分析Del-1对嗜酸性粒细胞上趋化因子ICAM-1表达的影响,探讨Del-1在特异性过敏中发挥作用的可能机制。
1 材料和方法
1.1 研究对象
选取上海交通大学附属儿童医院2015年11月—2016年4月特异性过敏患儿35例,其中男16例、女19例,年龄6~10岁,所有患儿血清中特异性IgE(包括吸入性过敏原和食物性过敏原)等级≥4级。这些患儿无除过敏以外的急、慢性疾病, 2周内无激素使用史。
1.2 方法
1.2.1 磁珠分选(magnetic-activated cell sorting,MACS) 采集患儿室温(20~25 ℃)肝素抗凝静脉血10 mL,立即采用嗜酸性粒细胞分选试剂盒(德国美天旎公司)分选嗜酸性粒细胞。步骤为:将10 mL血清用1×磷酸盐缓冲液(phosphate-buffered saline,PBS)按1∶1稀释,沿管壁缓慢叠加于20 mL淋巴细胞分离液(天津美德太平洋公司)液面上,20 ℃ 600×g离心30 min,保留最下面红细胞和粒细胞层,用50 mL 1×红细胞裂解液悬浮细胞,常温孵育10 min,20 ℃以300×g离心8 min,用冰缓冲液(pH值 7.2,1×PBS, 0.5 %牛血清白蛋白,2 mmol/L 乙二胺四乙酸)洗2次,得到富含嗜酸性粒细胞的粒细胞群,调细胞浓度至1×107/mL。以300×g离心10 min,弃上清,每1×107个细胞加入缓冲液40 μL,生物素标记的复合抗体(CD2、CD14、CD16、CD19、CD56、CD123 和 CD235a)10 μL, 充分混匀后4 ~ 8 ℃孵育10 min;每1×107个细胞再分别加入缓冲液30 μL、包被于磁珠表面的第二抗体(抗生物素抗体)20 μL,充分混匀后4~8 ℃孵育15 min;加入2 mL缓冲液,以300×g离心10 min,弃上清,加入缓冲液500 μL重悬细胞;以3 mL缓冲液冲洗MS分选柱,使细胞悬液通过MS分选柱,收集从MS分选柱中流出的细胞,即为纯化的嗜酸性粒细胞(阴性分选);将MS分选柱撤离磁场后以缓冲液冲洗,流出的细胞悬液即为除嗜酸性粒细胞以外的粒细胞(非嗜酸性粒细胞)。嗜酸性粒细胞纯度用FACS Calibur流式细胞仪(美国BD公司)分析鉴定。用台盼蓝染色细胞,细胞存活率达到99%以上。
1.2.2 Del-1处理及细胞培养 将上述方法中得到的细胞悬液调到1×106/mL,加1 mL完全细胞培养液(RPMI1640加 10% 胎牛血清)至24孔板中培养细胞,加入终浓度为5 μg/mL可溶性Del-1抗体(美国R&D Systems公司) 、10 μg/mL抗Del-1(美国R&D Systems公司)或5 ng/mL IL-17蛋白(美国R&D Systems公司)处理。对照组用PBS处理。在CO2孵箱中培养48 h后收集细胞进行逆转录聚合酶链反应(polymerase chain reation,PCR)检测。
1.2.3 实时荧光定量 PCR 培养后细胞总RNA的提取方法参照RNAiso Plus试剂盒(大连宝生物公司)说明书进行。抽提出的总RNA,采用ABI 7500 system通过一步法逆转录PCR扩增磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)及ICAM-1。GAPDH引物序列上游为5'-GAAGGTGAAGGTCGGAGTCA-3',下游为5'-GAAATCCCATCACCATCTTC-3';ICAM-1引物序列上游为5'- AGGGTAAGGTTCTTGCCCAC-3',下游为5'- TGATGGGCAGTCAACAGCTA-3'。逆转录PCR的结果用2-ΔΔCT方法处理。
1.3 统计学方法
采用SPSS 15.0软件进行统计分析。检测结果以x ±s表示,2个样本均数比较采用t检验,2个以上样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 Del-1处理后嗜酸性粒细胞上ICAM-1 mRNA的表达
为研究Del-1对嗜酸性粒细胞上ICAM-1表达的影响,用可溶性Del-1处理嗜酸性粒细胞,发现Del-1处理组ICAM-1 mRNA表达水平(-13.03±2.14)低于对照组(1.41±0.99),差异有统计学意义(P<0.05)。见图1。
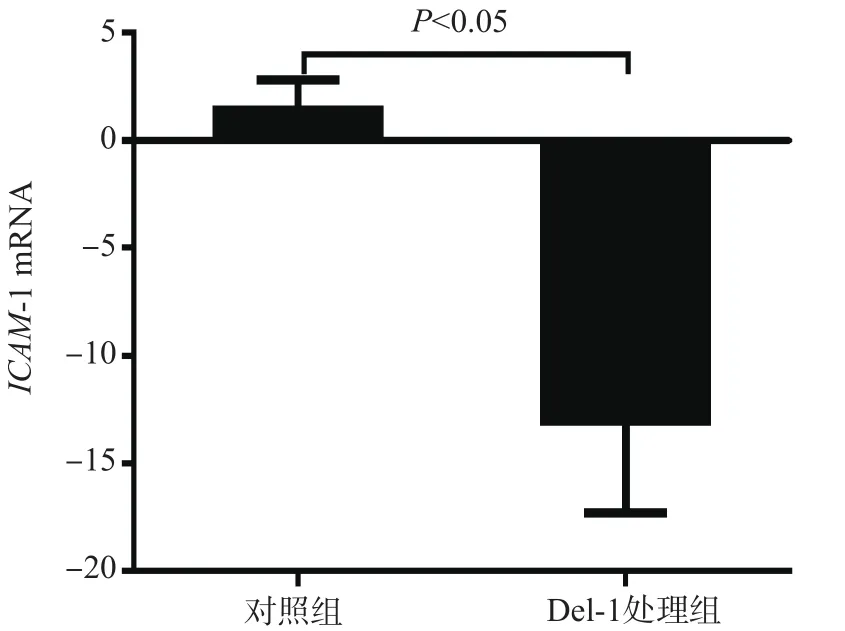
图1 Del-1处理后嗜酸性粒细胞上ICAM-1 mRNA的表达
2.2 抗Del-1抗体处理后嗜酸性粒细胞上ICAM-1 mRNA的表达
为进一步验证Del-1对嗜酸性粒细胞上ICAM-1表达的影响,用抗Del-1抗体处理嗜酸性粒细胞,发现抗Del-1抗体处理组ICAM-1 mRNA表达水平(20.05±4.50)高于对照组(1.41±0.99),差异有统计学意义(P<0.05)。见图2。
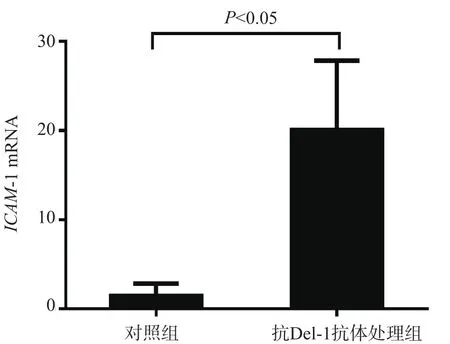
图2 抗Del-1抗体处理后嗜酸性粒细胞上ICAM-1 mRNA的表达
2.3 Del-1对IL-17处理后嗜酸性粒细胞上ICAM-1 mRNA表达的影响
为研究IL-17在Del-1抑制嗜酸性粒细胞中的作用,用可溶性Del-1和/或IL-17处理嗜酸性粒细胞,结果发现IL-17处理组ICAM-1 mRNA表达水平(6.51±0.82)高于对照组(0.94±0.52)(P<0.05);Del-1与IL-17共同处理组ICAM-1 mRNA表达水平(2.48±0.07)低于单独IL-17处理组(6.51±0.82)(P<0.05)。见图3。

图3 Del-1对IL-17处理后嗜酸性粒细胞上ICAM-1 mRNA表达的影响
2.4 Del-1或抗Del-1处理后非嗜酸性粒细胞上ICAM-1 mRNA的表达情况
为研究Del-1对非嗜酸性粒细胞上ICAM-1表达的影响,用可溶性Del-1处理非嗜酸性粒细胞,发现Del-1处理组ICAM-1 mRNA表达水平(-1.27±0.66)与对照组(-0.09±0.61)比较,差异无统计学意义(P>0.05);抗Del-1抗体处理组ICAM-1 mRNA表达水平(1.67±0.15)与对照组比较,差异无统计学意义(P>0.05)。见图4。
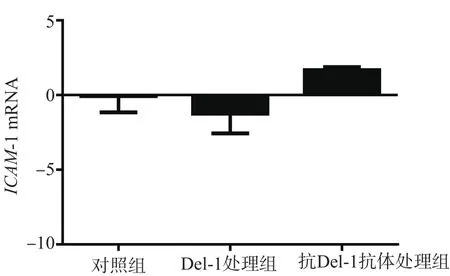
图4 Del-1或抗Del-1处理后非嗜酸性粒细胞上ICAM-1 mRNA的表达
3 讨论
特异性过敏是一类由特异性IgE介导的Ⅰ型变态反应性炎症性疾病。以嗜酸性粒细胞和淋巴细胞浸润为主,有多种炎性细胞参与。活化的嗜酸性粒细胞可以通过释放ECP、嗜酸性粒细胞过氧化物酶等细胞毒性蛋白导致组织直接损伤,其中ECP是嗜酸性粒细胞活化的主要标志物,也是反映过敏性炎症的重要指标之一[6]。我们前期的研究结果也显示,在特异性过敏中ECP表达显著上升[5]。Del-1是组织内血管内皮细胞合成的糖蛋白。Del-1的重要生物学作用是负向调控免疫系统炎症反应,维持组织局部免疫平衡[7]。在ECP明显升高的特异性过敏中,Del-1的表达明显下降[5],提示Del-1参与了特异性过敏的嗜酸性粒细胞炎症反应,但具体机制尚不明确。有研究显示,在特异性过敏中,嗜酸性粒细胞穿过血管内皮细胞聚集于组织局部与过敏性炎症过程密切相关,而嗜酸性粒细胞表面表达的黏附分子与其聚集密切相关[8]。ICAM-1是这些黏附分子中重要的一种。为此,本研究从特异性过敏患儿外周血中分离出嗜酸性粒细胞,用可溶性Del-1处理后检测了ICAM-1 mRNA的表达情况。结果发现Del-1可以抑制嗜酸性粒细胞上ICAM-1 mRNA的表达。提示Del-1可能通过抑制嗜酸性粒细胞上ICAM-1的表达抑制嗜酸性粒细胞趋化到炎症局部,从而负向调节特异性过敏性炎症。为了进一步验证Del-1对嗜酸性粒细胞上ICAM-1表达的影响,本研究用Del-1的中和抗体处理分离出的嗜酸性粒细胞,结果发现抗Del-1抗体处理后,嗜酸性粒细胞上ICAM-1 mRNA的表达明显上升,提示Del-1可能通过调节嗜酸性粒细胞上ICAM-1的表达来调节特异性过敏中嗜酸性粒细胞的趋化功能,从而参与特异性过敏炎症。
特异性过敏主要是由Th1/Th2 细胞失衡引起。但越来越多的研究发现,炎症细胞 Th17也参与其病变的发生,IL-17 是由 Th17 分泌的炎症介质[9]。在特异性过敏患者的肺泡灌洗液、肺组织、痰液以及外周血标本中IL-17表达明显升高[10]。我们前期的研究结果显示,在特异性过敏患儿肺泡灌洗液中,IL-17表达明显升高[5]。升高的IL-17诱导了趋化因子及Th2相关细胞因子的产生,使嗜酸性粒细胞在炎症局部聚集。为此,本研究用IL-17处理外周血分离出的嗜酸性粒细胞,结果显示IL-17可以上调ICAM-1 mRNA的表达,这可能是IL-17诱导嗜酸性粒细胞浸润的机制之一。有研究表明,Del-1参与了IL-17炎症调控,表现为正常牙周组织中,Del-1拮抗IL-17的产生及抑制炎症反应[3]。在特异性过敏中,Del-1与IL-17呈直线负相关[5],提示Del-1可能通过影响IL-17的产生和作用影响儿童特异性过敏性疾病的发生和发展。为此,本研究在IL-17处理嗜酸性粒细胞的同时加入Del-1,分析Del-1对于IL-17上调嗜酸性粒细胞上ICAM-1表达的影响。结果显示,Del-1可以下调IL-17诱导的ICAM-1 mRNA表达,这说明在IL-17表达升高的特异性过敏性炎症中,Del-1可以抑制嗜酸性粒细胞黏附分子表达,从而抑制特异性过敏中嗜酸性粒细胞的聚集。
为进一步研究Del-1对过敏性哮喘中粒细胞趋化作用的影响,本研究用Del-1处理分离嗜酸性粒细胞后的其他粒细胞(非嗜酸性粒细胞)。结果显示,不管是用Del-1处理还是用抗Del-1抗体处理,非嗜酸性粒细胞上ICAM-1 mRNA的表达都无明显差异,这可能是由于本研究应用特异性过敏患儿标本,其非嗜酸性粒细胞上的ICAM-1表达本身就低,在炎症局部聚集并不明显之故。提示在特异性过敏中Del-1主要作用于嗜酸性粒细胞表面的ICAM-1,抑制特异性过敏炎症局部嗜酸性粒细胞的聚集,从而减轻过敏反应。
综上所述,在特异性过敏中,Del-1可抑制嗜酸性粒细胞表达ICAM-1,并且拮抗IL-17诱导的ICAM-1表达升高,但对非嗜酸性粒细胞的ICAM-1表达影响不明显。提示在特异性过敏中,Del-1可能通过调节嗜酸性粒细胞表达ICAM-1,影响特异性过敏性炎症的发生和发展。Del-1可作为儿童特异性过敏安全治疗方案的新靶点。
[1]蔡德丰, 陆元善, 袁艳, 等. 儿童急、慢性荨麻疹IgE及嗜酸性粒细胞检测分析[J]. 检验医学,2014,29(11): 1120-1123.
[2]GATAULT S, DELBEKE M, DRISS V, et al.IL-18 is involved in eosinophil-mediated tumoricidal activity against a colon carcinoma cell line by upregulating LFA-1 and ICAM-1[J]. J Immunol,2015, 195 (5): 2483-2492.
[3]YANG X, YANG J, ZOU H. Baicalin inhibits IL-17-mediated joint inflammation in murine adjuvantinduced arthritis[J]. Clin Dev Immunol, 2013,2013: 268065.
[4]ESKAN M A, JOTWANI R, ABE T, et al. The leukocyte integrin antagonist Del-1 inhibits IL-17-mediated inflammatory bone loss[J]. Nat Immunol,2012, 13(5): 465-473.
[5]阎淑, 陈黎, 张泓. Del-1在儿童特异性过敏性疾病支气管肺泡灌洗液中的表达及其与IL-17的相关性[J]. 现代免疫学, 2013, 33(5): 403-406.
[6]WANG X, ZHANG N, BO M, et al. Diversity of THcytokine profiles in patients with chronic rhinosinusitis: a multicenter study in Europe,Asia, and Oceania[J]. J Allergy Clin Immunol,2016, 138(5): 1344-1353.
[7]QIN X, LIU J Y, ABDELSAYED R, et al. The status of glucocorticoid-induced leucine zipper protein in the salivary glands in Sjögren's syndrome: predictive and prognostic potentials[J]. EPMA J, 2016, 7: 3.
[8]JIAO D, WONG C K, QIU H N, et al. NOD2 and TLR2 ligands trigger the activation of basophils and eosinophils by interacting with dermal fibroblasts in atopic dermatitis-like skin inflammation[J]. Cell Mol Immunol, 2016, 13(4): 535-550.
[9]GAVINO A C, NAHMOD K, BHARADWAJ U,et al. STAT3 inhibition prevents lung inflammation,remodeling, and accumulation of Th2 and Th17 cells in a murine asthma model[J]. Allergy, 2016, 71(12): 1684-1692.
[10]王娟. Th17细胞与过敏性疾病[J]. 检验医学,2011, 26(8): 567-571.
