HPA-1a、HPA-3a、HPA-5b抗体MAIPA定量检测方法的建立
2018-02-01李睿书
李睿书, 凌 冰, 陆 萍
(上海市血液中心 上海市输血研究所,上海 200051)
作为国际输血学会(the International Society of Blood Transfusion,ISBT)推荐的检测人类血小板抗原(human platelet antigen,HPA)抗体的金标准,单克隆抗体特异性免疫固定检测(monoclonal antibody-specific immobilization of platelet antigen,MAIPA)法具有很高的敏感性和特异性,其重要特点之一是血小板(platelet,PLT)表面抗原在与血清中的抗体、特定抗人PLT膜糖蛋白单抗结合的过程中,仍然保持着天然的构象。另外,MAIPA还可用于PLT的分型。然而,国内虽然有使用MAIPA进行PLT抗体检测的临床应用[1-3],但成熟稳定的MAIPA定量检测方法尚未建立。在引发新生儿同种免疫性血小板减少症的HPA抗体中,HPA-1a、HPA-5b和HPA-3a的抗体相对较为常见[4-5]。为此,本研究初步建立了针对HPA-1a、HPA-3a和HPA-5b抗体的MAIPA定量检测方法。
1 材料和方法
1.1 主要试剂
采用G&T SSP Typer基因分型试剂盒(美国G&T Biotech公司,批号W9902、B9811A)对重复献血者进行人类白细胞抗原(human leukocyte antigen,HLA)和HPA基因分型,建立上海市单采PLT供者资料库。O型HPA-1a/a、HPA-3a/a、HPA-5a/b的新鲜单采PLT来自资料库筛选的特定血型的献血者,采集于上海市血液中心。HPA-1a标准抗血清、HPA-3a参比抗血清、HPA-5b参比抗血清购自英国国家生物制品检定所,货号分别为03/152、03/190、99/666;小鼠抗人CD61单克隆抗体购自美国BD公司,货号为555752;小鼠抗人CD41和CD49b单克隆抗体购自美国R&D公司,货号分别为MAB7616和MAB1233;羊抗鼠IgG单抗、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗人IgG均购自美国Jackson公司,货号分别是115-005-071、109-035-098;包板液、HRP底物3,3',5,5'-四甲基联苯胺和终止液均购自美国SurModics公司。其他试剂均为国产分析纯试剂。
1.2 方法
1.2.1 酶标板包被 用包被液稀释羊抗鼠IgG至3 μg/mL,平底酶标板每孔加入100 μL,4 ℃静置过夜,Tris盐缓冲液(Tris 1.21 g、NaCl 8.5 g、CaCl20.055 g、NP40 5 mL、Tween 0.5 mL,定容至1 L)洗涤3次并浸泡30 min封闭。
1.2.2 PLT准备 单采PLT用磷酸盐缓冲液(phosphate-buffered saline,PBS)/乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA;含EDTA- Na23.35 g、Na2HPO4·12H2O 7.52 g、NaCl 8.18 g,pH值调至7.0,定容至1 L)溶液洗涤,1 455×g离心 5 min,弃上清,重复2次。PLT洗涤完毕后重新悬浮于PBS/EDTA中,用血液分析仪将终浓度调整至200×109/L。
1.2.3 MAIPA定量检测方法的建立 在U形底微孔板中每孔加入100 μL PLT悬液,1 455×g离心3 min,弃上清,在吸水纸上轻轻拍干。根据实验设计,在各孔中分别加入标准抗血清或待测血清样品50 μL,将PLT轻轻吹打均匀,37 ℃孵育30 min。用PBS/EDTA洗涤2次,每次1 455×g离心3 min,弃上清,在吸水纸上轻轻拍干。各孔加入合适浓度的鼠抗人相应PLT糖膜蛋白单抗40 μL(稀释液为0.1%牛血清白蛋白-PBS),将PLT轻轻吹打均匀,37 ℃孵育30 min。用PBS/EDTA洗涤3次,每次1 455×g离心3 min,弃上清,在吸水纸上轻轻拍干。每孔加入130 μL裂解液(Tris 0.6 g、NaCl 4.25 g、NP40 2.5 mL,pH值调至7.4,定容至0.5 L),将PLT吹打悬浮,室温裂解15 min。4 ℃ 3 724×g离心15 min,每孔吸取上清100 μL至封闭好的平底酶标板中,4 ℃反应2 h。TBS洗涤液洗涤3次,每孔加入合适浓度的HRP标记的羊抗人IgG(稀释液为0.1%牛血清白蛋白-PBS),37 ℃孵育30 min。TBS洗涤液洗涤3次,每孔加入3,3',5,5'-四甲基联苯胺,室温显色30 min,加入终止液终止反应,在酶标仪450 nm波长处检测吸光度(A)值。
1.2.4 方法学评价 (1)标准曲线:HPA-1a标准抗血清(03/152)的原始浓度为100 UI,HPA-3a抗血清(03/190)和HPA-5b抗血清(99/666)的原始浓度均为100 AU,分别配制不同浓度的HPA-1a抗血清(0、1、2、3、4 IU)、HPA-3a抗血清(0、1、2、4、8、12、16、20 AU)和HPA-5b抗血清(0、2、4、8、12、16、20 AU),绘制标准曲线,并进行线性拟合。(2)敏感性试验:分别对上述3种抗血清零标准品测定20次,以检测值的x +3s作为方法的敏感性,计算方法为将算得的x +3s值代入标准曲线,得到的相应抗体浓度即为敏感性。(3)特异性试验:用3种抗体的MAIPA定量检测法分别对以上3份抗血清(03/152、03/190、99/666)和人源抗体抗A、抗B、抗I、抗P(滴度>1∶64,10倍稀释)进行测定,根据方法的敏感性判断其阴、阳性。(4)准确性和精密度试验:针对方法检测HPA-1、HPA-3a、HPA-5b抗体的MAIPA方法,分别选择对应的标准抗血清或参比抗血清线性范围内的3个不同浓度,批内测定12次,批间测定7次,分别计算其平均回收率和变异系数(coefficient of variation,CV)。

表1 HPA-1a、HPA-3a和HPA-5b抗体MAIPA定量检测标准体系经优化后的实验条件
2 结果
HPA-1a、HPA-3a和HPA-5b抗体MAIPA定量检测标准体系经过优化的实验条件见表1。
2.1 标准曲线
HPA-1a、HPA-3a和HPA-5b 3种抗体的MAIPA定量检测方法的检测范围分别为0~4 IU、0~20 AU、0~20 AU,标准曲线在检测范围内具有良好的线性拟合度(R2> 0.99)。见图1。
2.2 敏感性
HPA-1a、HPA-3a、HPA-5b 3种抗体的MAIPA定量检测方法的敏感性分别为0.3 IU、1.0 AU和1.5 AU。见表2。
2.3 特异性
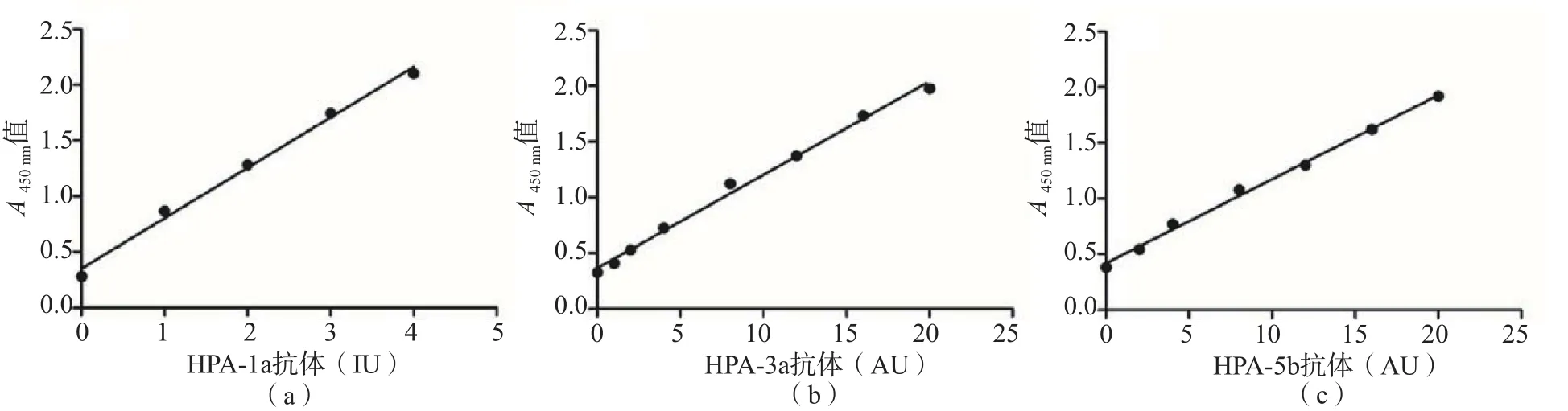
图1 HPA-1a、 HPA-3a和HPA-5b 3种抗体MAIPA定量检测方法的标准曲线
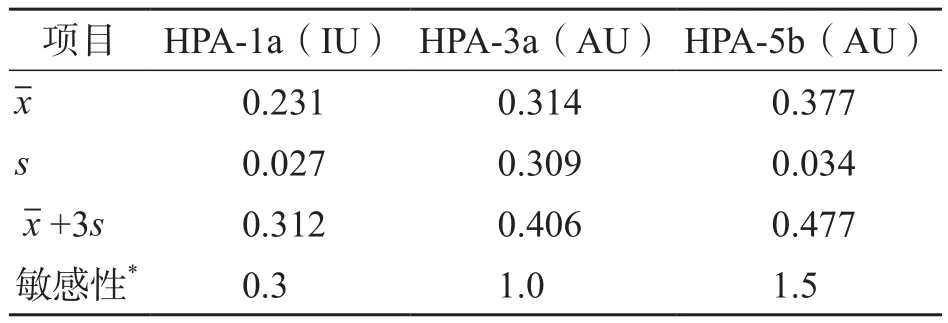
表2 HPA-1a、HPA-3a、HPA-5b 3种抗体MAIPA定量检测方法的敏感性
HPA-1a、HPA-3a、HPA-5b 3种抗体的MAIPA定量检测方法检测不同HPA抗血清(03/152、03/190、99/666)均为阳性,而检测人源抗体抗A、抗B、抗I、抗P均无明显阳性。方法具有良好的特异性。见图2。
2.4 准确性和精密度

图2 MAIPA定量检测方法的特异性
HPA-1a、HPA-3a、HPA-5b 3种抗体的MAIPA定量检测方法的准确性(回收率)为96.20%~103.10%、97.90%~103.10%、100.20%~106.10%,批内精密度(CV)分别为1.3%~3.6%、2.7%~5.2%和4.7%~5.3%,批间精密度(CV)分别为4.0%~5.6%、4.4%~5.9%和3.2%~6.3%。见表3。
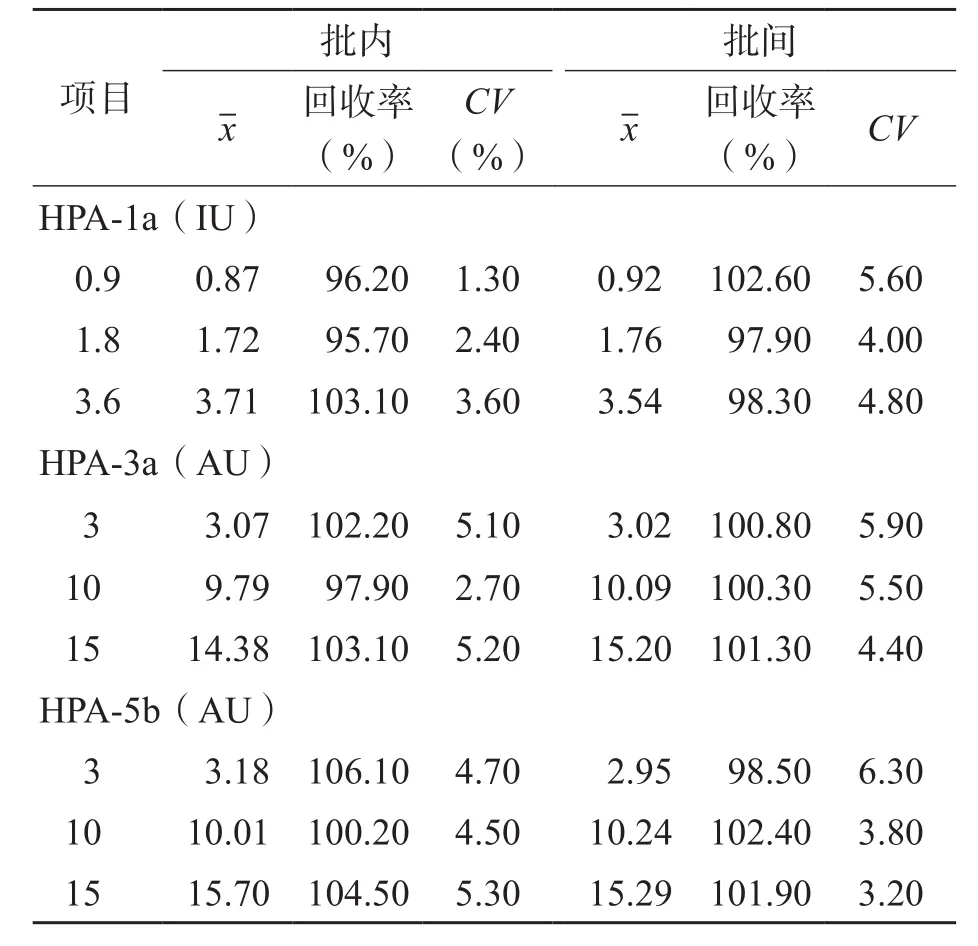
表3 HPA-1a、HPA-3a、HPA-5b 3种抗体MAIPA定量检测方法的准确性和精密性
3 讨论
人类PLT抗原是分布在PLT膜糖蛋白上的一类具有型特异性的抗原,在临床上具有特定意义。在输血或妊娠过程中,由于HPA血型不合而产生的同种抗体可引发多种同种免疫疾病。在临床输注PLT时,如果患者血清中检测出PLT抗体,则应该针对抗体的特异性,采用相应抗原阴性的供体PLT进行输注,否则可能引起严重的输血反应。
目前,HPA抗体检测的方法较多,各有优缺点。MAIPA作为ISBT推荐的检测HPA抗体的金标准,在众多方法中有着特殊的地位。MAIPA最大的优点是能检测出HPA抗体的特异性,因为PLT糖蛋白与待测血清以及对应鼠源单抗反应时能保持天然构象,其抗原性没有受到任何破坏。因此,MAIPA也成为ISBT PLT免疫学研讨会质控项目的指定检测方法。尽管已经成为金标准,国外也有一些对于MAIPA实验方法建立和改良的报道[6-10],并且将其应用于免疫性PLT减少症的临床分析和诊断[11-16]。然而,成熟稳定的MAIPA标准定量检测方法尚未形成。
在建立本方法的实验过程中,本研究对多个步骤的反应条件进行了调整和优化,通过单因素变量分析,同时将实验成本作为考虑因素之一,确定了各步骤的最优条件。预试验结果显示,当HPA-1a标准抗血清浓度超过4 IU时,A450nm值随抗体浓度升高而增加的趋势趋于缓慢,并且逐渐接近平台,因此本研究认为其最佳检测范围是0~4 IU。对于HPA-3a和HPA-5b抗体,当参比抗血清超过20 AU时,A450nm值达到较高水平(>2.0),但仍然有升高的趋势。考虑到实际运用时,若待测样品的测量值过高,会将其稀释到一个合适的值,因此从节约成本的角度考虑,本研究并没有去尝试寻找其检测范围的上限值。从图2可以看出,用本研究建立的MAIPA定量检测方法检测HPA-3a、HPA-5b抗体时,根据表2中的敏感性判断,HPA-1a抗血清(03/152)检测呈弱阳性,这可能是因为高浓度(10 IU)的HPA-1a抗体造成了非特异吸附。但在实际应用中,如果未知样本中有如此高浓度的HPA-1a抗体,则在HPA-1a抗体的MAIPA定量检测方法中会显示极强的阳性而被检出;在采用MAIPA定量检测方法检测HPA-3a和HPA-5b抗体时,如仅显示弱阳性,则可以认为该样本无HPA-3a、HPA-5b抗体,即使有少量该抗体,与高浓度的HPA-1a抗体相比其临床意义也可基本忽略。因此该现象并不影响本研究建立的MAIPA定量检测方法的临床应用。起初实验时,HPA-3a和HPA-5b抗体检测体系显色普遍很低,为了提高敏感性,我们尝试改变了多种条件。预实验结果显示,改变待测血清与PLT反应的时间和温度以及反应体系的离子强度对实验结果的影响很小。改变反应体系的pH值或加入少量聚乙二醇,可以微弱地增加反应强度。而提高二抗浓度,尤其是HPA-3a和HPA-5b抗体检测体系,可以大大增强反应强度,提高敏感性。
本研究还得到了一些经验性的结论,如:提高PLT浓度对实验的敏感性并无显著的改善作用;酶免疫实验中,封闭通常使用含一定浓度蛋白的试剂,而本研究中的封闭液是否含有蛋白成分却对结果影响不大;HPA-1a抗原在PLT上数量较多,也较为稳定,正常状态下保存2周以上仍可以保持完整的抗原性,实验效果依然较好,而HPA-3a和HPA-5b抗原表达量相对较低,所以反应强度也相应较弱,只能通过提高二抗浓度的方法来提高检测敏感性等。
本研究结果还显示,影响MAIPA检测结果的因素众多,使用不同的单克隆抗体或不同保存方式的PLT等,得到的结果都不尽相同[17]。因此,虽然国内早有利用MAIPA进行临床诊断的报道,但其仅用于定性分析,并没有建立稳定的检测体系并得到定量的检测结果[2-3]。本研究将MAIPIA方法中的各可控因素确定下来,获得了准确性和稳定性均较好的MAIPA定量检测方法,同时具有较高的敏感性和特异性,对于PLT输注无效、新生儿同种免疫性PLT减少症等疾病的诊断具有较高的应用价值。
[1]秦平,侯明,孙建芝,等. 直接MAIPA对免疫性和非免疫性血小板减少性紫癜的鉴别诊断[J]. 中华血液学杂志,2005,26(3):167-169.
[2]张颖琪,陈钰,夏文权,等. 血小板抗体检测方法的比较及其临床应用[J]. 上海医学,1997,20(2):95-97.
[3]胡翊群,BOEHLEN F,夏文权,等. 抗血小板抗原3a,5b(HPA-3a,5b)引起的新生儿同种免疫血小板减少症[J]. 中华血液学杂志,1997,18(3):40-41.
[4]DAVOREN A,CURTIS B R,ASTER R H,et al.Human platelet antigen-specific alloantibodies implicated in 1 162 cases of neonatal alloimmune thrombocytopenia[J]. Transfusion,2004,44(8): 1220-1225.
[5]KROLL H,YATES J,SANTOSO S. Immunization against a low-frequency human platelet alloantigen in fetal alloimmune thrombocytopenia is not a single event:characterization by the combined use of reference DNA and novel allele-specific cell lines expressing recombinant antigens[J]. Transfusion,2005,45(3): 353-358.
[6]KIEFEL V,SANTOSO S,WEISHEIT M,et al.Monoclonal antibody-specific immobilization of platelet antigens(MAIPA): a new tool for the identification of platelet-reactive antibodies[J].Blood,1987,70(6): 1722-1726.
[7]KIEFEL V. The MAIPA assay and its applications in immunohaematology[J]. Transfus Med,1992,2(3): 181-188.
[8]STOCKELBERG D,HOU M,JACOBSSON S,et al. Detection of platelet antibodies in chronic idiopathic throbocytopenic purpura(ITP). A comparative study using flow cytometry,a whole platelet ELISA,and an antigen capture ELISA[J].Eur J Haematol,1996,56(1-2): 72-77.
[9]BERTRAND G,JALLU V,GOUET M,et al.Quantification of human platelet antigen-1a antibodies with the monoclonal antibody immobilization of platelet antigens procedure[J]. Transfusion,2005,45(8): 1319-1323.
[10]CAMPBELL K,RISHI K,HOWKINS G,et al. A modified rapid monoclonal antibodyspecific immobilization of platelet antigen assay for the detection of human platelet antigen(HPA)antibodies: a multicentre evaluation[J]. Vox Sang,2007,93(4): 289-297.
[11]BRIGHTON T A,EVANS S,CASTALDI P A,et al. Prospective evaluation of the clinical usefulness of an antigen-specific assay(MAIPA) in idiopathic thrombocytopenic purpura and other immune thrombocytopenias[J]. Blood,1996,88(1):194-201.
[12]BERTRAND G,MARTAGEIX C,JALLU V,et al. Predictive value of sequential maternal anti-HPA-1a antibody concentrations for the severity of fetal alloimmune thrombocytopenia[J]. J Thromb Haemost,2006,4(3):628-637.
[13]KILLIE M K,HUSEBEKK A,KAPLAN C,et al.Maternal human platelet antigen-1a antibody level correlates with the platelet count in the newborns:a retrospective study[J]. Transfusion,2007,47(1):55-58.
[14]SOCHER I,ZWINGEL C,SANTOSO S,et al. Heterogeneity of HPA-3 alloantibodies:consequences for the diagnosis of alloimmune thrombocytopenic syndromes[J]. Transfusion,2008,48(3):463-472.
[15]DAVOREN A,SMITH G,LUCAS G,et al. Neonatal alloimmune thrombocytopenia due to HPA-3a antibodies: a case report[J].Immunohematology,2002,18(2):33-36.
[16]BERTAND G,JALLU V,BERANGER T,et al.HPA-5 typing discrepancy reveals an Ile503Leu substitution in platelet GPIa(α2 integrin)[J]. Vox Sang,2013,105(1):73-76.
[17]KILLIE M K,SALMA W,BERTELSEN E,et al.Quantitative MAIPA:comparison of different MAIPA protocols[J]. Transfus Apher Sci,2010,43(2): 149-154.
