基于正交试验的根霉固态转化坎利酮工艺条件优化
2018-01-31黄达明杜卓蓉张志才管国强
黄达明,杜卓蓉,张志才,管国强
(江苏大学 食品与生物工程学院,江苏 镇江 212013)
坎利酮(canrenone)是一种甾体激素类心血管药物,临床上可用作醛固酮拮抗剂治疗水肿、心衰、高血压、肝腹水等疾病。坎利酮治疗心血管疾病的效果较为显著,但若用于治疗心脏病,可能存在用药过量而导致死亡的危险后果,且其对强心剂地高辛(digoxin)的定量检测有负面干扰[1]。因此人们开始通过生物或化学转化的方法对坎利酮进行结构修饰,以期增强药效并减少副作用。在坎利酮的众多羟基化衍生物中,11α-羟基坎利酮受到广泛关注。因为它是合成另一种心血管药物依普利酮的重要医药中间体。依普利酮与坎利酮相比,副作用明显减小[2]。因此,11α-羟基坎利酮具有极大的市场需求。
微生物可以通过其胞内的11α-羟化酶对甾体底物进行羟基化。国内外目前对甾体类化合物的微生物转化研究都集中在液态发酵的领域。由于甾体化合物水不溶性的特性,在液态发酵过程中往往要添加各类表面活性剂作为底物助溶剂,增加底物在发酵液中的溶解度,从而提高转化率[3-6]。如王森[4]利用黑根霉转化16α,17α-环氧黄体酮,并添加吐温为底物助溶剂,最终转化率达到45%,KOLET S P等[5]利用毛霉转化黄体酮,并添加四氢呋喃为底物助溶剂,最终转化率达到94%,RESTAINO O F等[6]利用玫瑰产色链霉菌转化氢化可的松,并添加二甲基甲酰胺(dimethylformamide,DMF)为底物助溶剂,最终转化率达到(58±2.9)%;在底物为坎利酮的甾体化合物微生物液态发酵研究中,刘晓等[7]通过赭曲霉的高密度培养,在7 L发酵罐进行工艺放大,坎利酮转化率为86.1%;黄达明等[8]通过优化转化工艺条件,最终使坎利酮的转化率达到87.68%;张晓丽等[9]则研究了单一乳化剂sp60、sp80、tw60、tw80和复合乳化剂对坎利酮增溶及转化率的影响,最终通过添加复合乳化剂,使转化率达到92.22%;CONTENTE M L等[10]通过赭曲霉富氧培养,并添加二甲基亚砜为坎利酮的助溶剂,使转化率>95%。
这些研究为坎利酮羟基化提供了理论依据,但液态发酵存在局限性:由于甾体类化合物不溶于水的特性会大大降低其在液态发酵液中的转化率,所以大部分研究都选择在液态发酵液中添加表面活性剂促进底物的溶解。但表面活性剂的添加对菌体的生长有一些影响,且实践证明,添加了表面活性剂之后的甾体底物并不能完全溶于发酵液[11],而是以小颗粒的形态存在,这样就会降低坎利酮的转化率。固态发酵则可以解决以上问题,同时,固态发酵提取产物时对于提取剂没有特殊要求,只需选择有机溶剂如无毒的乙醇即可,而液态发酵需要选择可以溶解11α-坎利酮却不与发酵液互溶的乙酸乙酯进行萃取,乙酸乙酯是低毒溶剂,会对人体和环境产生不良影响[12-13]。
本研究拟利用根霉(Rhizopussp.)UJS-0602对坎利酮进行特异性转化生成11α-羟基坎利酮,并优化固态发酵转化坎利酮的培养基的组成和培养条件。以期证明新型固态发酵转化坎利酮生成11α-羟基坎利酮的可能性,为后续的化学合成依普利酮提供必要的中间体。弥补了液态发酵转化方法中存在的不足:解决液态发酵转化过程中坎利酮甾体底物水不溶性的问题,提高转化率,并使得产物提取过程绿色安全。
1 材料与方法
1.1 材料与试剂
菌种为根霉(Rhizopussp.)UJS-0602:保藏于本实验室菌物柜。
发酵基质大米:市售;坎利酮(分析纯):浙江朗华制药有限公司;甲醇(色谱级):美国TEDIA公司;其他试剂均为市售分析纯。
保藏斜面为马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:取土豆200 g蒸煮后过滤得到浸出液,加入葡萄糖20 g并加水定容至1 000 mL。固态发酵转化培养基组成为大米基质20g,自来水20mL,底物添加量为10%(按发酵基质质量计)。
1.2 仪器与设备
LC-20AT高效液相色谱仪:日本Shimadzu公司;ZC-2102GZ光照恒温摇床:常州中诚仪器制造有限公司;BCD-206TS冰箱:青岛海尔股份有限公司;SW-CJ-1D型单人净化工作台:苏州净化设备有限公司;FA1004精密天平:上海天平仪器有限公司;XSP-BM-2CA生物显微镜:上海彼爱姆光学仪器制造有限公司;YX280A手提式不锈钢蒸汽灭菌器:上海三申医疗器械有限公司;DHG-9240A型电热恒温鼓风干燥箱:上海三发科学仪器有限公司。
1.3 实验方法
1.3.1 菌种培养及底物转化方法
斜面菌种制备:将根霉(Rhizopussp.)UJS-0602置于PDA培养基上,28℃环境下培养3~4 d,待培养斜面底部变成红色,表面长满金黄色孢子时,即得到生产斜面,于4℃冰箱冷藏保存,保藏时间在7 d以内。
孢子悬液制备:在无菌环境下,将无菌水加入生产斜面冲下孢子,加入无菌水计数调节孢子悬液浓度为108个/mL。
一级种子液培养:孢子悬浮液(108个/mL)以5%的接种量接入灭菌后的一级种子培养基中,在温度为28℃,转速为150 r/min的摇床中培养48 h后得到一级种子液。
固态发酵转化:将所得的一级种子液接入灭菌后的固态发酵培养基中,接种量为0.1 mL/g发酵基质,在培养基pH=7,培养温度为27℃的条件下发酵72~96 h后结束转化。
1.3.2 单因素试验
考察碳源种类(葡萄糖、果糖、蔗糖、麦芽糖、木糖、糊精、甘油)、碳源添加量(0.4%、0.6%、0.8%、1.0%、1.2%)、氮源种类(蛋白胨、玉米蛋白粉、豆粕、酵母膏、牛肉膏、(NH4)2SO4、KNO3)、氮源添加量(0.4%、0.6%、0.8%、1.0%、1.2%)、无机盐种类(FeSO4、CuSO4、MnSO4、MgSO4)、营养因子种类(甘氨酸、VB2、VB6、VB12、3,5-二硝基水杨酸)、营养因子添加量(0.2%、0.4%、0.6%、0.8%、1.0%)、料水比(1.0∶2、1.5∶2、1.0∶1、2.5∶2、3.0∶2(g∶mL))、底物添加量(10%、15%、20%、25%、30%)对底物转化率的影响。
1.3.3 正交试验
利用单因素试验筛选出的初始条件设计正交试验,即以转化率为考察指标,选取碳源添加量(A)、氮源添加量(B)、营养因子(C)、料水比(D)、底物添加量(E)为正交试验的5个因素,采用L16(45)正交试验优化转化培养基组成,正交试验因素与水平见表1。
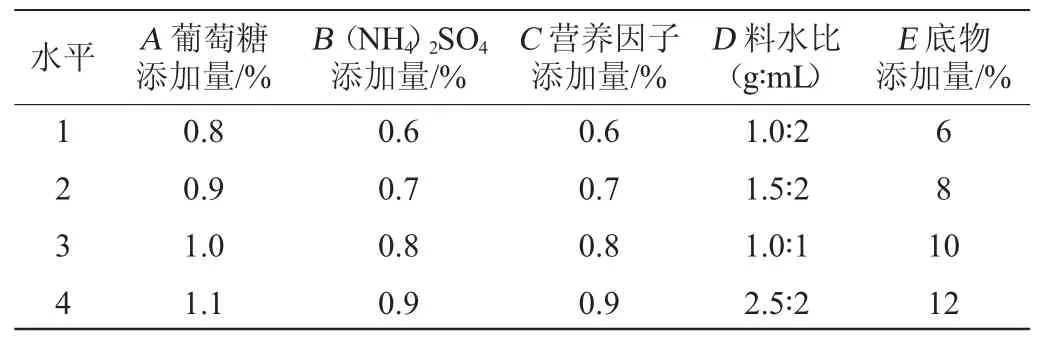
表1 培养基配方优化正交试验因素与水平Table 1 Factors and levels of orthogonal tests for medium formula optimization
1.3.4 提取及检测方法
取转化后的固态发酵培养基2 g,加入50 mL无水乙醇,于150 r/min摇床中振荡提取2 h后减压抽滤得到滤液,再使用无水乙醇反复冲洗滤渣3次后合并滤液,于60℃条件下减压蒸干,加入无水乙醇复溶后定容至50mL。用0.45μm有机滤膜过滤,供分析测定使用。
液相色谱柱为AgilentZORBAXEclipseXDB-C18(150mm×4.6 mm,5 μm);测定条件根据文献报道[14]作适当调整:以甲醇和水为流动相,利用甲醇溶液连续梯度洗脱,体积分数从60%升至80%,洗脱时间13.53 min;流速0.8 mL/min;检测波长280 nm;柱温:30℃;进样量5 μL。
取80℃烘干的11α-羟基坎利酮标品0.500 0 g,定容至100 mL,配制出5.0 g/L的母液,然后稀释配制成0.5 g/L、1.0 g/L、2.0 g/L、3.0 g/L、4.0 g/L、5.0 g/L不同浓度梯度的稀释液进行HPLC分析,绘制11α-羟基坎利酮的标准曲线,得到11α-羟基坎利酮质量浓度(Y)与吸收峰面积(X)的线性回归方程为Y=6935788.56X+10587476.56,根据产物峰面积计算产物含量从而得到产物转化率,其计算公式为:
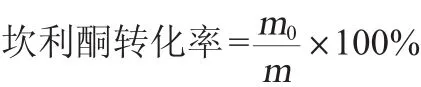
式中:m0为产物测定质量,g;m为底物投入质量,g。
2 结果与分析
2.1 碳源种类及水平的确定
碳源是C11α-羟基化过程中重要的营养和能源物质,为菌体提供生长所需的碳架和转化底物所需的代谢能,并为羟基化反应提供还原力,对甾体转化过程影响较大。本实验分别考察不同碳源对转化率的影响,结果见图1。

由图1可知,与未添加碳源的对照组相比,葡萄糖与果糖作为培养基碳源时底物的转化率较高,其中葡萄糖最有利于坎利酮的C11α-羟基化,转化率可达90.39%。不同微生物对碳源的偏好性不同,不同碳源会影响代谢活动中各种酶的表达。本研究得到的最佳碳源为葡萄糖的结论与赵玉金等[15-16]研究得到的结果一致。这可能是由于葡萄糖是可以被菌体快速利用的碳源,菌体需要利用碳源生长繁殖后产生次级代谢产物羟化酶来催化底物的羟基化反应,且葡萄糖价廉易得,广泛应用于工业化生产。因此选择葡萄糖作为转化培养基的最佳碳源。
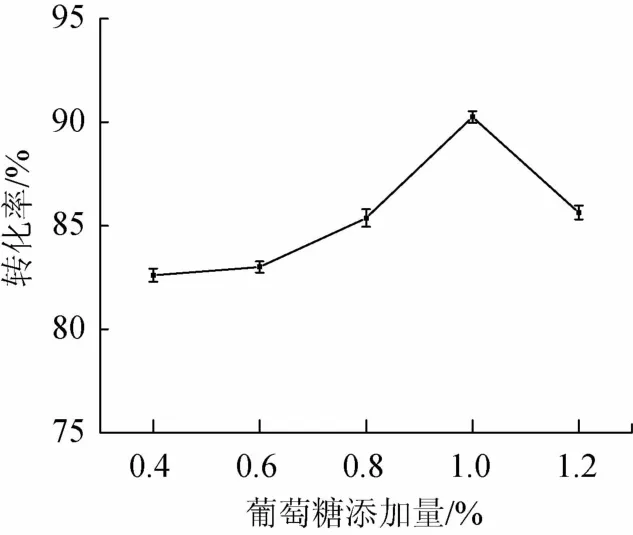
在培养基中分别添加0.4%、0.6%、0.8%、1.0%、1.2%不同比例的葡萄糖,考察葡萄糖添加量对转化率的影响,结果如图2所示。
由图2可知,当葡萄糖添加量为1.0%时,转化率最大为90.25%。这是由于葡萄糖为速效碳源,随着葡萄糖添加量增加,提供的能量充足,而当葡萄糖添加量>1.0%后,菌体代谢了过多葡萄糖,产生的热量在固态发酵培养基中难以快速挥发,一定程度上影响了菌体的生长,继而影响了菌体对底物的转化。因此选择葡萄糖添加量1.0%为宜。
2.2 氮源种类及水平的确定
氮源是构成菌体细胞的物质,如核酸、氨基酸和蛋白质等,并帮助细胞合成酶。涉及到酶的生物转化需要合适足量的氮源。分别考察不同氮源对转化率的影响,结果见图3。

图3 不同氮源对转化率的影响Fig.3 Effects of different nitrogen sources on conversion ratio
由图3可知,(NH4)2SO4为氮源时,转化率明显高于对照组。因此选择(NH4)2SO4为最佳氮源。在相关研究中[7,17],微生物羟基化坎利酮的最佳pH均为酸性,(NH4)2SO4可以为转化提供弱酸性环境,便于菌体细胞利用。因此选择(NH4)2SO4作为转化培养基的最佳氮源。
在培养基中分别添加0.4%、0.6%、0.8%、1.0%、1.2%不同比例的(NH4)2SO4,考察(NH4)2SO4添加量对转化率的影响,结果如图4所示。
由图4可知,硫酸铵添加量在0.4%~0.8%时转化率不断升高,到0.8%时达到最大,之后转化率略有降低。这说明当(NH4)2SO4添加量为0.8%时可以为菌体生长提供最适的弱酸性环境,转化率最高为91.57%,当(NH4)2SO4含量继续升高时,菌体的代谢途径可能发生改变,产生用于促进底物羟基化的羟化酶含量减少,转化率降低。因此选择(NH4)2SO4添加量0.8%为宜。
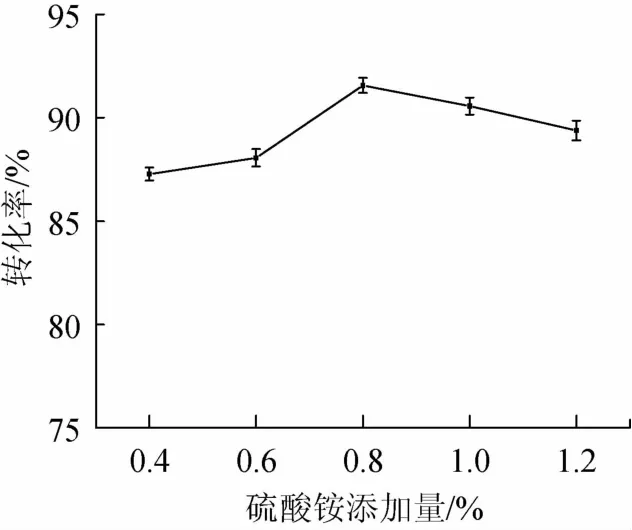
图4 不同硫酸铵添加量对转化率的影响Fig.4 Effects of ammonia sulfate addition on conversion ratio
2.3 无机盐种类的确定
考察不同种类无机盐对转化率的影响。结果见图5。
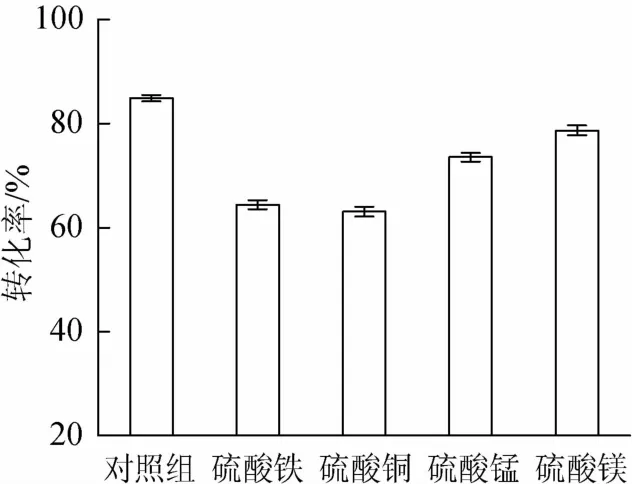
图5 不同无机盐对转化率的影响Fig.5 Effects of different inorganic salts on conversion ratio
由图5可知,培养基中添加无机盐对转化率的提高没有作用。微生物在生长繁殖及合成产物的过程中需要无机盐中微量元素作为活性物质合成中的调节物。在产酶真菌酶活研究[18]中提到,无机盐一般会在低浓度时促进微生物生长及产物合成,高浓度时则表现抑制作用:当无机盐含量为0.5%~1.0%时,菌体产酶量可以稳定在较高水平,但当含量继续上升时,产酶量表现为持续下降。坎利酮的转化也是通过羟化酶的参与而完成的。本研究采用的固态发酵培养基是复合培养基,成分复杂,且此时无机盐的额外添加量已经达到了1.0%,已经表现出对产物合成的抑制作用,因此转化培养基中不需要再额外添加无机盐。
2.4 营养因子种类及水平的确定
营养因子有助于菌体细胞构成成分的合成。考察了不同种类营养因子对转化率的影响。结果见图6。
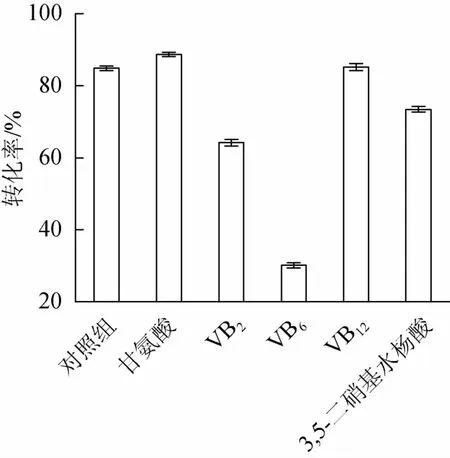
图6 不同营养因子对转化率的影响Fig.6 Effects of different nutritional factors on conversion ratio
由图6可知,培养基中添加甘氨酸可以显著提高转化率。有研究表明,甘氨酸的存在可能会引起细胞壁结构的改变,导致酶等胞内容物更好地被动分泌至胞外[19],从而促进酶对底物的催化,提高转化率。因此选择甘氨酸作为转化培养基的最佳营养因子。
在培养基中分别添加0.2%、0.4%、0.6%、0.8%、1.0%的甘氨酸,考察甘氨酸添加量对转化率的影响,结果如图7所示。
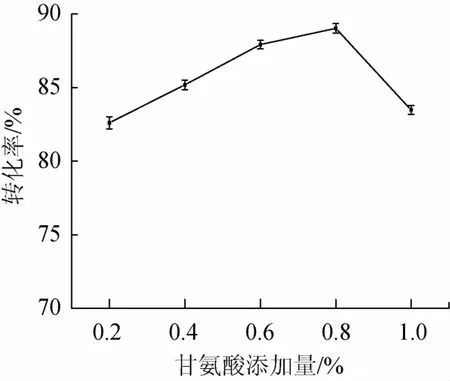
图7 不同甘氨酸添加量对转化率的影响Fig.7 Effects of different glycine addition on conversion ratio
由图7可知,甘氨酸添加量在0.8%时转化率最高为89.02%,说明在该添加量条件下,甘氨酸可以最大限度促进胞内酶的被动运输,又不至于对菌体细胞壁产生破坏,影响菌体生长代谢。因此选择甘氨酸添加量0.8%为宜。
2.5 培养基水分含量对转化率的影响
考察基质料水比对转化率的影响。结果见图8。
由图8可知,当发酵基质料水比为1.0∶1(g∶mL)时,转化率最大为86.76%,明显高于其余各组。这是由于水分是发酵过程的主要媒介,是微生物生长必不可少的条件之一,水分含量太低会导致基质变干,微生物生长困难甚至死亡,转化率会受到很大影响;而当含水量太高则导致发酵基质透气性下降,影响菌体生长繁殖,同时发酵产生的热量难以散发,基质温度升高,增加了杂菌污染的危险,用于转化的根霉生长受到抑制,转化率降低。因此当料水比为1.0∶1(g∶mL)时,对于微生物转化是最有利的。
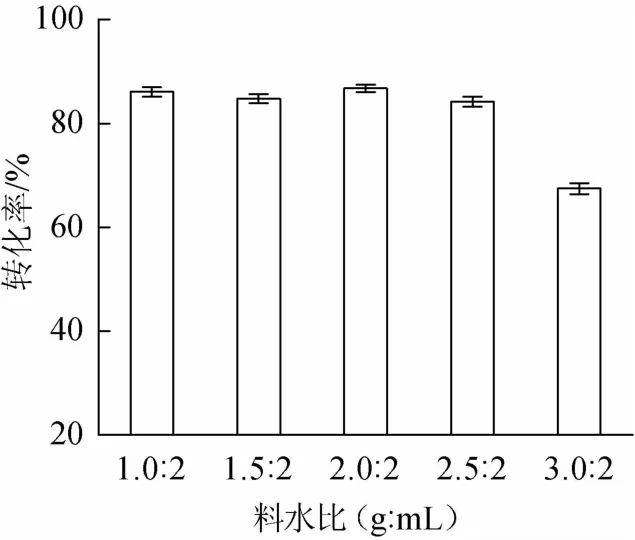
图8 培养基水分含量对转化率的影响Fig.8 Effect of moisture content of medium on conversion ratio
2.6 底物添加量对转化率的影响
考察不同底物添加量(10%、15%、20%、25%、30%)对转化率的影响。结果见图9。

图9 底物添加量对转化率的影响Fig.9 Effect of substrate addition on conversion ratio
由图9可知,当底物添加量为10%时,转化率最高可达82.88%。且当底物添加量逐渐增大时,转化率不断降低。这是由于过高的甾体化合物浓度对微生物具有一定毒害作用,会抑制其酶的活力[20]。CONTENTE M L等[10]也在坎利酮液态发酵的转化研究中表明,只有当底物浓度保持在5~6 g/L时才会达到高转化率,高浓度底物不仅会限制转化率,也会由于羟基化发生的碳位不同而产生副产物。因此选择底物添加量10%为宜。
2.7 固态发酵转化培养基优化正交试验
基于转化培养基中各组分的单因素试验结果,以转化率为指标,选定葡萄糖、(NH4)2SO4、甘氨酸、料水比、底物添加量进行正交试验,得到转化培养基的最佳组成条件。正交试验设计及结果见表2,方差分析见表3。
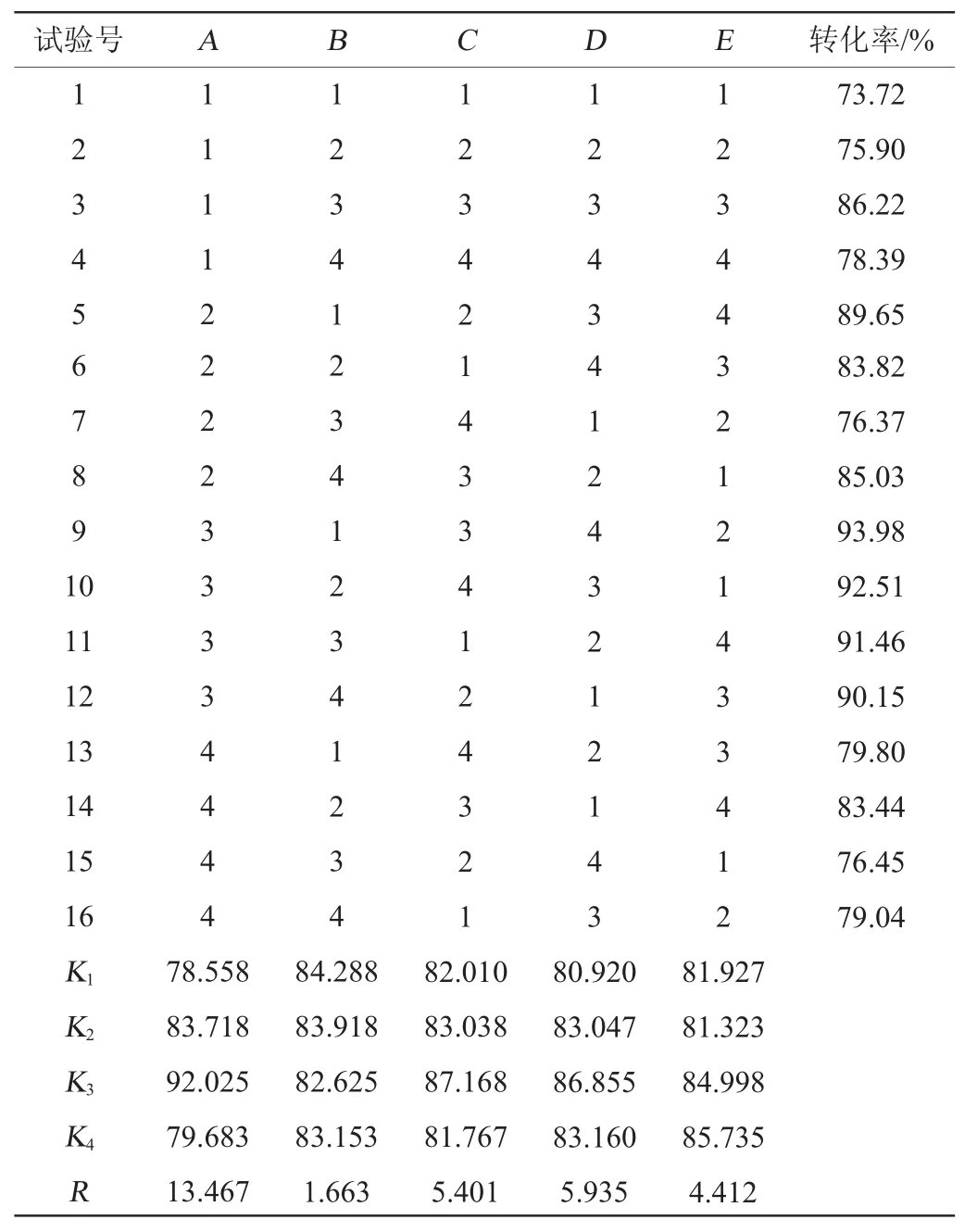
表2 培养基配方优化正交试验设计及结果Table 2 Design and results of orthogonal tests for medium formula optimization
由表2可知,各因素影响转化率的主次顺序为A>D>C>E>B,即葡萄糖添加量对转化率的影响最大,其次为料水比、甘氨酸添加量和底物添加量,氮源添加量对转化率影响最小。从K值可知,最优发酵培养基配方组合为A3B1C3D3E4,即培养基组成为葡萄糖1.0%,硫酸铵0.6%,甘氨酸0.8%,料水比为1.0∶1(g∶mL),底物添加量为12%。在此条件下进行验证试验,最终转化率可达94.21%。

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal tests results
由表3可知,葡萄糖和甘氨酸的添加量以及培养基料水比对转化率的影响显著(P<0.05),其余因素对实验结果影响不显著(P>0.05)。
3 结论
对根霉转化坎利酮生成11α-羟基坎利酮的固态发酵转化条件进行了条件优化,优化后的坎利酮发酵转化条件为:葡萄糖1%,硫酸铵0.6%,甘氨酸0.8%,料水比为1.0∶1(g∶mL),底物添加量为12%。经验证试验,在最佳工艺条件下,转化率可达到94.21%,高于前期研究。本研究证明了固态发酵转化坎利酮的可行性,且转化率高于液态发酵时坎利酮的转化率,同时极大简化了底物转化和产物提取过程,解决了液态发酵对于甾体底物溶解性的局限,具有应用前景。
[1]DASGUPTA A,TSO G,WELLS A.Effect of spironolactone,potassium canrenoate and their common metabolite canrenone on serum digoxin measurement by digoxin III,a new digoxin immunoassay[J].Ther Drug Monit,2008,30(6):744-747.
[2]GEORGIANOS P I,VAIOS V,ELEFTHERIADIS T,et al.Mineralocorticoid antagonists in ESRD:an overview of their efficacy and safety[J].Curr Vasc Pharmacol,2017,15(6):599-606.
[3]杜 刚,王忠诚,杨红梅,等.桃拟茎点霉对孕酮的生物转化研究[J].中国酿造,2015,34(12):93-96.
[4]王 森.固定化黑根霉进行甾体C11α羟基化的研究[D].杭州:浙江工业大学,2012.
[5]KOLET S P,HALDAR S,NILOFERJAHAN S,et al.Mucor hiemalis,mediated 14α-hydroxylation on steroids:In vivo,andin vitro,investigations of 14α-hydroxylase activity[J].Steroids,2014,85:6-12.
[6]RESTAINO O F,MARSEGLIA M,DE C C,et al.Biotechnological transformation of hydrocortisone to 16α-hydroxy hydrocortisone by Streptomyces roseochromogenes[J].Appl Microbiol Biot,2014,98(3):1291-1299.
[7]刘 晓,刘逸寒,别松涛,等.赭曲霉的高密度培养对坎利酮转化的影响[J].生物技术,2011,21(5):82-87.
[8]黄达明,崔鹏景,张志才,等.根霉转化坎利酮的培养基优化[J].现代食品科技,2013,29(2):345-348.
[9]张晓丽,张 莉,丁保妹,等.乳化剂对坎利酮增溶及生物转化的影响[J].上海应用技术学院学报:自然科学版,2012,12(2):134-136.
[10]CONTENTE M L,GUIDI B,SERRA I,et al.Development of a highyielding bioprocess for 11-α hydroxylation of canrenone under conditions of oxygen-enriched air supply[J].Steroids,2016,116:1-4.
[11]ZENG A G,PANG X L,WU N,et al.Solubility of daidzein in propylene glycol plus water cosolvent mixtures[J].Fluid Phase Equilibria,2014,366(12):127-133.
[12]QAZI N S.Acute and chronic toxicity study of ethyl acetate fraction of Caralluma tuberculatain mice[J].Int J Pharmacol Clin Sci,2013,2(4):99-104.
[13]KIM S H,RYU D S,LEE H S,et al.Acute oral toxicity of the ethyl acetate fraction ofOrostachys japonicusin mice.[J].Pharmaceut Biol,2014,52(10):1345-1350.
[14]HUANG D M,ZHANG T Z,CUI F J,et al.Simultaneous identification andquantificationofcanrenoneand11-α-hydroxy-Canrenone byLC-MS and HPLC-UVD[J].Biomed Res Int,2011,2011(2011):917232.
[15]赵玉金,杜连祥.深层培养中赭曲霉菌球催化坎利酮11α羟化反应条件的研究[J].天津科技大学学报,2006,21(3):8-11.
[16]薛海龙.黑根霉葡萄糖-6-磷酸脱氢酶基因工程菌构建及其在甾体C(11)α-羟基化中的应用[D].杭州:浙江工业大学,2013.
[17]牟晓然.赭曲霉制备心血管药物C11α-羟基化坎利酮培养条件的研究[D].长春:吉林大学,2008.
[18]潘乐毅.一株产纤维素酶真菌的筛选鉴定、酶学性质和发酵产酶条件的研究[D].长沙:湖南农业大学,2012.
[19]郭 森,吴 丹,陈 晟,等.重组大肠杆菌产角质酶-CBM摇瓶发酵优化及分泌表达研究[J].中国生物工程杂志,2011,35(9):55-61.
[20]DONOVA M V,EGOROVA O V.Microbial steroid transformations:current state and prospects[J].Appl Microbiol Biot,2012,94(6):1423-1447.
