超声心动图二维斑点追踪成像与心脏核磁共振钆延迟增强对心肌淀粉样变性检测的比较
2018-01-31冀晋方理刚方全朱文玲
冀晋,方理刚,方全,朱文玲
心肌淀粉样变性的患者心脏核磁共振(CMR)表现为心肌透壁性或心内膜下的钆延迟增强显像,最常见的表现为心肌弥漫受累,也可表现为颗粒状或条带状增强[1],其在心肌淀粉样变性中具有很高的诊断价值[2],超声心动图二维斑点追踪成像(2D-STE)技术可评估心室壁各个节段的心肌功能[3]。本研究通过分析同一例患者2D-STE 和CMR钆延迟增强显像,初步比较两种无创诊断方法探查心肌淀粉样变性的价值。
1 资料与方法
研究对象:本研究为单中心、回顾性研究。入选2006-09至2015-03期间在北京协和医院住院、诊断为心肌淀粉样变性并接受CMR和超声心动图检查有标准多切面录像的患者10例。8例为轻链型淀粉样变(AL型),其中1例合并多发性骨髓瘤,另2例未分型。心肌淀粉样变性的诊断依据[4]:心内膜活检或者其他组织活检证实淀粉样物质沉积且超声心动图或CMR有心肌受累表现。6例心肌活检,另4例其他器官活检提示淀粉样物质沉积在细胞间质,刚果红染色阳性,偏振光下呈现出苹果绿双折光。排除既往有糖尿病、心肌梗死、大量饮酒的患者。
临床资料收集:一般资料包括性别、年龄、体重指数(BMI)、入院时纽约心脏协会(NYHA)心功能分级、收缩压、舒张压、B型利钠肽(BNP)及心电图数据。心电图假性梗死波形定义为≥2个相邻或相关导联可见病理性Q波;肢体导联低电压定义为QRS波电压≤0.5 mV。
超声心动图检查:应用GE vivid E7及Vivid E9超声心动图仪,经胸采集多切面图像,探头频率1.7~3.4 MHz,图像原始数据数字化存储,依据美国超声心动图协会心腔定量测量指南进行参数测量[5]。左心室射血分数(LVEF)采用Simpson双平面法。所有左心室心肌应变数据的测量采用GE公司EchoPAC(version 112版本)工作站软件完成。对每位患者均采集心尖三个切面,即心尖四腔、两腔及左心室长轴切面,每一个切面均在收缩末期由人工描绘心内膜,系统将自动生成感兴趣的心肌范围,可人工调整该范围的宽度和长度,保证系统追踪的范围与实际心肌范围一致[6]。软件自动将每一个切面的左心室心肌分成6节段,自动一帧帧追踪感兴趣范围内的心肌运动,追踪完成后将生成每一节段的应变曲线,从该曲线可以测定每一节段及心室壁整体长轴峰值应变数据。在心尖四腔心切面人工描绘右心室心内膜,得到右心室侧壁长轴峰值应变数据。参考美国超声心动图协会/欧洲超声心动图协会共识,定义正常的收缩期长轴应变值为≥18%[7]。
CMR检查:采用GE Signal Excite HD 1.5T超导型核磁扫描仪,对比剂为钆喷替酸葡甲胺(Gd-DTPA),静脉注射对比剂完毕后8 min进行延迟心肌灌注CMR扫描,分析延迟钆增强显像在心肌分布的部位。超声心动图和CMR对心室的分段采用统一标准[8]。
统计学方法:采用SPSS 19.0 统计软件进行数据统计。连续变量各组数据进行正态性检验,符合正态分布计量资料用±s表示。二尖瓣舒张早期与舒张晚期峰值血流速度比值(E/A)不符合正态分布,使用中位数(四分位数) 表示。
2 结果
2.1 10例患者的基本资料
10例患者年龄43~75(55.1±11.3)岁,男女各5 例,BMI为(22.4±1.6)kg/m2,收缩压(97.7±15.8)mmHg(1 mmHg=0.133 kPa),其中2例患者入院时收缩压低于90 mmHg,舒张压(65.1±10.4)mmHg,入院时NYHA心功能Ⅱ级6例,NYHA心功能Ⅰ级和NYHAⅢ级各2例。均为窦性心律,心率(88.9±17.8)次 /min。BNP 为 168~1678 ng/ml(参考范围<100 ng/ml)。10例患者中,AL型8例(M蛋白分别为λ未分型5例、IgGλ2例、IgAλ1例),另2例未分型。6例患者合并其他组织或器官受累。
心电图检查:10例患者均进行心电图检查,一度房室传导阻滞2例,完全性左束支传导阻滞2例,完全性右束支传导阻滞1例,8例患者肢体导联低电压,6例R波进展不良。
超声心动图常规参数结果(表1):平均LVEF(41±11.29)%,其中LVEF<50%占8例;双心房增大7例;室间隔和左心室后壁的平均厚度分别为(12.5±2.8)mm和(13.5±3.3)mm;左心室肥厚7例;房间隔的平均厚度为(8.4±0.8) mm;10例患者均无左心室或右心室增大;三尖瓣环平面位移(TAPSE)为(11.5±4.4)mm;E/A 为 1.8(1.3,2.5),二尖瓣舒张早期峰值血流速度与二尖瓣瓣环平均速度比值(E/e’)为26.3±9.8,限制性舒张障碍8例;少量心包积液5例,中量心包积液1例。
2.2 2D-STE与CMR钆延迟增强比较
2D-STE测定10例患者的心室游离壁的收缩期长轴峰值应变值见表2。从表中可见,除1例患者外,余9例患者收缩期长轴应变值均明显降低。收缩期长轴峰值应变异常与CMR钆延迟强化阳性室壁比较见表3,从表中可见,心肌淀粉样变性CMR钆延迟强化分布特点为可为局部或弥漫性,心内膜下或全层性。

表1 10例患者的超声心动图常规参数结果

表2 10例患者的左心室及右心室游离壁收缩期长轴峰值应变值(%)

表3 10例患者的2D-STE收缩期长轴峰值应变异常与CMR钆延迟强化阳性心室壁比较
图1为病例6的 2D-STE长轴应变牛眼图,提示左心室壁各节段收缩期长轴应变均下降。图2为病例6的CMR钆延迟显像,箭头所指为钆延迟强化部位。
10例患者中CMR均有心室延迟强化阳性,而2D-STE显示9例存在心室收缩期长轴应变降低,1例正常,因此,两种技术对发现心室肌受累的总符合率为90%。进一步分析,9例2D-STE异常的患者有8例左心室及右心室游离壁收缩期长轴峰值应变均减低,1例左心室收缩期长轴峰值应变减低。比较2种显像技术,9例(除病例9外)左心室收缩期长轴应变异常的患者,CMR左心室均有延迟强化。4例(病例1、4、6、10)患者同时存在双心室收缩期长轴峰值应变异常与CMR延迟强化,4例(病例2、3、5、7)患者CMR未提示右心室受累但收缩期长轴应变峰值已经出现异常,1例(病例8)患者CMR提示室间隔延迟强化,而左、右心室收缩期长轴峰值应变均下降,另有1例(病例9)患者CMR提示异常,2D-STE提示收缩期长轴应变峰值正常。
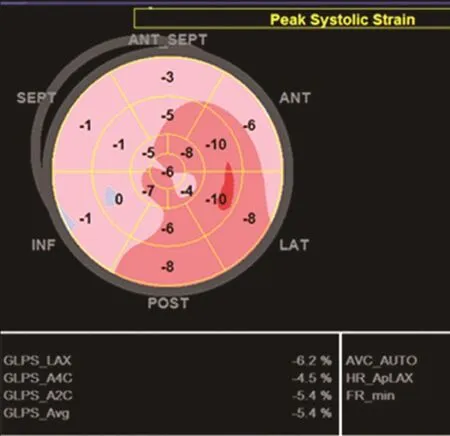
图1 病例6超声心动图二维斑点追踪成像收缩期长轴应变牛眼图

图2 病例6心脏核磁共振钆延迟显像(箭头所指为钆延迟强化部位)
3 讨论
核磁共振具有高度的组织学特异性及可重复性,对心肌疾病诊断有较高的敏感性及特异性,钆延迟增强显像在心肌淀粉样变性中具有很高的临床应用价值。Maceira等[9]对29例经心内膜活检证实为心肌淀粉样变性的患者进行核磁共振检查,发现69%患者心内膜出现弥漫环形延迟强化。Perugini等[10]报道76%心肌淀粉样性患者出现心肌延迟强化,延迟强化可局限或弥漫,见于心内膜下或跨心肌壁。病理学研究表明,钆延迟显像区域为淀粉样物质沉积区域,两者相关性良好。Vogelsberg等[11]对33例临床疑诊心肌淀粉样变性的患者同时进行CMR和心内膜心肌活检,研究表明,心脏钆延迟显像阳性诊断心肌淀粉样变性的敏感性、特异性、阳性预测值和阴性预测值分别为80%、94%、92%和85%。本研究中,10例患者CMR示心室肌均有不同程度和不同程度的钆延迟增强,且分布以心内膜下和整层心肌壁为特征,有的患者心房或房室瓣亦有延迟强化,表明CMR对于心脏淀粉样变性的诊断优势,且具有很高的阳性率,与以往的研究相符。
心肌应变反应心肌的形变能力,2D-STE技术测定的心肌应变可反映长轴、圆周及径向方向左心室心肌收缩能力[7],是一项逐渐为临床研究所广泛应用的可靠的新技术。系列的临床研究证实,2D-STE技术可通过观察局部心肌的运动变化来诊断系统性淀粉样变患者是否存在心肌受累[12-15],也有学者将此技术应用在心肌淀粉样变性与其他疾病所致的左心室肥厚的鉴别及心肌淀粉样变性的预后分析中,显示出很好的价值[6,16]。从超声心动图表现看,本研究中多数患者的LVEF降低或呈限制型舒张功能减低,右心室收缩功能亦多数减低,左、右心室室壁、房间隔均有不同程度增厚,心电图肢体导联低电压及R波进展不良,表明这些患者心肌淀粉样程度已较明显。除外病例9,其他患者室壁各节段长轴应变均明显降低,阳性率达90%,表明2D-STE技术测定的心肌应变能较好地反映淀粉样变性患者心肌受累,与心电图和其他超声心动图征象结合,将提高淀粉样变性心肌受累的诊断能力。
Smedema等[17]报道一例64岁老年女性心肌淀粉样变性患者进行核磁共振检查及心脏超声组织多普勒测定应变,发现室间隔、左心室前壁的部分心肌组织多普勒长轴应变下降,与CMR钆延迟显像的部位基本一致。本研究在心肌淀粉样变性患者中将2D-STE与CMR进行比较,9例左心室收缩期长轴峰值应变异常的患者,CMR左心室均有延迟强化,表明对于左心室心肌淀粉样变性,2D-STE和CMR的总符合率高,为90%,但双心室受累的符合率为50%,亦表明两显像技术对右心室淀粉样变性的符合率只为50%。4例(病例2、5、7、8)患者CMR未提示受累的室壁(主要是右心室壁)而2D-STE却出现异常,推测可能是由于淀粉样物质在心肌细胞间质的少量沉积首先引起心肌细胞的功能改变,而淀粉样物质沉积达到一定程度才会出现CMR延迟强化,推测2D-STE在诊断心肌淀粉样变性的受累心肌范围中可能较CMR更敏感,而病例9患者CMR异常而2D-STE正常,不除外与中等量心包积液的影响有关。因此,2D-STE和CMR各有优势,可相互补充。
本研究的局限性为回顾性观察研究,病例数较少,需要进一步扩大样本对不同程度淀粉样变心肌病受累患者进行前瞻性研究。
综上,2D-STE与CMR钆延迟显像技术对发现淀粉样变性心室肌受累均有很高的阳性率,两者总符合率高。两种技术对心肌淀粉样变性左心室受累的诊断具有很好的一致性,2D-STE对右心室受累的诊断可能较CMR更敏感。
[1]Syed IS, Glockner JF, Feng D, et al. Role of cardiac magnetic resonance imaging in the detection of cardiac amyloidosis[J]. JACC Cardiovascular imaging, 2010, 3(2): 155-164. DOI: 10.1016/j.jcmg.2009.09.023.
[2]Ruberg FL, Appelbaum E, Davidoff R, et al. Diagnostic and prognostic utility of cardiovascular magnetic resonance imaging in light-chain cardiac amyloidosis[J]. Am J Cardiol, 2009, 103(4): 544-549. DOI:10.1016/j.amjcard.2008.09.105.
[3]朱孔博, 程中伟, 田庄, 等. 心脏核磁共振在心肌淀粉样变中的诊断价值[J]. 中华心血管病杂志, 2011, 39(10): 915-916.DOI:10.3760/ema.J.issn.0253-3758.2011.10.009.
[4]Falk RH. Diagnosis and management of the cardiac amyloidoses[J].Circulation, 2005, 112(13): 2047-2060. DOI: 10.1161/CIRCULATIONAHA.104.489187.
[5]Lang RM, Bierig M, Devereux RB, et al. Recommendations for chamber quantification: a report from the American Society of Echocardiography's Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology[J]. J Am Soc Echocardiogr, 2005,18(12): 1440-1463. DOI: 10.1016/j.echo.2005.10.005.
[6]Sun JP, Stewart WJ, Yang XS, et al. Differentiation of hypertrophic cardiomyopathy and cardiac amyloidosis from other causes of ventricular wall thickening by two-dimensional strain imaging echocardiography[J]. Am J Cardiol, 2009, 103(3): 411-415. DOI:10.1016/j.amjcard.2008.09.102.
[7]Mor-Avi V, Lang RM, Badano LP, et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications endorsed by the Japanese Society of Echocardiography[J].J Am Soc Echocardiogr, 2011, 24(3): 277-313. DOi: 10.1016/j.echo.2011.01.015.
[8]Cerqueira MD, Weissman NJ, Dilsizian V, et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the cardiac imaging committee of the council on clinical cardiology of the American Heart Association[J]. Circulation, 2002, 105(4): 539-542.DOi:10.1161/hc0402.102975.
[9]Maceira AM, Joshi J, Prasad SK, et al. Cardiovascular magnetic resonance in cardiac amyloidosis[J]. Circulation, 2005, 111(2): 186-193. DOI:10.1161/01.CIR.0000152819.97857.9D.
[10]Perugini E, Rapezzi C, Piva T, et al. Non-invasive evaluation of the myocardial substrate of cardiac amyloidosis by gadolinium cardiac magnetic resonance[J]. Heart, 2006, 92(3): 343-349. DOI: 10.1136/hrt.2005.061911
[11]Vogelsberg H, Mahrholdt H, Deluigi CC, et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis:noninvasive imaging compared to endomyocardial biopsy[J]. J Am Coll Cardiol, 2008, 51(10): 1022-1030. DOI: 10.1016/j.jacc.2007.10.049.
[12]Liu D, Hu K, Niemann M, et al. Impact of regional left ventricular function on outcome for patients with AL amyloidosis[J]. PLoS One,2013, 8(3): e56923. DOI: 10.1371/journal.pone.0056923.
[13]Phelan D, Collier P, Thavendiranathan P, et al. Relative apical sparing of longitudinal strain using two-dimensional speckle-tracking echocardiography is both sensitive and specific for the diagnosis of cardiac amyloidosis[J]. Heart, 2012, 98(19): 1442-1448. DOI:10.1136/heartjnl-2012-302353.
[14]Liu D, Niemann M, Hu K, et al. Echocardiographic evaluation of systolic and diastolic function in patients with cardiac amyloidosis[J]. Am J Cardiol, 2011, 108(4): 591-598. DOI: 10.1016/j.amjcard.2011.03.092.
[15]Kusunose K, Yamada H, Iwase T, et al. Cardiac magnetic resonance imaging and 2-dimensional speckle tracking echocardiography in secondary cardiac amyloidosis[J]. Circ J, 2010, 74(7): 1494-1496.
[16]Koyama J, Falk RH. Prognostec significance of strain Doppler imaging in light-chain amyloidosis[J]. JACC Cardiovascular imaging, 2010,3(4): 333-342. DOI: 10.1016/j.jcmg.2009.11.013.
[17]Smedema JP, James R. Tissue Doppler imaging and contrast-enhanced cardiac magnetic resonance in primary cardiac amyloidosis[J]. Eur J Echocardiogr, 2009, 10(8): 984-986. DOI: 10.1093/ejechocard/jep105.
