31例呼吸疾病和(或)缺氧合并肺动脉高压患者的临床特征分析
2018-01-31高柳柳志红赵智慧罗勤赵青马秀平张洪亮王勇黄智伟唐毅禹雪金旗
高柳,柳志红,赵智慧,罗勤,赵青,马秀平,张洪亮,王勇,黄智伟,唐毅,禹雪,金旗
肺动脉高压是以肺血管阻力进行性升高为特点,最终导致右心衰竭,甚至死亡的一大类疾病,其中特发性肺动脉高压患者通常病情进展迅速,预后较差,需接受价格昂贵的靶向药物治疗。而呼吸疾病和(或)缺氧相关肺动脉高压目前属于第Ⅲ大类肺动脉高压[1],若能对因治疗改善缺氧后则预后较好。由于肺动脉高压的临床表现和体征与引起缺氧的呼吸疾病非常相似,难以鉴别,如阻塞性睡眠呼吸暂停低通气综合征(OSAHS),若不做睡眠呼吸监测将难以获得诊断,而缺氧引起的肺动脉高压程度一般较轻[2],因此不易引起重视,极易误诊、误治。我们对比了呼吸疾病和(或)缺氧合并严重肺动脉高压患者与严重特发性肺动脉高压患者的临床特点和治疗探索,以帮助临床医生更好的对此类患者进行识别和治疗。
1 资料与方法
研究对象:连续纳入2016-01至2017-01期间于阜外医院肺血管病中心住院、明确诊断为合并呼吸疾病和(或)缺氧的严重肺动脉高压患者31例(缺氧相关肺动脉高压组),以及严重特发性肺动脉高压患者41例(特发性肺动脉高压组)。所有患者入院后均行右心导管检查以明确肺动脉高压的诊断和指导治疗。呼吸疾病和(或)缺氧合并严重肺动脉高压被定义为右心导管检查证实的静息状态下平均肺动脉压(mPAP)≥ 35 mmHg(1 mmHg=0.133 kPa)[3],经动脉血气分析、胸片、肺部计算机断层摄影术(CT)或睡眠呼吸监测证实存在缺氧及睡眠呼吸疾病和明显低氧血症,且排除其他可解释患者肺动脉高压的病因。特发性肺动脉高压的诊断为排除其他肺动脉高压的病因后做出,且入选患者均为经右心导管检查证实静息状态下mPAP≥35 mmHg以和缺氧相关肺动脉高压组匹配。所有临床表现为失代偿性右心衰竭的患者均被排除。
资料收集:患者的一般情况包括年龄、性别、体重指数(BMI)、血压、心率和临床主诉等均被记录。呼吸疾病和(或)缺氧相关疾病的诊断均根据最新指南所做出[4-6]。辅助检查包括患者入院后的血气分析、超声心动图、6分钟步行距离(6MWD)、睡眠呼吸监测和N末端B型利钠肽原(NT-proBNP)测定结果。右心导管检查获取侵入性的肺血流动力学数据 [包括 mPAP、肺血管阻力(PVR)、心指数(CI)、平均右心房压(mRAP)和肺毛细血管楔压(PCWP)]。患者的治疗包括根据右心导管结果接受的规范的肺血管扩张药物、利尿剂、口服抗凝药物治疗、氧疗及对症治疗。
统计学分析:所有数据以SPSS19.0软件进行分析。计数资料以均数±标准差(±s)表示,计量资料以百分比(%)表示。连续性变量符合正态分布的两独立样本均数比较以两独立样本t检验进行分析,分类变量使用卡方检验进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的一般特点和临床表现比较(表1)
缺氧相关肺动脉高压组患者的平均年龄为(45.55±14.43)岁,其中64.52%(20/31)的患者为女性;平均BMI为(25.58±4.83) kg/m2,平均血压为(117.58±12.12)/(79.26±8.76) mmHg,平均心率为(86.32±13.47)次/min;平均年龄、平均BMI和平均血压均高于特发性肺动脉高压组(P<0.05);大部分患者为世界卫生组织(WHO)功能分级Ⅱ或Ⅲ级;患者的主要临床表现包括气促、胸痛、咯血、心悸、黑矇、晕厥和外周水肿等。特发性肺动脉高压组患者咯血的表现多于缺氧相关肺动脉高压组患者,但总的来说,两组患者的临床表现多无明显差异。
2.2 缺氧病因分析
缺氧相关肺动脉高压组中,20例为单纯OSAHS合并肺动脉高压患者,其中3例为重度OSAHS患者。余11例患者中,3例为慢性阻塞性肺疾病(COPD)合并肺动脉高压患者,1例为OSAHS合并神经纤维瘤病患者,1例为OSAHS合并肥胖患者,1例为OSAHS合并COPD患者,1例为COPD合并肺纤维化患者,4例为未能确定病因的呼吸系统疾病患者。
2.3 常规辅助检查和右心导管检查结果(表2)
缺氧相关肺动脉高压组患者的平均动脉血氧分压明显低于特发性肺动脉高压组。睡眠呼吸监测提示缺氧相关肺动脉高压组的睡眠呼吸暂停指数(AHI)更高,夜间平均血氧饱和度更低。相较特发性肺动脉高压组患者,缺氧相关肺动脉高压组患者的超声心动图提示左心房和左心室内径更大,NT-proBNP浓度更高,而6分钟步行试验距离更短。两组患者的右心导管检查指标无明显差异。
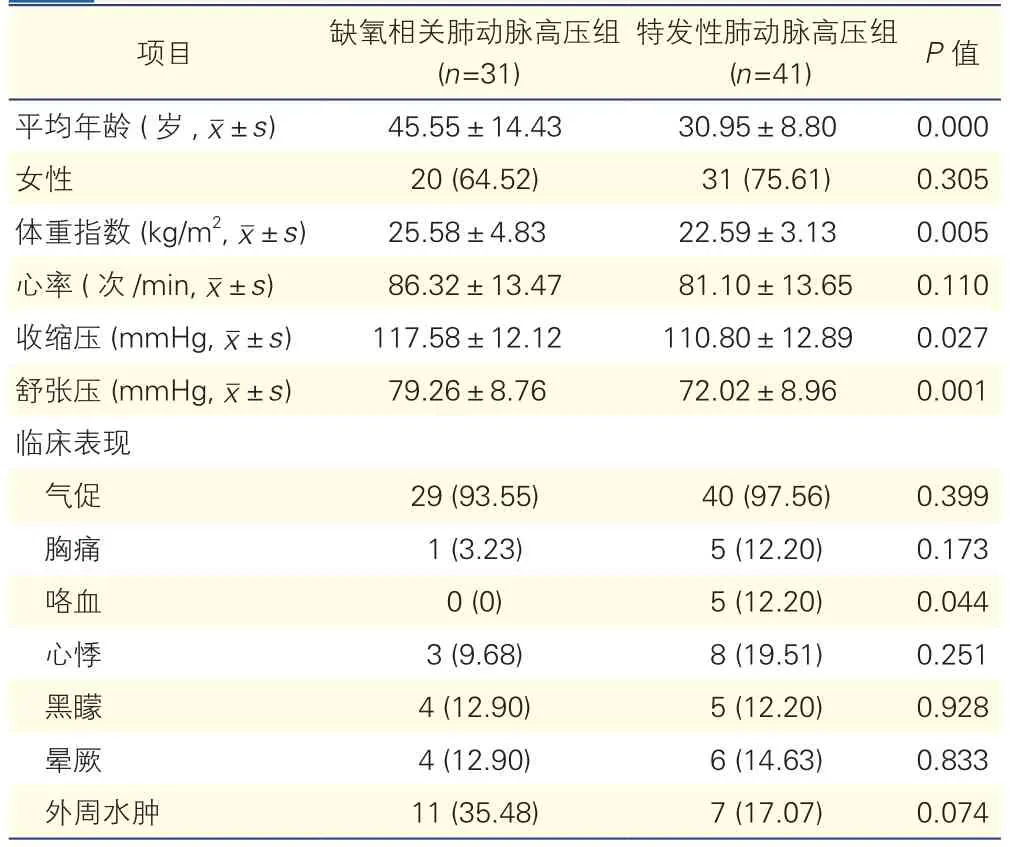
表1 两组患者的一般特点和临床表现比较[例(%)]
表2 两组患者的常规辅助检查和右心导管检查结果比较(±s)
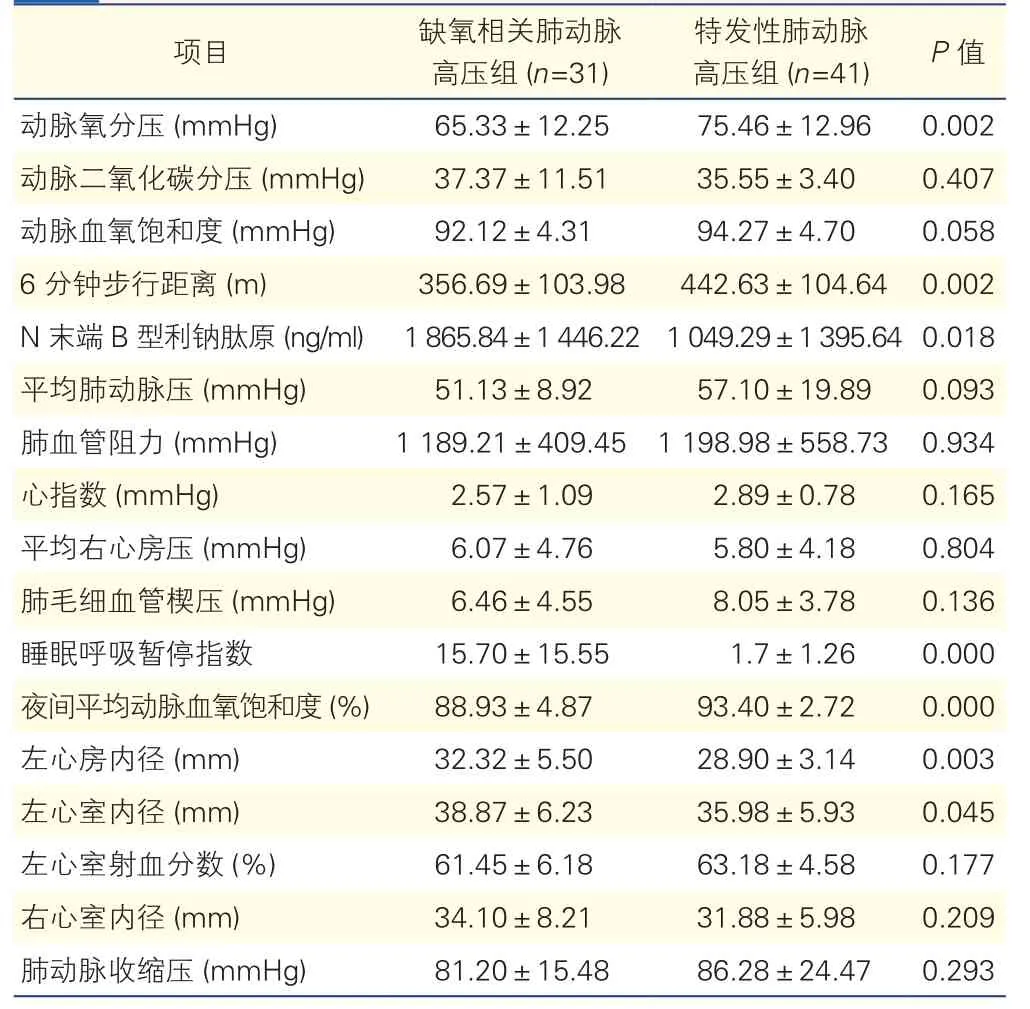
表2 两组患者的常规辅助检查和右心导管检查结果比较(±s)
注:1 mmHg=0.133 kPa
?
2.4 两组患者的治疗情况比较(表3)
特发性肺动脉高压组患者和缺氧相关肺动脉高压组患者均接受了右心导管及血管扩张试验结果指导下的钙拮抗剂、靶向药物及对症治疗,部分患者接受了多种靶向药物联合治疗。部分OSAHS患者根据严重程度接受了持续正压通气治疗。
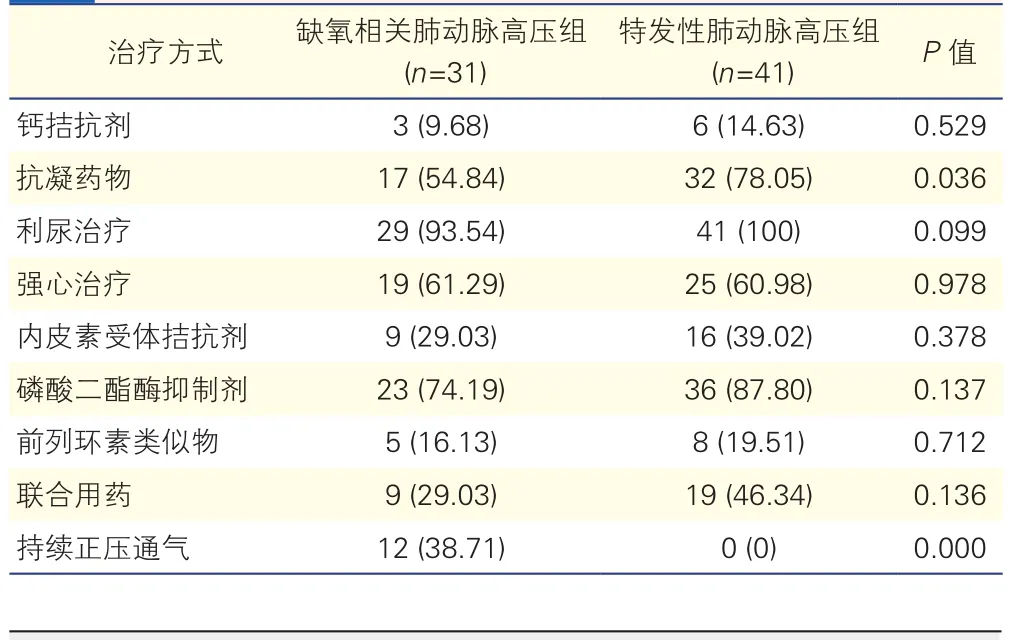
表3 两组患者的治疗情况比较[例(%)]
3 讨论
呼吸疾病和(或)缺氧相关肺动脉高压的诊断依赖于右心导管检查和缺氧病因的确立。常见的引起缺氧的疾病包括COPD、间质性肺病、OSAHS、肥胖低通气综合征等。按照mPAP的高低,可将呼吸系统或缺氧性疾病的患者分为无肺动脉高压、合并肺动脉高压和合并严重肺动脉高压[3]。呼吸疾病患者中合并肺动脉高压并不少见,但合并严重肺动脉高压的发病率较低[7],因此对严重肺动脉高压患者常忽视进行呼吸疾病的筛查。Sims等[8]发现,在COPD患者中,mPAP每增加5 mmHg,6MWD降低11 m。Burrows等[9]发现,增加的PVR与COPD患者的生存率降低强相关。ASPIRE研究证实,在间质性肺病合并肺动脉高压患者中,3年生存率仅为16%[10]。研究表明,低氧可能直接损伤心肌[11]。本研究中,缺氧相关肺动脉高压组患者的NT-proBNP和6MWD均低于特发性肺动脉高压组,缺氧很可能是导致该类肺动脉高压患者预后不良的原因。
值得注意的是,研究中20例患者为单纯OSAHS相关肺动脉高压患者,4例为OSAHS合并其他呼吸系统疾病的肺动脉高压患者,提示OSAHS与肺动脉高压密切相关。Dumitrascu等[12]发现,接近1/4的肺动脉高压患者中存在睡眠呼吸暂停现象。Bady等[13]使用右心导管,发现肺动脉高压患者中,27%的患者存在OSAHS。尤其在OSAHS合并其他呼吸系统疾病时可能引起较严重的肺动脉高压。
经胸超声心动图在合并呼吸疾病患者中评价肺动脉压力并不准确,且对于半数的患者被高估[14]。尽管如此,经胸超声心动图在怀疑肺动脉高压的呼吸疾病患者中仍然是重要的筛查手段,右心导管检查仅用于超声心动图提示重度肺动脉高压或右心功能不全的患者[3]。目前没有证据表明呼吸系统疾病的病情与肺动脉高压的严重程度平行,因此对于轻度缺氧性疾病合并严重肺动脉高压的患者,很难确定两种疾病之间的关系。对于难以鉴别基本病因时,应结合患者情况同时进行针对呼吸或缺氧性疾病和肺动脉高压的综合治疗。
钙拮抗剂在缺氧相关肺动脉高压患者中不被推荐,但对于严重缺氧相关肺动脉高压患者,钙拮抗剂的效果还缺乏明确证据。本研究中,3例患者为急性血管反应阳性,考虑到患者肺动脉高压较重,且未合并支气管痉挛等因素,我们在对症治疗的基础上尝试加用了钙拮抗剂,取得了较好的效果。
在临床中,对于OSAHS合并轻症肺动脉高压患者主要采用持续正压通气和针对基础呼吸疾病治疗。对OSAHS相关肺动脉高压患者,持续正压通气有可能逆转病情。患者若未做睡眠呼吸监测,很可能被误诊为特发性肺动脉高压,从而错失了使用持续正压通气治疗的机会。靶向药物治疗对缺氧相关肺动脉高压患者的效果目前还缺乏大规模、随机研究结果。仅有的研究因设计、患者选择的不同而结果不一。波生坦可能加重COPD相关肺动脉高压患者的病情[15],但也有研究显示,波生坦在COPD合并严重肺动脉高压患者中可能有效[16]。安立生坦可能无益于提高特发性肺纤维化合并肺动脉高压患者的生存率[17]。对严重的缺氧相关肺动脉高压患者,指南推荐到专业的肺血管病中心,根据具体病情和对治疗的反应综合处理。在本研究中,纳入的患者均为严重肺动脉高压患者,心力衰竭较重,进展较快,但部分患者拒绝接受持续正压通气治疗。对于这类患者我们在密切观察下尝试性加用了靶向药物治疗,患者对治疗反应良好。
由于我院为心血管病专科医院,限制了就诊患者的病因类型,而且研究纳入患者样本量偏小,可能对研究结果存在一定影响。此外,对于药物和持续正压通气治疗在此类患者中的效果,以及对于部分由于客观原因难以接受持续正压通气治疗的患者,靶向药物治疗是否能改善预后,依然需要长期随访来进一步确定。
[1]Sajkov D, Wang T, Saunders NA, et al. Daytime pulmonary hemodynamics in patients with obstructive sleep apnea without lung disease[J]. Am J Respir Crit Care Med, 1999, 159 (5 Pt 1): 1518-1526.DOI: 10. 1164/ajrccm. 159. 5. 9805086.
[2]Sims MW, Margolis DJ, Localio AR, et al. Impact of pulmonary artery pressure on exercise function in severe COPD[J]. Chest, 2009, 136:412-419. DOI: 10. 1378/chest. 08-2739.
[3]Galiè N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension[J]. Rev Española Cardiol, 2016, 69(2): 177. DOI: 10. 1016/j. rec. 2016. 01. 002.
[4]Vogelmeier CF, Criner GJ, Martínez FJ, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report: GOLD executive summary[J]. Arch Bronconeumol,2017, 53(3): 128-149. DOI: 10. 1016/j. arbres. 2017. 02. 001.
[5]中华医学会呼吸病学分会睡眠呼吸障碍学组. 阻塞性睡眠呼吸暂停低通气综合征诊治指南 (2011年修订版) [J]. 中华结核和呼吸杂志, 2012, 35(1): 9-12. DOI: 10. 3760/ema. J. issn. 1001-0939. 2012.01. 007.
[6]Iber C, Ancoli-Israel S, Chesson AI, et al. The AASM manual for the scoring of sleep and associated events. Rules, terminology and technical specifications[M]. 1sted. Westchester, Illinois: American Academy of Sleep Medicine, 2007.
[7]Thabut G, Dauriat G, Stern JB, et al. Pulmonary hemodynamics in advanced COPD candidates for lung volume reduction surgery or lung transplantation[J]. Chest, 2005, 127(5): 1531-1536. DOI: 10. 1378/chest. 127. 5. 1531.
[8]Sims MW, Margolis DJ, Localio AR, et al. Impact of pulmonary artery pressure on exercise function in severe COPD[J]. Chest, 2009, 136(2):412-419. DOI: 10. 1378/chest. 08-2739.
[9]Burrows B, Kettel LJ, Niden AH, et al. Patterns of cardiovascular dysfunction in chronic obstructive lung disease[J]. N Engl J Med, 1972,286(17): 912-918. DOI: 10. 1056/NEJM197204272861703.
[10]Hurdman J, Condliffe R, Elliot CA, et al. ASPIRE registry:Assessing the Spectrum of Pulmonary hypertension Identified at a referral centre[J]. Eur Respir J, 2012, 39(4): 945-955. DOI: 10.1183/09031936. 00078411.
[11]Morgan BJ, Denahan T, Ebert TJ. Neurocirculatory consequences of negative intrathoracic pressure versus asphyxia during voluntary apnea[J]. J Appl Physiol, 1985, 74(6): 2969-2975.
[12]Dumitrascu R, Tiede H, Eckermann J, et al. Sleep apnea in precapillary pulmonary hypertension[J]. Sleep Medicine, 2013, 14(3):247-251. DOI: 10. 1016/j. sleep. 2012. 11. 013.
[13]Bady E, Achkar A, Pascal S, et al. Pulmonary arterial hypertension in patients with sleep apnoea syndrome[J]. Thorax, 2000, 55(11): 934-939. DOI: 10. 1136/thorax. 55. 11. 934.
[14]Arcasoy SM, Christie JD, Ferrari VA, et al. Echocardiographic assessment of pulmonary hypertension in patients with advanced lung disease[J]. Am J Respir Crit Care Med, 2003, 167(5): 735-740. DOI:10. 1164/rccm. 200210-1130OC.
[15]Stolz D, Rasch H, Linka A, et al. A randomised, controlled trial of bosentan in severe COPD[J]. Eur Respir J, 2008, 32(3): 619-628. DOI:10. 1183/09031936. 00011308.
[16]Valerio G, Bracciale P, Grazia D, et al. Effect of bosentan upon pulmonary hypertension in chronic obstructive pulmonary disease[J]. Ther Adv Respir Dis, 2009, 3(1): 15-21. DOI: 10.1177/1753465808103499.
[17]Raghu G, Behr J, Brown KK, et al. Treatment of idiopathic pulmonary fibrosis with ambrisentan: a parallel, randomized trial[J]. Ann Intern Med, 2013, 158(9): 641-649. DOI: 10. 7326/0003-4819-158-9-201305070-00003.
