富硒治疗对大鼠急性一氧化碳中毒性脑病的作用
2018-01-30李金兰刘群会曹学兵贾敏谭明会聂淑科陈贵勤
李金兰,刘群会,曹学兵,贾敏,谭明会,聂淑科,3,陈贵勤
急性一氧化碳(carbon monoxide,CO)中毒是我国冬春季常见病、多发病,其发病率和死亡率在我国职业和非职业危害中均占前位。急性CO中毒性脑病是中毒后的常见神经系统并发症,占急性CO中毒的10%~30%,占重症CO中毒的50%,其发病率国内为10%~30%,国外为0.8%~43%[1-3]。CO中毒的急性阶段不但抑制血红蛋白与氧结合,与氧的解离也发生障碍,组织细胞的氧供及利用氧的能力下降,一旦缺氧即可造成严重的神经元破坏[4-6]。缺氧、氧化应激、炎症等激活某些信号系统,一系列的基因表达发生改变,促进或抑制细胞凋亡的发生[7]。硒(Se)以硒蛋白的形式存在于机体内,是主要抗氧酶--谷胱甘肽过氧化物酶(GPx)的必要组成部分,GPx通过含硒代半胱氨酸残基的氧化还原位点,参与调节激素、细胞信号传导及抗氧化[8]。小白蛋白(parvalbumin,PV)属于钙缓冲蛋白,可减少神经元损伤后出现的钙超载,进而阻断Caspase-3的激活,保护神经元免受兴奋性及钙超载诱导的神经元损伤,在调节细胞内钙聚集和抑制细胞凋亡中发挥重要作用[9,10]。因此,Caspase-3可能是硒及钙缓冲蛋白相互关联的一个关键点。本文研究富硒对急性CO中毒大鼠脑损伤后脑组织PV和Caspase-3表达水平的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康成年雄性SD大鼠60只,体质量250~280 g,由苏州爱尔特麦科技有限公司提供。喂养于条件相对恒定的环境,室内温度(23±1)℃,湿度(50±2)%,光照与黑夜各半(8~20时为光照时间)。
1.1.2 主要设备和试剂 99.99%CO气体由北京兆格气体科技有限公司提供;硒麦宝片,规格为0.5g/片,含硒量(以se计)91.59 μg/g,批号为QS610113016008,由恩施康世道生物技术发展有限公司提供;兔抗鼠PV抗体和兔抗鼠Caspase-3均购于美国Novus Biologicals公司,β-tubulin抗体购于武汉安特捷生物技术有限公司;免疫组化试剂盒(兔/鼠),购于武汉谷歌生物技术有限公司。Image-J图像分析软件购于美国National Institutes of Health公司。
1.2 方法
1.2.1 动物分组 将60只大鼠随机分为正常对照组(BC组)、急性CO中毒组(CO组)、低硒治疗组(L-Se组)、中硒治疗组(M-Se组)、高硒治疗组(H-Se组),每组各12只。BC组和CO组在造模前30 d及造模后每天对大鼠行纯水4 mL/kg灌胃;L-Se组、M-Se组、H-Se组分别在造模前30 d及造模后每天对大鼠行50 μg/(kg·d)、200 μg/(kg·d)、500 μg/(kg·d)的硒麦宝片+纯水4 mL/kg灌胃补硒。造模后7 d、14 d为时相点。
1.2.2 CO中毒动物模型制备 动物适应性饲养1周后,除对照组外的其余4组腹腔内注入纯CO气体制备动物模型[11]:造模前1 d大鼠禁食、禁水,清晨7时将大鼠称重后,首次腹腔注射130 mL/kg的CO,后每隔4 h追加1次65 mL/kg,共追加3次。造模过程中每10~20 min观察大鼠神志行为变化并记录。每次腹腔注射CO前取尾血0.1 mL抗凝入0.4 mL氨液(0.4 mol/L),并加入低亚硫酸钠20 mg混匀。5~10 min测定535 nm、578 nm波长吸光度,监测血碳氧血红蛋白(HbCO)浓度,公式为:HbCO(%)=(2.44×A535/A578-2.68)×100%。以血HbCO水平维持在50%以上为中毒指标。注射完毕将大鼠迅速移到空气流通的地方。BC组采用腹腔等量分次空气注射。造模完毕 24 h内给予存活大鼠牛奶、花生碎、凉开水灌胃,通风保暖,室温保持(24±2)°C,环境湿度(40±10)%。
1.2.3 大鼠外周脏器病理检查和大脑皮质免疫组织化学检查 造模后第7天、第14天,大鼠用3.6%水合氯醛(1 mL/100 g)腹腔注射麻醉,仰卧位固定,暴露心脏,左心室心尖行心内插管,剪开右心房,灌注生理盐水至右心房流出液清亮为止,再用4%多聚甲醛溶液心内灌注固定至头及四肢发硬,断头法取出全脑,再取外周肝脏、双肾组织,置于4%多聚甲醛中固定10~20 h,冠状面取材后脱水、石蜡包埋,用超薄切片机切成4 μm的连续切片。肝脏、双肾组织行常规组织病理HE染色,脑组织行免疫组织化学染色。
1.2.4 Western blot法检测大脑皮质PV和失活Caspase-3蛋白的表达 每组取6只大鼠,经乙醚麻醉,快速处死,取大脑皮质,采用组织裂解法提取总蛋白。用考马斯亮蓝蛋白试剂盒测定蛋白含量,按4 μg/μL蛋白制成样品,-80℃保存。制备5%浓缩胶和10%分离胶的聚丙烯酰胺垂直平板凝胶,40 μg总蛋白经70 V电压电泳2.5 h后,电转280 mA、1 h转印至PVDF膜。转膜后,用含5%小牛血清蛋白室温封闭1 h。按分子量大小切取条带,分别加入兔抗大鼠PV抗体(稀释度1∶ 1 000),兔抗大鼠Caspase-3抗体(稀释度1∶1 000),4℃孵育过夜,TBST洗脱3次,每次10 min;加入碱性磷酸酶标记的羊抗兔IgG抗体(稀释度1∶5 000),室温孵育1 h,TBST洗脱3次,每次10 min。ECL发光、显影、定影、扫描,采用Image-J图像分析软件进行分析,以目的蛋白条带灰度值与内参β-actin条带灰度值的比值反映目的蛋白表达水平。重复测定3次,取其均值。
1.3 统计学处理
PV采用阳性细胞计数法:每张切片计数高倍镜下(400倍)10个视野皮质放射冠内有核阳性细胞数。采用SPSS13.0统计软件进行分析,计量资料以(均数±标准差)表示,计数资料采用χ2检验,多组间比较应用单因素方差分析,进一步两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝脏组织组织学比较
造模后7 d、14 d,BC组肝小叶结构完整,肝索排列整齐,汇管区无纤维化;CO组大鼠肝细胞未见明显水肿,肝小叶结构正常,汇管区无扩大增宽,无胶原沉积,未见纤维间隔和假小叶形成;L-Se组、M-Se组和H-Se组的肝小叶结构基本正常,肝细胞无明显变性、坏死,汇管区无胶原沉积,无明显纤维间隔形成,与BC组和CO组比较,无明显病理结构改变,见图1。
2.2 各组大鼠肾组织组织学比较
造模后7 d、14 d,BC组肾脏皮质区结构正常,小管管腔完整,腔面可见刷状缘,间质无充血、水肿及炎性细胞浸润;CO组细胞无肿胀,小管刷状缘无明显受损,小管上皮细胞无缺血坏死,与BC组的肾脏皮质结构比较无明显变化。L-Se组、M-Se组和H-Se组的肾小球体积无增大,肾小球囊腔正常,细胞数未见增多,小管上皮细胞未见肿胀、坏死、刷状缘脱落,无空泡样、颗粒样变性,无炎性细胞浸润,与BC组、CO组比较无明显病理性改变,见图2。
2.3 各组大鼠脑皮质免疫组化染色比较
PV免疫反应阳性细胞表现为细胞浆呈棕褐色的圆形或卵圆形颗粒。造模后7 d、14 d,相较于BC组,CO组大鼠皮质内PV阳性细胞数大幅度下降,差异有统计学意义(P<0.05);相较于CO组,L-Se组的PV阳性细胞数无明显变化(P>0.05),M-Se组第7天的PV阳性细胞数差异无统计学意义(P>0.05),第14天的PV阳性细胞数增多明显,差异有统计学意义(P<0.05)。L-Se组在7 d和14 d的PV阳性细胞数比BC组少,差异有统计学意义(P<0.05)。M-Se组在7 d和14 d的PV阳性细胞数较L-Se组增多,差异有统计学意义(P<0.05);14 d与BC组比较差异无统计学意义(P>0.05);H-Se组在7 d和14 d的PV阳性细胞数较CO组、L-Se组、M-Se组明显增多,差异均有统计学意义(P<0.05);与BC组无明显差异(P>0.05),见图3。

图1 各组大鼠肝脏病理组织学观察(HE染色,×200)
图2 各组大鼠肾皮质病理组织学结果(HE染色,×400)
2.4 各组大鼠脑皮质PV和Caspase-3蛋白表达结果
造模后7 d、14 d,CO组的大鼠脑皮质内PV的表达量低于BC组,Caspase-3的表达量高于BC组,差异有统计学意义(P<0.05);L-Se组在7 d和14 d的PV表达量较CO组差异无统计学意义(P>0.05),但仍低于BC组,差异有统计学意义(P<0.05),Caspase-3表达量仍高于BC组,差异有统计学意义(P<0.05);M-Se组在7 d和14 d的PV表达量较CO组、L-Se组无明显变化,低于BC组,差异有统计学意义(P<0.05),Caspase-3表达量较CO组、L-Se组减少,仍高于BC组,差异有统计学意义(P<0.05);H-Se组在7 d和14 d的PV表达量较CO组、L-Se组增多,差异有统计学意义(P<0.05),与BC组比较差异无统计学意义(P>0.05),Caspase-3的表达量较CO组、L-Se组减少,差异有统计学意义(P<0.05),与BC组比较差异无统计学意义(P>0.05),见图4。
3 讨论
CO是急性中毒导致死亡最常见的窒息性气体,是较常见的职业性及生活性中毒,CO中毒能引起以中枢神经系统和心血管系统功能损害为主的多脏器损害[2]。急性CO中毒性脑病中最严重的是部分患者急性中毒症状消失后,经过数天或数周表现正常或接近正常的“假愈期”,会出现以痴呆为主的精神神经症状,称为急性CO中毒迟发性脑病[12](delayed encephalopathy after acute carbon monoxide poisoning,DEACMP),其发病机制尚未阐明,可能与谷氨酸兴奋毒性、氧化应激、细胞内Ca2+超载、细胞凋亡等多种因素有关[13,14]。
CO中毒后脑组织缺血缺氧可显著诱导ROS的产生和细胞内钙超载的形成,介导神经元的死亡[5,6];氧化应激本身也可诱导产生自由基,并导致细胞内钙离子浓度的大量增加[15,16]。缺氧缺血组织因能量降低使细胞内Ca2+升高,可激活钙蛋白酶并介导钙蛋白酶从细胞质向细胞膜易位,使活化的Caspase-12进一步激活Caspase-3导致细胞凋亡[17]。凋亡过程中,上游产物(主要复合物cyt CApaf-1,Caspase-9d)活化下游产物Caspase-3、6、7。Caspase-3的活化标志着细胞凋亡的开始,因此Caspase-3也被称为死亡蛋白[18]。文献报道CO中毒患者尸检时发现其脑组织皮质、海马、基底核区存在大量细胞凋亡现象。国内外学者也证实大鼠CO中毒3 d后神经元开始凋亡,7 d达到高峰,说明CO中毒可引起细胞凋亡[19]。本研究显示,在大鼠CO中毒前后灌胃补充硒可显著降低Caspase-3活性,减少继发性神经元损伤。


图3 造模后第7天和第14天各组大鼠脑皮质PV免疫组化结果
硒是人体重要的微量元素,在人体以硒蛋白的形式存在。由于硒的治疗剂量和中毒剂量接近,本实验在给予灌胃补硒治疗后行HE染色观察大鼠肝脏和肾脏组织,结果表明大鼠的外周肝脏、肾组织形态无明显损伤,说明给药剂量为安全剂量。硒是GPx的必要组成部分,Chris等[20]发现GPx可保护红细胞中的血红蛋白不受H2O2和抗坏血酸诱导生的氧化,其独特之处是其活性不受叠氢物或氰化物的抑制,减少脂质的氧化,抑制Ca2+超载。PV属于钙缓冲蛋白,可减少神经元损伤后出现的钙超载,进而阻断Caspase-3的激活,保护神经元免受兴奋性及钙超载诱导的神经元损伤[9]。
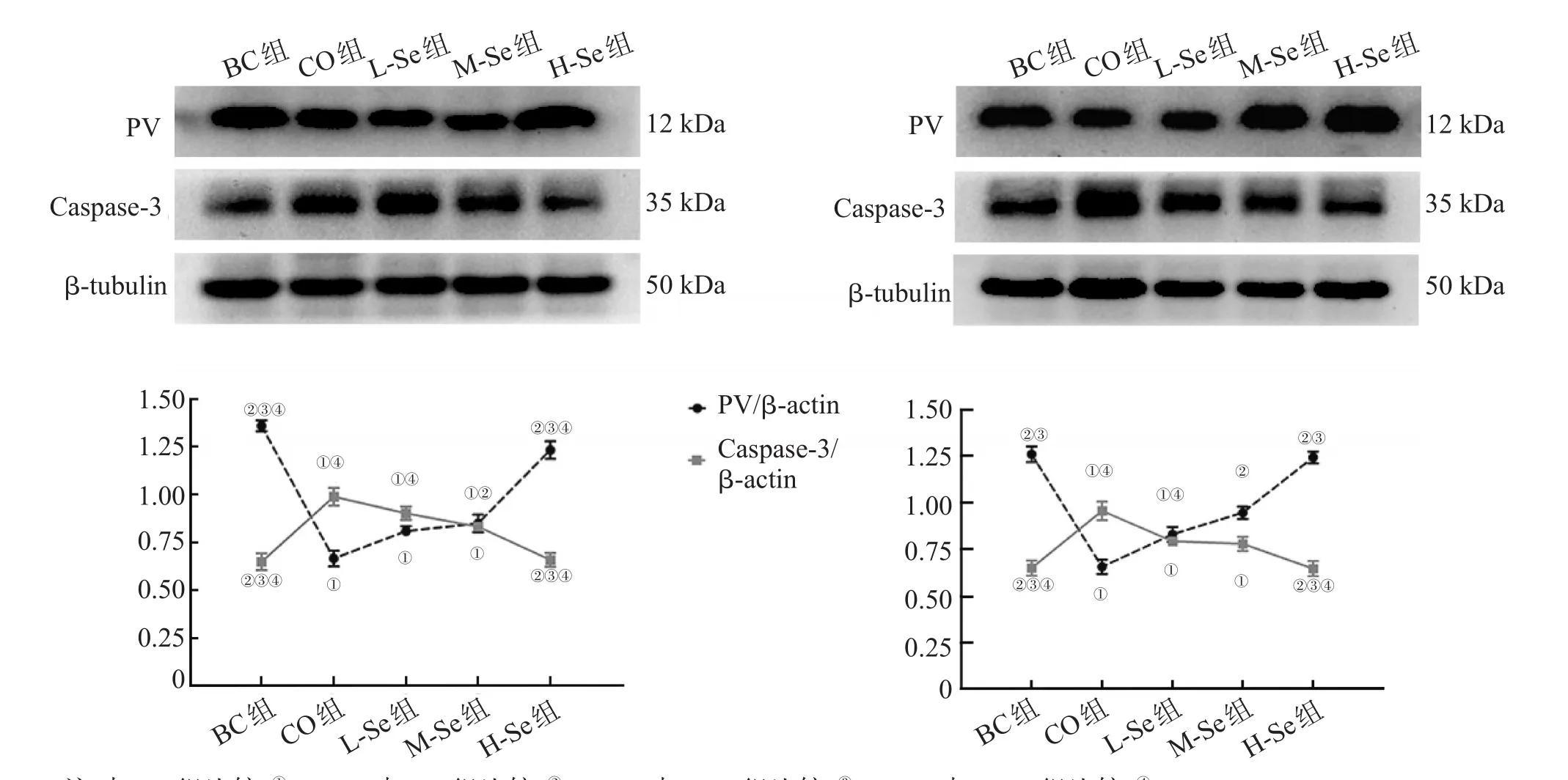
图4 造模后第7天(A)和第14天(B)各组大鼠脑皮质PV和Caspase-3 Western blotting结果
众所周知,CO中毒后迟发性脑病防治一直是医学研究领域的难点,目前国内外关于富硒药物对急性CO中毒的防治未见相关研究,本研究通过建立大鼠腹腔注射CO中毒迟发性脑病模型,发现高剂量的硒治疗可明显上调PV,减少Caspase-3的活化,保护急性CO脑病的脑组织损伤,而低剂量和中剂量的补硒治疗对急性CO中毒性脑病后脑组织的PV和Caspase-3表达的变化无明显影响。
[1]Birmingham CM,Hoffman RS.Hyperbaric oxygen therapy for acute domestic carbon monoxide poisoning:two randomized controlled trials[J].Intensive Care Med,2011,37:1218.
[2]Liu XH,Yan H,Xu M,et al.Hyperbaric oxygenation reduces longterm brain injury and ameliorates behavioral function by suppression of apoptosis in a rat model of neonatal hypoxia-ischemia[J].Neurochem Int,2013,62:922-930.
[3]HampsonNB,WeaverLK.Carbon monoxide poisoning:a new incidence for an old disease[J].Undersea Hyperb Med,2007,34:163-168.
[4]Xu X,Zhang H,Wang K,et al.Protective Effect of Edaravone against Carbon Monoxide Induced Apoptosis in Rat Primary Cultured Astrocytes[J].Biochem Res Int,2017:5839762.
[5]Akyol S,Yuksel S,Pehlivan S,et al.Possible role of antioxidants and nitric oxide inhibitors against carbon monoxide poisoning:Having a clear conscience because of their potential benefits[J].Med Hypotheses,2016,92:3-6.
[6]Dong G,Ren M,Wang X,et al.Allopurinol reduces severity of delayed neurologic sequelae in experimental carbon monoxide toxicity in rats[J].Neurotoxicology,2015,48:171-179.
[7]Hu HJ,Sun Q,Ye ZH,et al.Characteristics of exogenous carbon monoxide deliveries[J].Med Gas Res,2016,6:96-101.
[8]Ilham I,Siddik MA,Fotedar R,et al.Effects of Organic Selenium Supplementation on Growth,Accumulation,Haematology and Histopathology of Juvenile Barramundi(Lates calcarifer)Fed High Soybean Meal Diets[J].Biol Trace Elem Res.2016,174:436-447.
[9]Lema Tomé CM,Bauer C,Nottingham C,et al.MK801-induced caspase-3 in the postnatal brain:inverse relationship with calcium bigding proteins[J].Neuroscience,2006,141:1351-1363.
[10]Sung JH,Shah FA,Cho EH,et al.Ginkgo biloba extract(EGb 761)prevents the ischemic brain injury-induced decrease in parvalbumin expression[J].LabAnim Res,2012,28:77-82.
[11]王耀宏,赵金垣,崔书杰,等.急性一氧化碳中毒迟发性脑病的动物模型制备研究[J].中国职业医学,2004,31:5-10.
[12]Li SG,Li WQ,Wang JK,et al.Association of the genes for tumor necrosis factor-α and myelin basic protein with delayed encephalopathy after acute carbon monoxide poisoning[J].Genet Mol Res,2012,11:4479-4486.
[13]Akyol S,Erdogan S,Idiz N,et al.The role of reactive oxygen species and oxidative stress in carbon monoxide toxicity:an in-depth analysis[J].Redox Rep,2014,19:180-189.
[14]Lippi G,Rastelli G,Meschi T,et al.Pathophysiology,clinics,diagnosis and treatment of heart involvement in carbon monoxide poisoning[J].Clin Biochem,2012,45:1278-1285.
[15]Liu W1,Xu Z2,Yang T1,et al.Memantine,a Low-Affinity NMDA Receptor Antagonist,Protects against Methylmercury-Induced Cytotoxicity of Rat Primary Cultured Cortical Neurons,Involvement of Ca2+Dyshomeostasis Antagonism,and Indirect Antioxidation Effects[J].Mol Neurobiol,2017,54:5034-5050.
[16]李墁,宋艳玲,梅元武,等.不同时间点电针治疗对脑梗死大鼠Bcl-2 mRNA转录及caspase-3蛋白表达的影响[J].神经损伤与功能重建,2010,5:343-346.
[17]Tyagi N,Moshal KS,Ovechkin AV,et al.Mitochondrial mechanism of oxidative stress and systemic hypertension in hyperhomocysteinemia[J].J Cell Biochem,2005,96:665-671.
[18]Chang HY,Yang X.Proteases for cell suicide:functions and regulation of caspases[J].Microbiol Mol Biol Rev,2000,64:821-846.
[19]彭道勇,王苏平,张志清,等.一氧化碳中毒迟发记忆障碍小鼠海马神经细胞凋亡的初步研究.大连医科大学学报,2006,28:1-3.
[20]Feeney CJ,Frantseva MV,Carlen PL,et al.Vulnerability of glial cells to hydrogen peroxide in cultured hippocampal slices[J].Brain Res,2008,1198:1-15.
