芒果苷通过抑制氧化应激及抗凋亡作用保护大鼠颅脑损伤
2018-01-30谭支强
谭支强
创伤性颅脑损伤(Traumatic Brain Injury,TBI)的发生率逐年增加,已成为神经外科常见的疾病之一[1]。TBI后颅内继发水肿、氧化应激反应和炎症反应等是患者死亡的主要原因[2,3]。因此,抑制颅内水肿及氧化应激以及抗神经凋亡能加速TBI患者恢复。芒果苷(Mangiferin,MAN)是一类双苯吡酮类黄酮类化合物,具有抗糖尿病、抗肿瘤、抗炎、抗氧化等作用[4,5]。本实验探讨MAN对大鼠TBI的保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级雄性SD大鼠60只,体质量200~250 g,由上海交通大学动物实验中心提供。
1.1.2 主要试剂及仪器 Freeny's自由落体架由上海交通大学动物实验中心提供,MAN(纯度≥98%,购于美国Sigma公司);大鼠丙二醛(Malondialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)Elisa试剂盒、谷胱甘肽(Glutathione,GSH)(购于上海博谷公司);大鼠Bax,Bcl-2一抗,DAB显色试剂盒(购于美国Santa Cruz公司);1%戊巴比妥钠(购于北京化学试剂公司);紫外分光光度计(购于美国Bausch Lomb公司);0.9%氯化钠注射液(购于北京双鹤药业);注射用青霉素钠(购于瑞阳制药公司);Image Pro Plus 6.0软件(美国Media Cybernetics公司)。
1.2 方法
1.2.1 TBI模型的制作 术前禁食8 h,1%戊巴比妥钠腹腔注射麻醉大鼠,将大鼠固定于Freeny's支架上,消毒,切开颅顶部皮肤后剥离骨膜,充分暴露颅骨,利用微型电钻切开直径约5 mm的圆形骨窗,将50 g打击器置于20 cm高度自由落下撞击骨窗,骨蜡封闭骨窗,缝合头皮。术后大鼠单笼饲养。神经功能缺损评分>2分表明造模成功。假手术组只制作骨窗,不打击颅脑。
1.2.2 实验分组及给药 60只SD大鼠适应性喂养1周后随机分为5组:假手术组、模型组、MAN低浓度组(10 mg/kg)、MAN中浓度组(20 mg/kg)和MAN高浓度组(40 mg/kg),每组12只。MAN低、中、高组每日通过腹腔注射MAN 1次,连续注射7 d。假手术组和模型组大鼠腹腔注射等体积生理盐水。
1.2.3 神经功能评估 采用改良神经功能缺损评分(modified Neurological Severity Score,mNSS)[6]评估术后各组大鼠3 d和7 d的神经功能缺损情况,包括:肢体运动测试6分,感觉测试2分,平衡木测试6分,反射反应及异常活动4分。
1.2.4 颅内水肿的测定 造模7 d后,各组取4只大鼠,取出脑组织后称重,随后放入80℃烘箱中放置72 h,待完全风干后再次称重。
1.2.5 Elisa法检测损伤脑组织氧化应激因子含量及活性 造模7 d后,各组取4只大鼠脑组织,保留损伤灶及边缘2 mm区域,每个脑组织切分为2份,分别用于氧化应激因子和Bax/Bcl-2蛋白的检测。充分剪碎后研磨,利用标准稀释液进行稀释,加终止液后混匀,测定450 nm吸光度,根据吸光度计算MDA、CAT、SOD、GSH含量。
1.2.6 Western-blot法检测Bax和Bcl-2蛋白表达造模7 d后,取出损伤区域脑组织,充分剪碎后研成匀浆,3 mL/g蛋白裂解液充分裂解后,以10 000 g离心30 min,取出上清液。BCA法测定总蛋白浓度。经过加样、SDS-PAGE电泳、转膜、封闭、一抗(1:1 500)孵育过夜,二抗(中衫金桥)1∶5 000孵育3 h,脱脂奶粉充分洗净后加入显色剂显色,利用凝胶成像系统成像,Image Pro Plus 6.0软件计算各组条带灰度值。1.2.7免疫组织化学染色观测 造模7 d后,各组取4只大鼠脑组织,保留损伤灶及边缘2 mm区域,10%多聚甲醛固定48 h,石蜡包埋,从损伤部位的脑组织连续切片,片厚5 μm。切片后行Caspase-3免疫组织化学染色,荧光倒置显微镜下观察,Caspase-3阳性镜下可呈黄色或棕黄色,形态不规则。200倍镜视野下,每张切片随机取3个视野,观察Caspase-3染色及利用Image Pro Plus 6.0软件检测Caspase-3蛋白表达平均光密度值。
1.3 统计学处理
2 结果
2.1 各组大鼠神经功能比较
造模后3 d和7 d,mNSS评分明显升高(P<0.05),经过芒果苷治疗后,MAN 3个浓度组mNSS评分低于假手术组(P<0.05);MAN中浓度组低于低浓度组,高浓度组低于低、中浓度组,呈剂量依赖趋势(P<0.05),见表1。
表1 各组造模后mNSS评分比较(±s,n=12)

表1 各组造模后mNSS评分比较(±s,n=12)
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05;与MAN低浓度组比较,③P<0.05;与MAN中浓度组比较,④P<0.05
7 d 0 8.7±0.8①7.2±0.9②6.4±0.7②③5.5±0.6②③④19.343 0.007组别假手术组模型组MAN低浓度组MAN中浓度组MAN高浓度组F值P值只数12 12 12 12 12 3 d 0 12.1±1.3①9.5±0.9②8.6±0.7②③7.3±0.8②③④14.862 0.018
2.2 芒果苷对TBI大鼠脑水肿情况的影响
假手术组、模型组、MAN低浓度组、MAN中浓度组、MAN高浓度组的脑组织含水量分别为(68.3±4.4)%、(82.1±4.9)%、(79.2±4.7)%、(74.8±4.4)%、(70.4±4.8)%,模型组的脑组织含水量较假手术组明显升高(P<0.05)。MAN低浓度组和中浓度组的脑组织含水量较模型组降低(P<0.05),而高浓度组脑含水量明显低于低、中浓度组脑组织含水量(P<0.05)。
2.3 各组大鼠MDA、CAT、SOD及GSH活性比较
造模后,模型组MDA含量明显升高,CAT、SOD、GSH含量明显降低(P<0.05),经MAN治疗后,各组氧化应激因子明显逆转(P<0.05),中浓度组高于低浓度组,高浓度组高于低、中浓度组,呈剂量依赖趋势(F=10.967,17.455,9.174,13.021,P<0.05),见表2。
2.4 Western blot法检测Bax/Bcl-2蛋白表达
各组大鼠脑组织Bax蛋白表达分别为(1.1±0.2)、(11.8±0.9)、(9.1±0.8)、(7.3±0.8)、(5.6±0.7),模型组中凋亡蛋白Bax表达提高(P<0.05),而经过MAN治疗后,损伤脑组织中Bax表达得到明显抑制,与模型组相比,差异具有统计学意义(P<0.05),各浓度组之间,中浓度组低于低浓度组,而高浓度组低于低、中浓度组(F=16.927,P<0.05);各组大鼠脑组织Bcl-2蛋白表达分别为(9.3±0.9)、(1.0±0.2)、(3.2±0.3)、(3.9±0.4)、(5.7±0.6),模型组中Bcl-2表达明显下调(P<0.05),而经过MAN治疗后,损伤脑组织中Bcl-2表达得到明显提升(P<0.05),各浓度组之间,中浓度组高于低浓度组,而高浓度组高于低、中浓度组(F=12.852,P<0.05),见图1。

图1 各组大鼠Bax及Bcl-2蛋白表达
2.5 免疫组织化学染色观察
各组Caspase-3蛋白均表达于脑皮质,假手术组可见少量Caspase-3表达,模型组可见大量Caspase-3蛋白,MAN组Caspase-3蛋白依次减少,见图2。假手术组、模型组、MAN低浓度组、MAN中浓度组和MAN高浓度组的Caspase-3表达平均光密度分别为(13.9±2.8)、(94.7±9.6)、(82.1±8.8)、(67.9±7.1)、(55.4±6.3),模型组的Caspase-3表达高于假手术组(P<0.05)。MAN组Caspase-3表达均低于模型组(P<0.05)。MAN各组之间,中浓度组低于低浓度组,高浓度组低于低、中浓度组,差异有统计学意义(P<0.05)。
表2 各组氧化应激因子表达(±s)
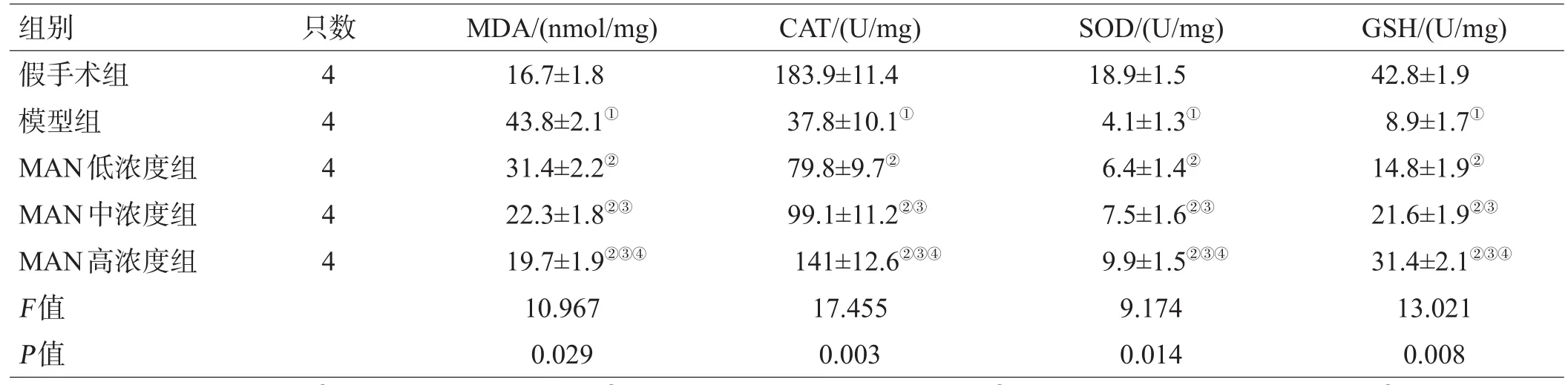
表2 各组氧化应激因子表达(±s)
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05;与MAN低浓度组比较,③P<0.05;与MAN中浓度组比较,④P<0.05
组别假手术组模型组MAN低浓度组MAN中浓度组MAN高浓度组F值P值只数4 4 4 4 4 MDA/(nmol/mg)16.7±1.8 43.8±2.1①31.4±2.2②22.3±1.8②③19.7±1.9②③④10.967 0.029 CAT/(U/mg)183.9±11.4 37.8±10.1①79.8±9.7②99.1±11.2②③141±12.6②③④17.455 0.003 SOD/(U/mg)18.9±1.5 4.1±1.3①6.4±1.4②7.5±1.6②③9.9±1.5②③④9.174 0.014 GSH/(U/mg)42.8±1.9 8.9±1.7①14.8±1.9②21.6±1.9②③31.4±2.1②③④13.021 0.008
3 讨论
TBI包括原发脑损伤(Primary Brain Injury,PBI)和继发脑损伤(Secondary Brain Injury,SBI)[7],PBI后颅内发生一系列病理生理改变,如脑组织水肿、氧化应激及炎性因子代谢异常或神经细胞凋亡和坏死等[8]。大量研究证明,脑水肿、氧化应激反应、炎性反应以及神经凋亡是TBI后继发性脑损伤的主要原因[9]。
颅内水肿在TBI病情发展中占据重要作用[10],TBI后血脑屏障发生变化,脑微循环障碍,引起损伤区及周围组织含水量增加,且TBI后可发生脑自由基、前列腺素及神经肽类变化,均可引起脑水肿。本研究通过Feeney氏自由落体法制作的TBI模型,通过干湿法可测量脑水肿情况发现,TBI后脑水肿明显加剧,而经过MAN治疗后,水肿指数明显下调,mNSS评分显示大鼠神经功能明显提高,提示MAN可通过抑制损伤脑组织水肿从而发挥神经保护作用。

图2 各组大鼠Caspase-3表达(免疫组织化学染色×200)
氧化应激是TBI后形成继发性损伤的重要因素之一[11],TBI后颅内氧自由基大量增加,自由基破坏生物膜结构的完整性和通透性,使细胞钙通道开发,大量钙离子进入细胞内,导致细胞变性、凋亡和坏死。MDA是膜脂过氧化终产物,可直接反映体内膜脂过氧化程度,其含量可间接反映呼吸链酶对细胞的攻击程度[12]。SOD催化过氧阴离子的歧化反应,是细胞内主要的自由基清除剂,广泛存在于哺乳动物细胞内,SOD含量可反映机体细胞内源性氧自由基清除能力[13]。CAT科催化分解过氧化氢,避免过氧化氢与氧在铁螯合物作用下生产有害的氢氧根离子,CAT主要存在于红细胞和机体某些组织内,是过氧化物酶体的标志酶。GSH是一种重要的过氧化物分解酶,可将过氧化物还原成无毒性的羟基化合物,其含量高低可间接反映机体清除过氧化物的能力[14]。本研究发现,TBI后脑组织氧化应激因子MDA明显上调,而CAT、SOD、GSH含量得到抑制,经MAN治疗后,MDA含量明显下调,CAT、SOD、GSH含量明显提高,提示MAN可通过抑制MDA,上调CAT、SOD、GSH含量抑制氧化应激反应,从而发挥神经保护作用。
凋亡是细胞的自毁机制,在TBI后病理生理机制中发挥重要作用,TBI后神经细胞受到氧化应激及炎性因子刺激,启动一系列控制程序,其中Bcl家族与凋亡的关系最为密切。Bcl-2是一种重要的抗凋亡蛋白,能掌控细胞存活的分子调控点,能通过线粒体膜抑制一些凋亡诱导因子,如Caspase和细胞色素C的释放,促使细胞存活[15]。Bax是细胞内主要的促凋亡因子之一,Bax过表达可拮抗Bcl-2,从而促进细胞凋亡[16],病理条件下,Bax可促进细胞色素C释放,激活Caspase,加速细胞凋亡。因此,Bax大量表达可能是导致颅脑损伤后神经细胞凋亡的主要原因。目前研究认为,Bcl-2和Bax对细胞凋亡调控作用相互拮抗,存在动态平衡,当Bax过表达,细胞出现凋亡[17-19]。本研究发现,TBI后,脑组织Bax表达水平提高,Bcl-2表达明显下调,而经MAN治疗后Bax蛋白表达受到明显抑制,Bcl-2水平提高,并且,MAN可明显抑制TBI大鼠脑组织Capase-3表达,提示MAN可通过抑制Bax/Bcl-2和Caspase-3途径发挥神经保护作用。
[1]Corps KN,Roth TL,McGavern DB.Inflammation and neuroprotection in traumatic brain injury[J].JAMANeurol,2015,72:355-362.
[2]骆良钦,陈祥荣,李亚松,等.JNK信号通路在大鼠创伤性脑损伤后炎症反应中的作用[J].中华神经医学杂志,2014,12:1233-1238.
[3]白立曦,宋锦宁.创伤性脑损伤后氧化应激损伤机制研究进展[J].中华脑科疾病与康复杂志,2013,5:325-328.
[4]Vyas A,Syeda K,Ahmad A,et al.Perspectives on medicinal properties of mangiferin[J].Mini Rev Med Chem,2012,12:412-425.
[5]Garrido-Suárez BB,Garrido G,Delgado R,et al.A Mangifera indica L.extract could be used to treat neuropathic pain and implication of mangiferin[J].Molecules,2010,15:9035-9045.
[6]Charidimou A,Pasi M,Fiorelli M,et al.Leukoaraiosis,Cerebral Hemorrhage,and Outcome After Intravenous Thrombolysis for Acute Ischemic Stroke:AMeta-Analysis(v1)[J].Stroke,2016,47:2364-2372.
[7]McDonald SJ,Sun M,Agoston DV,et al.The effect of concomitant peripheral injury on traumatic brain injury pathobiology and outcome[J].J Neuroinflammation,2016,13:90.
[8]Kinoshita K.Traumatic brain injury:pathophysiology for neurocritical care[J].J Intensive Care,2016,4:29.
[9]Nguyen T,Mao Y,Sutherland T.Neural progenitor cells but not astrocytes respond distally to thoracic spinal cord injury in rat models[J].Neural Regen Res,2017,12:1885-1894.
[10]Liu W,Yuan J,Zhu H,et al.Curcumin reduces brain-infiltrating T lymphocytes after intracerebral hemorrhage in mice[J].Neurosci Lett,2016,620:74-82.
[11]Lopez MS,Dempsey RJ,Vemuganti R.Resveratrol neuroprotection in stroke and traumatic CNS injury[J].Neurochem Int,2015,89:75-82.
[12]Kontos Ding H,Wang H,Zhu L.Ursolic Acid Ameliorates Early Brain Injury After Experimental Traumatic Brain Injury in Mice by Activating the Nrf2 Pathway[J].Neurochem Res,2017,42:337-346.
[13]Afonso V,Champy R,Mitrovic D,et al.Reactive oxygen species and superoxide dismutases:Role in joint diseases[J].Joint Bone Spine,2007,74:324-329.
[14]Wang XF,Huang YF,Wang L,et al.Photo-protective activity of pogostone against UV-induced skin premature aging in mice[J].Exp Gerontol,2016,77:76-86.
[15]Li K,Ding D,Zhang M.Neuroprotection of Osthole against Cerebral Ischemia/Reperfusion Injury through an Anti-apoptotic Pathway in Rats[J].Biol Pharm Bull,2016,39:336-342.
[16]Scarfò L,Ghia P.Reprogramming cell death:BCL2 family inhibition in hematological malignancies[J].Immunol Lett,2013,155:36-39.
[17]刘伟国,杨小锋,李谷.盐酸纳络酮对严重颅脑损伤后神经细胞凋亡及相关基因的Bcl-2,Bax的表达影响的研究[J].中华神经外科杂志,2004,20:170-172.
[18]崔梅,杨琦,董强.Mdivi-1对糖氧剥夺后神经元凋亡蛋白Bax活化、嵌入及细胞色素C释放的影响[J].神经损伤与功能重建,2014,9:173-176.
[19]孙涛,杨天明,王天路.Bcl-2、Bax、Caspase-3表达与颞叶癫癎发病的相关性研究[J].神经损伤与功能重建,2009,4:170-172.
