大黄鱼鱼卵磷脂酰胆碱纳米脂质体对Hep G2细胞增殖活性影响的初步探究
2018-01-30陈丽娇程文健
孙 鹤 ,张 敏 ,魏 微 ,梁 鹏 ,2,陈丽娇 ,2,程文健 ,2
大黄鱼鱼卵作为大黄鱼加工过程中的主要副产物,其含有丰富的营养物质,尤其是二十二碳六烯酸(Docosahexaenoic acid,DHA)、二十碳五烯酸(Eicosapentaenoic acid,EPA) 和磷脂 (Phospholipids,PLs),具有较高的食用价值和营养价值[1]。PLs是构成生物细胞的重要物质,按其来源可分为动物磷脂、植物磷脂、微生物磷脂。植物磷脂以大豆磷脂最为常见,但由于不饱和脂肪酸的存在,导致其稳定性不高,易氧化变质。生产PLs的微生物主要包括细菌、酵母等,但需借助高度的发酵技术,并进行大量菌株的筛选,所以微生物来源的PLs要比动植物性PLs昂贵得多。相比而言,由于海洋磷脂结合了大量的DHA、EPA,海洋磷脂的抗氧化性使得DHA-PLs和EPA-PLs在进入人体后,可以较好地被人体细胞摄取。此外,相比于结合其他较低不饱和度的脂肪酸磷脂来说,DHA-PLs和EPA-PLs的氧化稳定性更高。PLs种类繁多、结构复杂,不同的PLs具有不同的生物学功能。研究表明,磷脂酰胆碱(Phosphatidylcholine,PC) 具有提高免疫功能、改善肝脏脂质代谢障碍、激活巨噬细胞活力、增强机体抵抗疾病的能力[2-3]。结合有DHA、EPA的PC,在拥有PC和EPA、DHA等各自功能特性的基础上具有许多独特的生物学活性。Martin Rossmeisl等人[4]研究发现富含ω-3多不饱和脂肪酸(Polyunsaturated fatty acids,ω-3 PUFA) 的PLs能够对非酒精性脂肪肝起到一定的预防作用;胡世伟等人[5]研究发现海参EPA-PC能显著降低糖尿病大鼠空腹血糖水平,改善口服葡萄糖耐量,促进空腹血清胰岛素的分泌,增加肝糖原含量。崔洁等人[6]研究表明DHA-PLs对试验性肥胖小鼠脂质代谢具有良好的调节减肥作用。课题组前期采用大黄鱼鱼卵磷脂研究了其对小鼠脂质代谢的调节作用,结果表明大黄鱼鱼卵磷脂具有显著改善脂质吸收的作用[7]。因此,近年来源于水产品中的PC作为PLs的主要功能组分越来越受到研究者的关注[8]。
课题组前期研究发现大黄鱼鱼卵中PC的含量高达60%以上,以氯仿-甲醇法提取的大黄鱼鱼卵粗磷脂为原料,分离纯化出纯度达96.34%的鱼卵磷脂酰胆碱(Roe-PC)[9]。试验在前期研究的基础上,为进一步提高大黄鱼鱼卵资源利用水平,在明确鱼卵主要功能组分PC脂肪酸组成信息的基础上,将Roe-PC制备成纳米脂质体,以期更好地提高其生物利用度。主要采用薄膜分散法[10]制备了Roe-PC纳米脂质体,通过噻唑兰染色吸光值法(Methyl thiazolyl tetrazolium value,MTT) 初步探究了其对HepG2细胞的增殖效应,为后续研究Roe-PC对HepG2细胞增殖效应的分子机制奠定前期基础。
1 材料与方法
1.1 试剂与仪器
大黄鱼鱼卵磷脂酰胆碱(Roe-PC),纯度≥95%,自制;胆固醇,中国惠兴生化试剂有限公司提供;氯仿,上海中试化工总公司提供;DMEM培养基、新生牛血清、二甲基桠枫(DMSO),美国Gibco公司提供;胰蛋白酶、MTT,美国Amiresco公司提供;人肝癌HepG2细胞,南京凯基生物科技有限公司提供;其他试剂均为国产分析纯。
RE-52AA型旋转蒸发器,上海亚荣生化仪器厂产品;FCD-270SE型海尔电冰柜,青岛海尔特种电冰柜有限公司产品;SQP型电子天平,赛多利斯科学仪器(北京)有限公司产品;HH-4型数显恒温水浴锅,常州国华电器有限公司产品;680型酶标仪,美国BIO-RAD公司产品;DL-CJ-1N型超净工作台,北京东联哈尔仪器公司产品;Bj5060UV型CO2培养箱,德国Heraeus公司产品;CKX41型倒置显微镜系统,Olympus公司产品。
1.2 试验方法
1.2.1 Roe-PC脂肪酸组成的分析
委托上海市粮油制品质量监督检验站,依据GB/T 17376—2008《动植物油脂脂肪酸甲酯制备》和GB/T 17377—2008《动植物油脂脂肪酸甲酯气相色谱分析》进行分析。
1.2.2 Roe-PC纳米脂质体的制备
将质量比为1∶1.5的胆固醇和Roe-PC用少量的氯仿溶于容积为500 mL的圆底烧瓶中旋转蒸发,旋转蒸发温度不宜过高,一般在30℃左右,得到一层干燥的PLs膜,加入一定量的D-Hanks振荡混匀,然后在超声仪上处理,直到其成为均匀的乳白色悬浊液。通过200 nm的微孔滤膜过滤后,即得到Roe-PC纳米脂质体。
1.2.3 Roe-PC纳米脂质体形态和大小的测定
采用透射电子显微镜观察Roe-PC纳米脂质体的形态,将制得的Roe-PC脂质体滴一滴到碳涂层铜网格,2 min后,用滤纸吸取水分,背景染色,采用1%的硅钨酸盐染色30 s,用滤纸除去多余的硅钨酸盐,采用透射电子显微镜观察干样品,并使用相机拍照[11]。
1.2.4 肝癌细胞的培养
HepG2细胞用含10%胎牛血清的DMEM培养基培养。当细胞达到80%~90%密度时传代,一般3 d传1次,每次1传2,细胞生长稳定、形态良好即可使用。取对数生长期细胞接种于96孔培养板进行试验。所有试验操作均在无菌条件下培养。
1.2.5 MTT法检测Roe-PC纳米脂质体对HepG2细胞增殖活性的影响
将处于对数生长期的HepG2细胞,经0.25%的胰酶消化,用DMEM完全培养基制成密度为2×105mL的细胞悬液,接种于96孔培养板内,100 L/孔。培养24 h后,对照组只加培养液,试验组加入Roe-PC纳米脂质体,使其质量浓度分别为25,50,100,150,200,300,400 g/mL,每组质量浓度设5个平行孔,置于37℃,5%的CO2细胞培养箱内分别培养24,48,72 h。每孔加20 L MTT液,继续培养4 h。随后,弃掉孔内培养上清液,加入二甲基桠枫(DMSO) 150 L/孔,振荡器上振荡溶解5~10 min,使其蓝紫色结晶物完全溶解,用酶标仪测490 nm处OD值,以T(样品组OD值) /C(对照组OD值)表示细胞增殖活性。
1.2.6 数据分析
采用SPSS17.0统计软件对试验数据进行统计学分析。数据以X±S表示,组间比较采用单因素方差分析,p<0.05为差异有统计学意义。
2 结果与讨论
2.1 大黄鱼鱼卵PC脂肪酸组成分析
大黄鱼鱼卵PC的脂肪酸组成分析结果见表1。
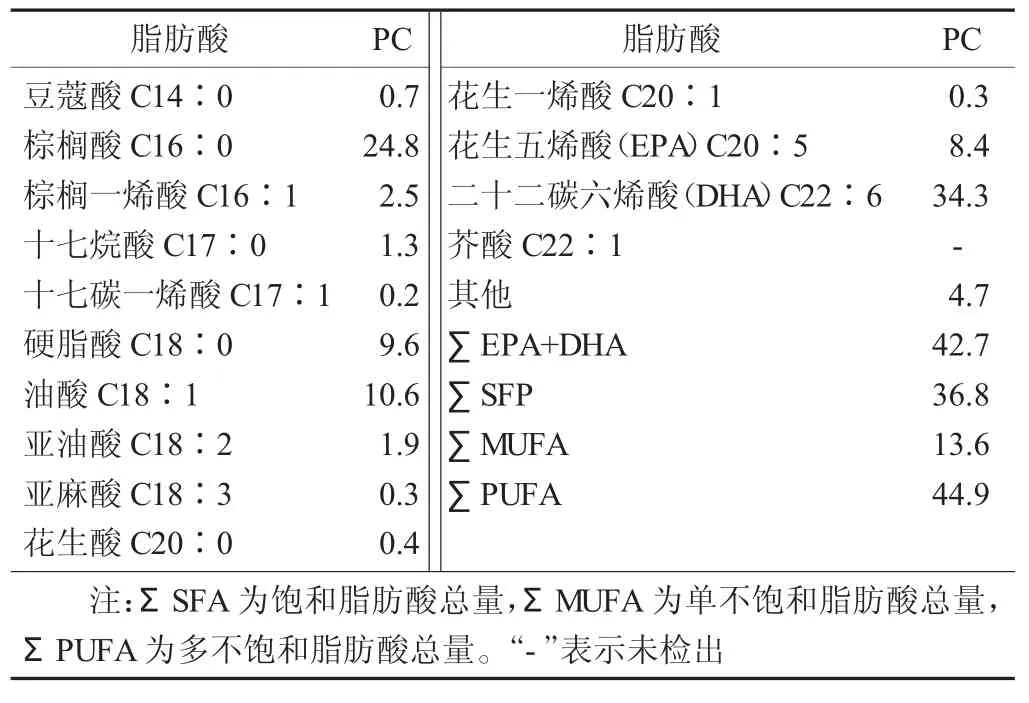
表1 大黄鱼鱼卵PC的脂肪酸组成分析结果/%,n=3
由表1可以看出,在大黄鱼鱼卵PC中检测出13种脂肪酸,碳原子数为14~22,其中饱和脂肪酸(SFA) 5种,单不饱和脂肪酸(MUFA) 4种,多不饱和脂肪酸(PUFA) 4种。SFA主要包括豆蔻酸(C14∶0)、棕榈酸 (C16∶0)、十七烷酸 (C17∶0)、硬脂酸(C18∶0)、花生酸(C20∶0),以棕榈酸(C16∶0)含量为最高,占总脂肪含量的24.8%。对于MUFA而言,在检测到的MUFA中以油酸(C18∶1)含量最为丰富。脂肪酸是鱼类生长发育阶段重要的代谢能源,同时也是鱼类机体重要的内源性营养物质。有研究表明C16∶0,C18∶1脂肪酸是鱼类代谢的主要能量来源,试验结果与该结论一致,即C16∶0,C18∶1在大黄鱼鱼卵PC中含量较高。PUFA方面,PC中PUFA的含量高达44.9%,EPA、DHA占据了主要比例,其中DHA含量达到34.3%,远远高于其他脂肪酸的含量。邹舟等人[12]研究了鲢鱼各部位磷脂的脂肪酸组成,结果表明各部位间EPA+DHA的总量,内脏中明显高于其他部位,其总和为27.12%。孙艳宾[13]研究了太平洋磷虾油脂的提取工艺及其脂肪酸组成,其中EPA+DHA在油脂脂肪酸中含量为31.9%。宫勋等人[14]研究了池沼公鱼肌肉的脂肪酸组成,其中EPA和DHA的含量分别为8.43%和11.85%,其总和为20.28%。由此可以看出大黄鱼鱼卵是富含EPA-PC和DHA-PC的海洋资源,具有很好的开发应用前景。
2.2 Roe-PC纳米脂质体的形态和大小
Roe-PC脂质体的透射电镜形态见图1。
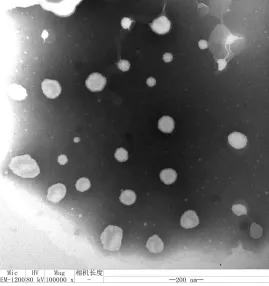
图1 Roe-PC脂质体的透射电镜形态
利用透射电子显微镜观察Roe-PC纳米脂质体的形态。试验经薄膜分散法制备得到的脂质体为乳白色混悬液,在透射电镜下观察,放大1×105倍的Roe-PC纳米脂质体的电镜显示,脂质体分布均匀、颗粒间彼此分散独立、连续成圆形或椭圆形微球体,平均粒径为100 nm。
2.3 Roe-PC脂质体对HepG2细胞增殖活性的影响
MTT比色法的检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性的MTT还原为水不溶性的蓝紫色结晶甲瓒,并沉积在细胞中,而死细胞则无此功能。DMSO能溶解细胞中的结晶,通过酶标仪测定其吸光值,可间接反映活细胞数量[15]。试验将前期纯化所得的Roe-PC制作成纳米脂质体,并配制成不同浓度,检测其在24,48,72 h下对HepG2细胞增殖活性的影响。表2是Roe-PC脂质体处理HepG2细胞后进行MTT测定得到的吸光值,每个质量浓度梯度5个重复。
Roe-PC脂质体质量浓度对HepG2细胞处理不同时间吸光值的影响(X±S) 见表2,Roe-PC脂质体对HepG2细胞增殖活性的影响见图2。
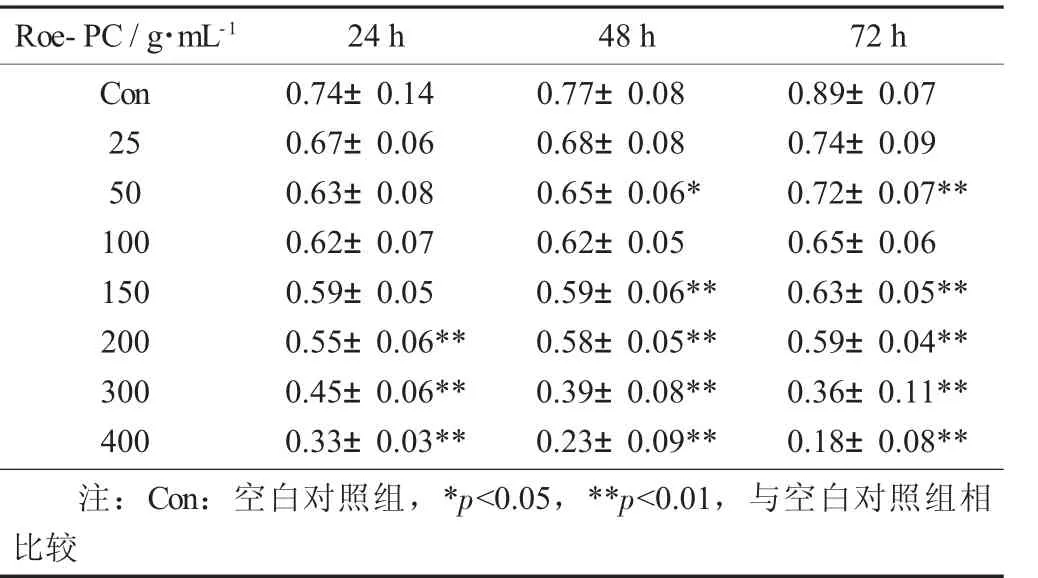
表2 Roe-PC脂质体质量浓度对HepG2细胞处理不同时间吸光值的影响(X±S)
以未添加Roe-PC脂质体处理组为对照组,处理组与对照组比值的百分数即为细胞增殖率,结果进行统计学分析。试验结果表明,不同质量浓度的Roe-PC脂质体处理HepG2细胞24 h后,其增殖活性没有显著变化,当Roe-PC脂质体质量浓度达到200μg/mL时其增殖活性才被显著抑制(0.55±0.06 VS 0.74±0.04,p<0.01),抑制率 (IR) 为 26%;而延长作用时间至48,72 h后,细胞增殖受到了抑制,受试物质量浓度越高,抑制作用越强,且随着作用时间的延长,其抑制作用有增强的趋势,Roe-PC质量浓度为400μg/mL,作用时间为72 h时抑制作用最强 (0.18±0.08 VS 0.89±0.07,p<0.01),其 IR 达到80%。说明Roe-PC脂质体对HepG2细胞的增殖抑制作用具有时效和量效的关系。同时说明Roe-PC脂质体有抑制癌细胞增殖的作用,但需要一定的作用时间后才能发挥效果。
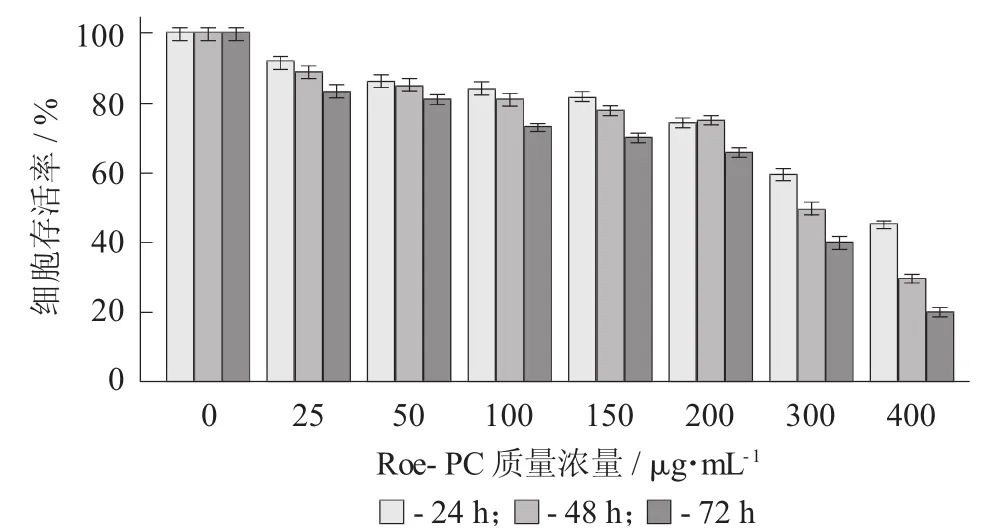
图2 Roe-PC脂质体对Hep G2细胞增殖活性的影响
2.4 Roe-PC脂质体对HepG2细胞形态学的影响
Roe-PC脂质体处理HepG2细胞72 h后的形态学变化见图3。
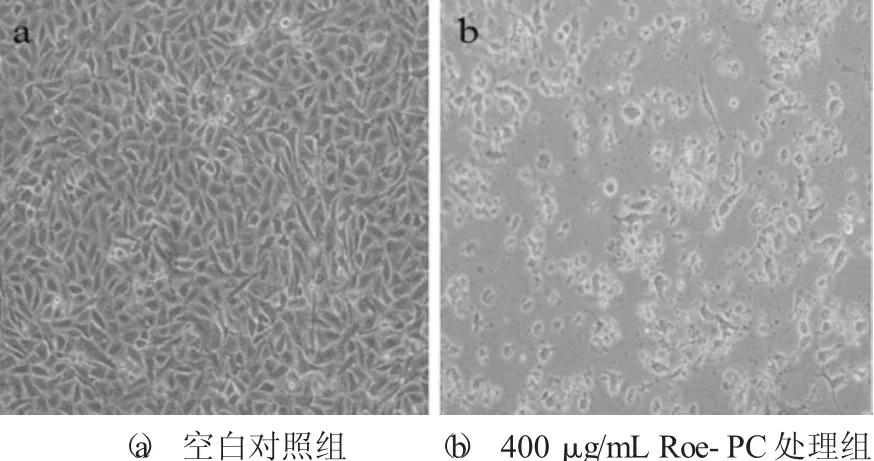
图3 Roe-PC脂质体处理HepG2细胞72 h后的形态学变化
为了更直观地观察Roe-PC脂质体对HepG2细胞的抑制作用,在显微镜下观察未处理和400μg/mL Roe-PC脂质体处理后的HepG2细胞,二者都培养72 h,倒置显微镜观察并拍照。由图3可知,正常对照组细胞呈汇合生长且贴壁性好,细胞轮廓清晰、密度大,相互排列紧密,连接成大片,细胞生长旺盛;Roe-PC脂质体处理后的细胞数量显著下降,并且收缩呈圆形,部分细胞脱落至培养液中,表明其生长与活力被显著抑制。
3 讨论
试验以大黄鱼鱼卵中获得的PC为研究材料,首先分析了其脂肪酸组成信息,结果发现PUFA的含量高达44.9%,而且EPA,DHA占据了主要组成比例,其中DHA含量更是高达34.3%,远远高于其他脂肪酸的含量。进一步采用薄膜分散法获得了100 nm级的脂质体,并对其形态进行了表征。在此基础上,初步开展了Roe-PC脂质体对细胞增殖活性方面的研究,试验结果说明Roe-PC脂质体对HepG2细胞的增殖具有一定的抑制作用。
根据文献报道,DHA对于肿瘤细胞的生长抑制作用在许多细胞试验和动物模型中得到了证实[16-19]。DHA能抑制直肠癌、前列腺癌、乳腺癌等多种肿瘤细胞的增殖,并诱导其凋亡。孙思楠[20]研究了不同浓度的DHA对人肝癌细胞株Bel-7402细胞增殖及细胞凋亡的影响。结果表明,DHA可抑制人肝癌细胞Bel-7402的增殖并诱导细胞早期凋亡,且呈时间-剂量依赖性。李群珍等人[21]以人肝癌HepG2细胞为研究对象,检测了DHA联合5氟尿嘧啶(5-FU)的体外抗肿瘤作用。结果表明,DHA联合5-FU可抑制肝癌细胞的增殖并诱导其凋亡,二者具有协同作用。Chapkin R S等人[22]研究发现,DHA可通过改变生物膜的结构和功能来抑制肝癌HepG2细胞的增殖。多不饱和脂肪酸是构成生物膜结构的脂肪酸,肿瘤细胞膜DHA比例升高导致线粒体膜电位下降,细胞呼吸链受损,膜通透性增加,使细胞凋亡诱导因子得以释放,半胱氨酸蛋白酶的级联反应得以进行,导致细胞凋亡。同样,EPA对于肿瘤细胞的生长也具有一定的抑制作用。王占有[23]研究了不同浓度的EPA对人肝癌细胞株HepG2细胞增殖活性的影响。结果表明,一定浓度的EPA对HepG2细胞的生长具有明显的抑制作用,且随作用时间的延长抑制率增加。其作用机制可能与其影响肝癌细胞脂质过氧化有关。盛虹[24]研究发现,EPA能够抑制胃癌细胞的增殖并具有浓度依赖性,但无时间依赖性。
试验所获得的PC主要与DHA协调发挥效果,但其具体机制尚不明确,有待今后更进一步的研究。此外,Roe-PC脂质体在体外的稳定性如何还需要进行深入的研究和分析。为今后开发Roe-PC脂质体保健功能食品提供更为全面的科学依据。
4 结论
大黄鱼鱼卵PC富含DHA和EPA,以鱼卵中纯化所得的PC为材料,采用薄膜分散法制备了Roe-PC纳米脂质体,以人肝癌HepG2细胞为研究对象,进行体外抗肿瘤试验,通过MTT法测定了Roe-PC纳米脂质体对HepG2细胞增殖活性的影响。结果表明,Roe-PC纳米脂质体对HepG2细胞的生长抑制作用具有时效和量效的关系。研究结果对鱼卵磷脂资源利用和进一步深入研究其中的分子机制奠定了前期基础。
[1]Bekhit AE-DA,Morton J D,Dawson C O,et al.Optical properties of raw and processed fish roes from six commer-cial New Zealand species[J].Journal of Food Engineering,2009(2):363-371.
[2]袁利鹏,刘波,熊波,等.大豆磷脂的制备、功能特性及行业应用研究进展 [J].中国酿造,2013,32(5):13-15.
[3]Hosokawa M,Takahashi K,Hou CT.Handbook of industrial biocatalysis[M].Boca Raton:CRC Press,2005:13-15.
[4]Rossmeisl M,Medrikova D,Van Schothorst E M,et al.Omega-3 phospholipids form fish suppress hepatic steatosis by integrated inhibition of biosynthetic pathways in dietary obese mice[J].Biochimica et Biophysica Acta(BBA) -Molecular and Cell Biology of Lipids,2014 (2):267-278.
[5]胡世伟,王静凤,徐雷雷,等.海参磷脂型二十碳五烯酸降血糖机制研究 [J].深圳大学学报(理工版),2013,30(4):349-355.
[6]崔洁,刘小芳,董喆,等.DHA-磷脂对肥胖小鼠脂质代谢的影响 [J].中国油脂,2014(1):27-31.
[7]梁鹏,许艳萍,程文健,等.大黄鱼鱼卵磷脂对小鼠脂质代谢的调节作用 [J].现代食品科技,2016(11):1-7.
[8]杜阳吉.大豆粗磷脂中磷脂酰胆碱的分离纯化研究 [J].中国食品添加剂,2014(4):86-91.
[9]程新伟,梁鹏,孙鹤,等.大黄鱼鱼卵磷脂酰胆碱的分离纯化 [J].福建农林大学学报(自然版),2017,46(2):228-233.
[10]邓莹.多柔比星脂质体的制备研究及表征 [D].南京:东南大学,2010.
[11]Gharib R,Greigegerges H,Jraij A,et al.Preparation of drug-in-cyclodextrin-in-liposomes at a large scale using a membrane contactor:application to trans-anethole[J].Carbohydrate Polymers,2016 (4):276-285.
[12]邹舟,王琦,于刚,等.鲢鱼各部位磷脂组分及脂肪酸组成分析 [J].食品科学,2014,35(24):105-109.
[13]孙艳宾,刘云,陈洪基,等.太平洋磷虾油脂提取工艺及其脂肪酸成分分析 [J].中国酿造,2014,33(12):68-71.
[14]宫勋,李红今,张莉,等.池沼公鱼肌肉中脂肪酸成分的GC-MS分析 [J].吉林化工学院学报,2013,30(11):93-95.
[15]李慧.杜仲木脂素对HepG2细胞甘油三酯聚集的影响[D].长沙:中南大学,2013.
[16]Jude S, Roger S, Martel E, et al.Dietary long-chain omega-3 fatty acids of marine origin:a comparison of their protective effects on coronary heart disease and breast cancers[J].Prog Biophys Mol Biol,2006 (1/3):299-325.
[17]Kelavkar U P,Hutzley J,Dhir R,et al.Prostate tumor growth and recurrence can be modulated by theω-6:ω-3 ratio in diet:athymic mouse xenograft model simulating radical prostatectomy[J].Neoplasia,2006,8 (2):112-124.
[18]Shirota T, Haji S, Yamasaki M, et al.Apoptosis in human pancreatic cancer cells induced by eicosapentaenoic acid[J].Nutrition,2005,21(10):1 010-1 017.
[19]Chen Z Y,Istfan N W.Docosahexaenoic acid is a potent inducer of apoptosis in HT-29 colon cancer cells[J].Prostaglandins Leukot Essent Fatty Acids,2000,63 (5):301-308.
[20]孙思楠.DHA对人肝癌细胞凋亡和侵袭力的影响及其机制研究 [D].合肥:安徽医科大学,2013.
[21]李群珍,邓红,张茂祥,等.二十二碳六烯酸联合5氟尿嘧啶对人肝癌细胞HepG2增殖的抑制作用 [J].现代消化及介入诊疗,2013(4):243-245.
[22]Chapkin R S,Hong M Y,Fan Y Y,et al.Dietaryω-3 PUFA alter colonocyte mitochondrial membrane composition and function[J].Lipids,2002,37 (2):193-199.
[23]王占有.ω-3多不饱和脂肪酸诱导人肝癌细胞HepG2凋亡及其分子机制的研究 [D].洛阳:河南科技大学,2010.
[24]盛虹.ω-3多不饱和脂肪酸对胃癌细胞生长的影响及其机制研究 [D].上海:上海交通大学,2012.◇
