普洱茶、红茶、绿茶中真菌毒素的检测
2018-01-29王鹭杨骅谢国祥贾伟
王鹭+杨骅+谢国祥+贾伟
[摘要] 检测茶叶中黄曲霉毒素(B1,B2,G1和G2)、伏马霉素(FB1, FB2, FB3)和脱氧雪腐镰刀菌烯醇,明确茶叶中的真菌毒素含量范围并为茶叶监管提供依据。采用有机溶剂(0.1%甲酸乙腈溶液)以及80 ℃热水2种方法提取茶叶中的真菌毒素,利用超高效液相色谱串联质谱(UPLC-MS/MS)法进行分析测定。黄曲霉毒素B1,G1的线性范围为39.1~5 000 ng·L-1,黄曲霉毒素B2,G2的线性范围为 117~15 000 ng·L-1;伏马霉素(FB1, FB2, FB3)的线性范围为2.44~313 ng·L-1;脱氧雪腐镰刀菌烯醇的线性范围为3 125~5 000 ng·L-1。所得8种真菌毒素的回归方程均有良好的线性关系 (r≥0.999 0),回收率为85.7%~99.6%,相对标准偏差<10%。对20种国际市售茶叶中的8种真菌毒素进行测定,结果显示采用有机溶剂提取法,包括普洱茶、红茶、绿茶在内的多种茶叶产品都不同程度含有微量的真菌毒素,其中黄曲霉毒素B2在6种茶叶产品中被检测到,黄曲霉毒素G1在3种茶叶中被检测到,伏马霉素FB1在2种茶叶中被检测到,伏马霉素FB2在一种茶叶中被检测到。而采用热水提取方法,只有一种茶叶产品的茶汤中检测到微量的伏马霉素B1,B2,其他各种茶叶的茶汤中均未检出毒素。以上2种方法检出的真菌毒素含量在0.15~7.31 μg·kg-1,均未超过国际食品安全规定的真菌毒素限量。80 ℃热水提取模拟实际的饮茶方法,更能准确地检测茶叶中进入茶汤的真菌毒素,适用于茶叶(采用热水冲泡的)饮用产品,而有机溶剂萃取法适用于食用产品中霉菌毒素绝对含量的检测。
[关键词] 黄曲霉毒素; 伏马霉素; 脱氧雪腐镰刀菌烯醇; 液质联用; 普洱茶; 红茶; 绿茶
[Abstract] To establish a robust method for the determination of mycotoxins in tea samples, and to provide means for the quality and safety control of tea products. Samples of 20 tea products acquired from international market were extracted by organic solvents (acetonitrile containing 0.1% formic acid) or hot water, respectively. The extracts were analyzed by UPLC-MS/MS.A good linear regression was achieved in a range of 39.1 to 5 000 ng·L-1for aflatoxin B1 (AFB1) and aflatoxin G1 (AFG1), 117 to 15 000 ng·L-1 for aflatoxin B2 (AFB2) and aflatoxin G2 (AFG2), 2.44 to 313 ng·L-1for fumonisin B1 (FB1), fumonisinB2 (FB2) and fumonisin B3 (FB3), and 3 125 to 5 000 ng·L-1for deoxynivalenol, with recovery rates between 85.7% and 99.6%. The coefficient of the linear equation for all standards was greater than 0.999 0, and the RSD value was less than 10%. Mycotoxins were detected in several tea samples using the two extraction methods but with different outcomes. The levels of mycotoxins detected ranging from 0.15 to 7.31 μg·kg-1 were well below the State or US FDA regulation limits of mycotoxins in food products. Both methods are simple, accurate, and sensitive, and thus, suitable for the quantitative determination of mycotoxins in different food products. The method with the 80 ℃ hot-water extraction is more appropriate to determine the trace amounts of mycotoxins in tea leaves that are likely to be present in brewed tea liquor, while organic solvent method is more suitable for the detection of mycotoxins in ingestible foods.
[Key words] aflatoxins; fumonisins; deoxynivalenol; UPLC-MS/MS; pu-erh tea; black tea; green tea
中國是茶的故乡和茶文化的发源地,茶的发现和利用在中国已有数千年的历史,唐代陆羽《茶经》中认为最早利用茶的是神农氏—— “茶之饮,发乎神农”。传说中“神农尝百草,日遇七十二毒,得茶而解之,”从那时起古人就知道饮茶可健身,有治病之疗效。到了近代,随着科技的进步、研究方法的不断改进,人们发现茶叶中含有很多活性成分,包括茶多酚、咖啡因、黄酮、三萜及其苷类等,这些活性成分具有预防心血管疾病、降血脂、降血压、抑菌、调节血糖以及防治神经退行性疾病等多种功效[1-3]。endprint
中国出产的名茶众多,其中绿茶、红茶和普洱茶是国内市场最受欢迎的茶叶品类[4]。同时中国也是茶叶的产销大国,很多茶叶品种尤其是发酵茶如普洱茶在生产加工和保存过程中,存在真菌毒素污染的可能。黄曲霉毒素(aflatoxins, AF)是由黄曲霉和寄生曲霉代谢产生的一类结构类似的化合物,是一种天然存在的最强致癌物之一,主要有B1, B2, G1, G2 4种,又以B1的毒性最强[5]。伏马菌素(fumonisins, FB)是最近发现的、由串珠镰刀菌等产生的一种新型、强毒性的生物毒素,主要包括FB1,FB2,FB3。伏马霉素同黄曲霉素一样,广泛存在于各种农作物和农作物副产品中,对人体健康有很大的潜在危害并且会导致肝癌,还可能诱发其他脏器癌变[6]。脱氧雪腐镰刀菌烯醇(deoxynivalenol) 同样也是最常见的一类污染性真菌毒素,食用低剂量的脱氧雪腐镰刀菌烯醇会引起食欲下降、呕吐等症状[7] 。因此,严格控制茶叶中的真菌毒素含量与百姓的安全健康息息相关。
目前真菌毒素的检测方法主要有酶联免疫吸附法[8]、免疫亲和净化-HPLC[9-11]、免疫亲和柱色谱-酶联免疫吸附法(ELISA)[12-13]、液相色谱-串联质谱法(LC-MS/MS法)[14-19]。酶联免疫吸附法、免疫亲和色谱-HPLC、免疫亲和柱色谱-酶联免疫吸附法(ELISA)等受茶叶中茶多酚和茶色素的干扰,在测定真菌毒素时产生“假阳性“结果。液相色谱-质谱联用技术,具有灵敏度高、选择性好、多种组分同时检测等技术優点, 当前广泛应用于食品中真菌毒素检测[20]。基于此,本研究采用超高效液相色谱串联质谱法对包括普洱茶、红茶、绿茶在内的20种国际市售茶叶中黄曲霉毒素B1, B2, G1, G2,伏马霉素FB1, FB2, FB3和脱氧雪腐镰刀菌烯醇(deoxynivalenol)进行检测。
除了采用常规的有机溶剂萃取的方法对茶叶中的真菌毒素进行提取,本研究还模拟实际的饮茶方法采用80 ℃热水分不同的时间段进行提取,更能准确地检测茶叶中进入茶汤的霉菌毒素。从而为明确茶叶中的霉菌毒素含量,加强茶叶卫生管理、制定相关卫生标准提供了更全面的技术基础和资料。
1 材料
AcquityTM超高效液相色谱仪和XevoTM TQ-MS质谱仪器(美国Waters 公司);Allegra X-15R 和Microfuge 22R 离心机(美国Beckman Coulter公司);Multi-THERM型冷却/加热振荡器(美国Benchmark Scientific公司);I24 振荡器(英国New Brunswick Scientific公司);冻干机(美国Labconco公司), XP105DR 型1/10万电子分析天平(瑞士Mettler公司);氮气发生器(Peak Scientific);Milli-Q超纯水处理系统。
黄曲霉毒素混合对照品(黄曲霉毒素 B1, B2, G1, G2)购于美国 Sigma公司(批号A0263);对照品伏马菌素 B1(批号 62580)、伏马菌素 B2(批号 13227)、伏马菌素 B3(批号 20434)、脱氧雪腐镰刀菌烯醇(批号11428)均购于美国Cayman公司;色谱纯甲醇、乙腈、甲酸、二甲基亚砜(美国Sigma公司);水为高纯水;氯化钠(纯度>99.9%)、硫酸镁(美国Fisher 公司);C18硅胶(60A级)购于美国Sorbtech公司。本研究所检测茶叶样本为随机抽取的国际茶叶市场共20种茶叶样品,其中有8种茶叶购自日本茶商LUPICIA。
2 方法与结果
2.1 色谱条件
色谱柱为UPLC ACQUITY BEH C18柱(2.1 mm×100 mm,1.7 μm),流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈(B),梯度洗脱(0~3.0 min,10%B;3.0~10 min,10%~70% B;10~10.1 min,70%~10% B;10.1~13 min,10% B),流速0.4 mL·min-1,柱温40 ℃,进样量5 μL。
2.2 质谱条件
电喷雾离子源(ESI)正离子模式;多反应检测模式(MRM);毛细管电压1.0 kV;脱溶剂气温度400 ℃;锥孔流速150 L·h-1;脱溶剂气流速600 L·h-1。其他质谱参数见表1。混合对照品的典型色谱图见图1。
2.3 溶液的制备
2.3.1 对照品溶液
精密称取上述8种对照品适量,加甲醇定容至刻度,摇匀,制成质量浓度均为1.0 g·L-1的对照品储备液。精密量取各对照品储备液适量置于同一量瓶中,定容至刻度,制得质量浓度均为1.0 mg·L-1的混合对照品储备液。以甲醇稀释成系列质量浓度的对照品溶液。
2.3.2 样品处理
2.3.2.1 有机相萃取 称取粉碎后的样品0.3 g 于50 mL具塞离心管中,加入10 mL 乙腈-0.2%甲 酸水(1∶1),超声提取30 min。之后加入2.0 g硫酸镁和0.5 g氯化钠,涡旋5 min,4 000 r·min-1离心10 min。吸取2.0 mL上清液至5.0 mL 具塞离心管中,加入0.1 g C18硅胶和0.3 g硫酸镁,涡旋5 min,4 000 r·min-1离心10 min,吸取1.0 mL上清液至另一试管中,再加入200 μL二甲基亚砜,氮气吹干,加入800 μL甲醇复溶,涡旋振荡30 s,经0.22 μm滤膜过滤,供检测使用。
2.3.2.2 水相萃取 考虑到日常泡茶、饮茶习惯,采用如下2种热水提取方法进行茶叶中毒素的萃取检测。①称取粉碎后的样品1.0 g于50 mL具塞离心管中,加入20 mL 80 ℃热水。在0.5,1,3,6,12 h后,分别吸取1.2 mL的样品溶液到1.5 mL的离心管中,使用4 000 r·min-1离心10 min,再分别吸取1.0 mL上清液至1.5 mL 离心管中,冷冻干燥后加入800 μL甲醇溶解,涡旋振荡30 s,离心后上清液供检测使用。②称取粉碎后的样品1.0 g于50 mL具塞离心管中,加入20 mL 80 ℃热水。在0.5,1,3,6,12 h后,分别吸取1.2 mL的样品溶液到1.5 mL的离心管中。每一时间点均弃去剩余水溶液,并重新加入20 mL 80 ℃热水。水提液经4 000 r·min-1离心10 min,再分别吸取1.0 mL上清液至1.5 mL 离心管中,冷冻干燥后加入800 μL甲醇溶解,涡旋振荡30 s,离心后上清液供检测使用。endprint
2.4 线性关系检测限和定量限考察
分别精密吸取混合对照品溶液适量,加甲醇溶液稀释至不同质量浓度,涡旋,制得系列混合对照品溶液,分别取以上混合对照品溶液按2.1和2.2项下色谱与质谱条件进行测定。以对照品质量浓度为横坐标(X)峰面积为纵坐标(Y),绘制标准曲线。用加权最小二乘法(W=1/x2)计算回归方程。以0.3 g茶叶样本计算得到有机相萃取和1.0 g茶叶样本计算得到的水相萃取的定量下限见表2。
2.5 加样回收率考察
取上述8种真菌毒素未检出的空白茶叶样品,平行取6份,加入混合标准溶液,按2.3.2项样品处理方法制备样品并进行回收测定,得到本实验的平均回收率和精密度,见表3。
2.6 样品测定
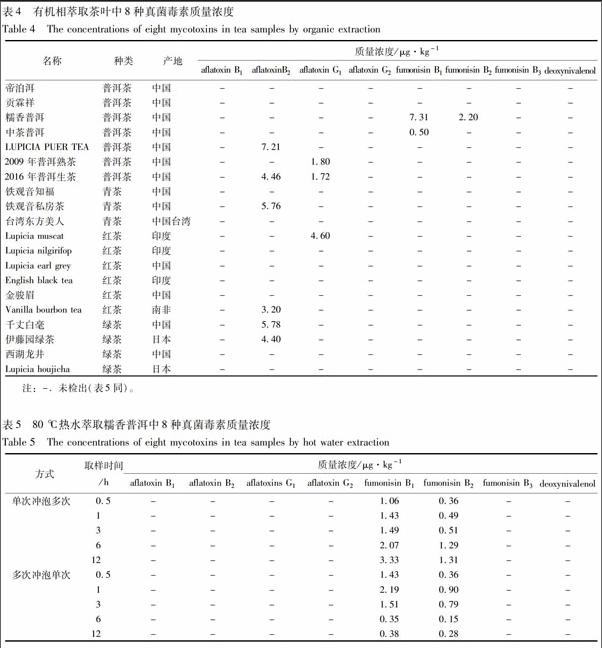
采用2.3.2项方法处理茶叶样本,在上述仪器测定条件下对20种茶叶进行测定。将样本中检测到的真菌毒素的峰面积代入表2 方程,计算得到样本中真菌毒素的实际浓度。有机相萃取结果见表4, 在6种茶叶中检测到黄曲霉毒素B2,在3种茶叶中检测到黄曲霉毒素G1,在2种茶叶中检测到伏马霉素B1和在1种茶叶中检测到伏马霉素B2。水提取样本中,仅一种茶叶(糯香普洱)检出伏马霉素B1以及伏马霉素 B2,结果见表5,其余样本均未检出。
3 讨论
本实验建立的定量分析茶叶中8种真菌毒素UPLC-MS/MS方法,在其各自的质量浓度范围内,线性良好,所有测定样品的准确度,回收率等均满足定量分析要求。
对市售的20种茶叶样本进行测定,采用有机溶剂提取,在2种普洱茶,3种绿茶和1种红茶中检出 了黄曲霉毒素B2;2种普洱茶和1种红茶中检出了黄曲霉毒素G1;2种普洱茶中检出了伏马霉素B1以及1种普洱茶中检出了伏马霉素B2。其中毒性最强的黄曲霉毒素B1并未检测到,普洱茶产品并不比 其他的茶叶(红茶、绿茶等)产品含有更多的霉菌毒素。而水相提取样本除在1种糯香普洱产品中检出微量的(0.15~3.33 μg·kg-1)伏马霉素B1和B2以外,其余所测样本中8种真菌毒素均未检出。采用80 ℃热水提取模拟实际的饮茶方法(单次冲泡和多次冲泡茶叶取样),能更准确地检测茶叶中进入茶汤的霉菌毒素,而有机溶剂萃取法更适合检测食品中的霉菌毒素的含量。
美国食品药品监督管理局以及中国国家标准GB2761《食品中真菌毒素限量》中规定食品、玉米、玉米制品、花生、花生制品中的黄曲霉素限量标准为20 μg·kg-1[21-22];脱氧雪腐镰刀菌烯醇在玉米、玉米面、大麦、小麦中的限量為1 000 μg·kg-1[9];伏马菌素欧盟限定标准为玉米和玉米制品中不得超过1 000 μg·kg-1[23]。从上述限量标准来看,黄曲霉毒素毒性最强,控制得最严。本研究所采用的2种方法对20种市售茶叶产品所检出的几种霉菌毒素含量在0.15~7.31 μg·kg-1,均未超过相关食品安全规定的真菌毒素限量。
黄曲霉毒素具有很高的脂溶性,难溶于水,茶叶受到黄曲霉菌污染,所含有的毒素只有少量会在冲泡过程中进入茶汤。饮茶是用开水泡茶,饮用的是茶汤,与玉米、花生等粮食在食用方法(后者全部入口)和用量上(前者几克,后者往往数百克)相比有着根本的差异,所以评价饮茶中摄入的霉菌毒素不应该采用粮食中检测毒素的有机溶剂提取方法。事实上有人用有机溶剂提取法对西班牙超市中售卖的多种咖啡样本进行分析,检测出多种霉菌毒素,其中有的超标很高[14]。所以食品安全评价中的分析方法不当,会夸大问题,引起大众不必要的恐慌。
另外,包括黄曲霉菌在内的常见寄生霉菌,广泛存在于生长温度为25~40 ℃的温暖地区,因此位于热带地区或者常温条件下的实验室也容易受到污染,在食品分析过程中对于实验设备、材料、试剂等排除微量霉菌的污染,从而保证高灵敏的分析仪器不受干扰,也是一个容易忽视却又非常重要的质量控制环节。
[参考文献]
[1] 赵龙飞, 周红杰, 安文杰. 云南普洱茶保健功效的研究[J]. 食品研究与开发, 2005, 26(2):114.
[2] 余鹏辉, 袁沛, 童杰文. 红茶对人类疾病防治功效研究进展[J]. 茶叶通讯, 2014, 41(3):8.
[3] 李丽, 许利嘉, 彭勇,等. 绿茶与其他4种别样茶的比较[J]. 中国中药杂志, 2011, 36(1):5.
[4] 陈小强, 叶阳, 成浩,等. 三类茶中茶氨酸、咖啡碱及多酚类的比较分析[J]. 食品研究与开发, 2007, 28(12):141.
[5] Carnaghan R B, Hartley R D, O′Kelly J. Toxicity and fluorescence properties of the aflatoxins [J]. Nature, 1963, 200(4911):1101.
[6] 金海涛, 陈道付, 李绍钰. 伏马菌素的毒性作用研究[J]. 饲料工业, 2007, 28(20):55.
[7] 霍星华, 赵宝玉, 万学攀,等. 脱氧雪腐镰刀菌烯醇的毒性研究进展[J]. 毒理学杂志, 2008, 22(2):151.
[8] 冯翀. 食品中真菌毒素检测分析——以酶联免疫吸附法(ELISA)为例 [J]. 中国科技博览, 2011(36):264.
[9] 刘丽娜,李耀磊,金红宇,等. 免疫亲和净化HPLC柱后光化学衍生荧光法测定动物药中黄曲霉毒素 [J].中草药, 2017,48(6):1220.
[10] 李佐卿,谢东华,孙大为,等.免疫亲和柱HPLC荧光检测酒中黄曲霉毒素B1、B2、G1、G2[J].光谱实验室,2001,18(1):28.
[11] 黎睿, 谢刚, 王松雪. 高效液相色谱法同时检测粮食中常见8种真菌毒素的含量[J]. 食品科学, 2015, 36(6):206.endprint
[12] 陈旭明, 李婷. 酶联免疫吸附结合免疫亲和柱-高效液相色谱法检测大米中黄曲霉毒素B1的研究[J]. 包装与食品机械, 2016(6):68.
[13] 张羽, 唐亚芳, 王烨旻. 免疫亲和柱净化高效液相色谱法与酶联免疫吸附法测定小麦中脱氧雪腐镰刀菌烯醇[J]. 粮食与油脂, 2016, 29(6):78.
[14] García-Moraleja A, Font G, Maes J, et al. Simultaneous determination of mycotoxin in commercial coffee[J]. Food Control, 2015, 57:282.
[15] Campbell K, Cavalcante A L F, Galvin-King P, et al. Evaluation of an alternative spectroscopic approach for aflatoxin analysis: comparative analysis of food and feed samples with UPLC–MS/MS [J]. Sensor Actuat B-Chem, 2017, 239:1087.
[16] Ediage E N, Poucke C V, Saeger S D. A multi-analyte LC-MS/MS method for the analysis of 23 mycotoxins in different sorghum varieties: the forgotten sample matrix [J]. Food Chem, 2015, 177:397.
[17] Flores-Flores M E, González-Peas E. An LC-MS/MS method for multi-mycotoxin quantification in cow milk [J]. Food Chem, 2017, 218:378.
[18] Andrade P D, Dantas R R, Caldas E D. Determination of multi-mycotoxins in cereals and of total fumonisins in maize products using isotope labeled internal standard and liquid chromatography/tandem mass spectrometry with positive ionization [J]. J Chromatogr A, 2017:138.
[19] Al-Taher F, Cappozzo J, Zweigenbaum J, et al. Detection and quantitation of mycotoxins in infant cereals in the U.S. market by LC-MS/MS using a stable isotope dilution assay [J]. Food Control, 2017, 72:27.
[20] 宋卫得, 苏征, 惠希东,等. 液质联用技术在食品真菌毒素检测中的研究进展[J]. 食品工业科技, 2016, doi:10.13386/j.issn1002-0306.2016.17.070.
[21] 食品安全國家标准食品中真菌毒素限量. GB2761[S]. 2011.
[22] FDA. FDA Mycotoxin Regulatory Guidance: a guide for grain elevators, feed manufacturers,grain processors and exporters[S]. 2011.
[23] Commission Regulation (EC). Laying down the methods of sapling and analysis for the official control of the levels of mycotoxins in food stuffs [S].2006.
[责任编辑 丁广治]endprint
