高皂苷人参株系早期筛选的研究
2018-01-29郝丽珊郜玉钢臧埔赵岩何忠梅祝洪艳杨鹤刘双利柳靖婷张连学
郝丽珊+郜玉钢+臧埔+赵岩+何忠梅+祝洪艳+杨鹤+刘双利+柳靖婷+张连学

[摘要] 通过PCR引物检测人参DNA特异性片段,快速、准确的评价低龄人参种质质量,加快人参育种进程。该研究基于个体之间的基因差异,设计7对引物,通过比对不同人参DNA的扩增图谱与皂苷含量相关性,成功得到一对特异性引物GC1,并采用L16(45)正交试验优化其25 μL PCR体系,各组分最佳配比为:DNA 2.60 mg·L-1,Mg2+ 1.44 mmol·L-1,dNTP 0.19 mmol·L-1,引物0.32 μmol·L-1,Taq 0.076 U·μL-1。对GC1引物进行验证,在24株供试人参中有2株扩增出1 200 bp特异性条带阳性样品,2株阳性样品中9种单体皂苷及其加和值含量均较高。该特异性条带序列与甘油-3-磷酸脱氢酶同源性达99%。GC1可以作为一种高皂苷人参株系早期筛选鉴定方法的特异性引物,有利于加快人参育种进程。
[关键词] 人参育种; PCR; 引物筛选; 体系优化
[Abstract] The study aims at screening the specific bands by PCR, quickly and accurately evaluating the quality of ginseng seeding, accelerating the process of ginseng breeding. Based on the correlation of genetic differences and saponin content between individuals, a pair of specific primer GC1 was screened by PCR. According to the experiment by L16 (45) orthogonal test, a PCR system most suitable for GC1 was established, which came out total 25 μL reaction system containing DNA 2.60 mg·L-1, Mg2+ 1.44 mmol·L-1, dNTP 0.19 mmol·L-1, primer 0.32 μmol·L-1and Taq enzyme concentration 0.076 U·μL-1. By comparing the saponin content and the GC1 PCR electrophoretogram of samples, the ginseng, with 1 200 bp specific band by PCR of GC1, the contents of 9 monosodium saponins and their additions were higher than others, which provided a reliable method for accelerating the process of ginseng breeding. The sequence was sequenced and 99% homologous to glycerol-3-phosphate dehydrogenase.
[Key words] ginseng breeding; PCR; primer screening; system optimization
人参皂苷具有多种生理、药理功能,其含量是衡量人参品质、培育新品种的重要指标之一。但其含量很低,稀有皂苷含量更低,而且尚未实现全化学合成,严重限制了人参的开发和应用。长久以来,培育高皂苷含量的新人参品种,是解决该问题的有效途径,然而由于人参世代间隔长的原因,传统的人参育种方法存在周期长,人力、物力消耗大等不足。本研究在前期的研究基础之上,筛选高皂苷株系的特异性引物,优化PCR体系,通过检测人参特异性DNA片段的有无,从而快速、准确的评价低龄人参种质质量,为建立人参优良品种早期筛选先进方法提供依据,从而加快育种进程。
1 材料
2016年9月中旬,于吉林农业大学药植园随机采取48株四年生种植人参,样品所处环境和管理条件均相同,24株用于特异基因筛选方法建立,24株用于特异基因筛选方法验证。
植物基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒均购自Tiangen公司;PCR试剂均购自Takara公司;乙腈、甲醇均为色谱纯;水为去离子水;其余试剂为分析纯。
Infinite M200PRO连续波长多功能酶标仪、安捷伦Sure Cycler 8800梯度PCR仪、电泳仪DYY-6B(北京六一仪器厂)、英国SYNGEN GGM/D2凝胶成像系统、日本岛津AUY220电子分析天平、日本岛津LC-2010A高效液相色谱仪(LC-2010A型液相色谱泵、LC-2010A 型自动进样器、CLASS-vP色谱工作站)。
2 方法
2.1 引物的设计 根据实验室前期工作基础,使用Primer 5设计7对引物[1],引物序列见表1,由大连宝生物合成。
2.2 DNA的提取及检测 用蒸馏水洗去供试人参表面泥土,然后用70%乙醇进行表面消毒,再用无菌水冲净,最后用冻干机干燥,分别无菌条件下单株粉碎,随机编号。按照试剂盒说明提取24株供试人参基因组DNA,酶标仪检测所得DNA质量和浓度,稀释至50 mg·L-1,1%琼脂糖凝胶电泳,-20 ℃保存。
2.3 特异性引物筛选 按说明书依次加入PCR Mix,ddH2O,人参DNA和上下游引物混匀得25 μL体系,反应程序[2]:94 ℃预变性4 min;前5个循环在94 ℃變性1 min,45 ℃复性1 min,72 ℃延伸10 s;接下来的30个循再94 ℃变性1 min,55 ℃复性1 min,72 ℃延伸10 s;循环结束72 ℃延伸5 min。0.1%琼脂糖凝胶电泳观察。精确称取各株人参粉末1.00 g,参照文献测定供试人参16种皂苷[3],结果运用SPSS 19.0进行方差分析(P<0.05)。对比结果,筛选特异性引物。endprint
2.4 特异性引物PCR反应体系的优化 以回收2.3特异性条带为优化模板DNA,对模板DNA、引物、dNTP、Mg2+和Taq酶5个因素的适宜浓度进行优化[4-6],具体见表2,PCR反应程序同上。
采用L16(45)正交试验确定该PCR反应体系5个因素的最优组合,每个因素依据单因素试验结果设定4个水平。正交试验水平信息见表3。
2.5 特异性引物PCR反应验证 根据优化的PCR体系对另24株供试人参基因进行扩增,电泳检测结果。测定和分析各株人参皂苷,方法同2.3,验证引物的准确性。
2.6 特异性片段测序与分析 使用凝胶回收试剂盒回收特异性条带,并送往TKARA公司进行测序。测序结果与NCBI数据库进行同源性比对。
3 结果与分析
3.1 DNA提取 供试人参DNA经1%琼脂糖凝胶电泳检测,条带清晰,见图1。经酶标仪检测,DNA样品A260/A280均在1.8~2.0,说明所提DNA完整性好,纯度较高,可作为PCR的模板。
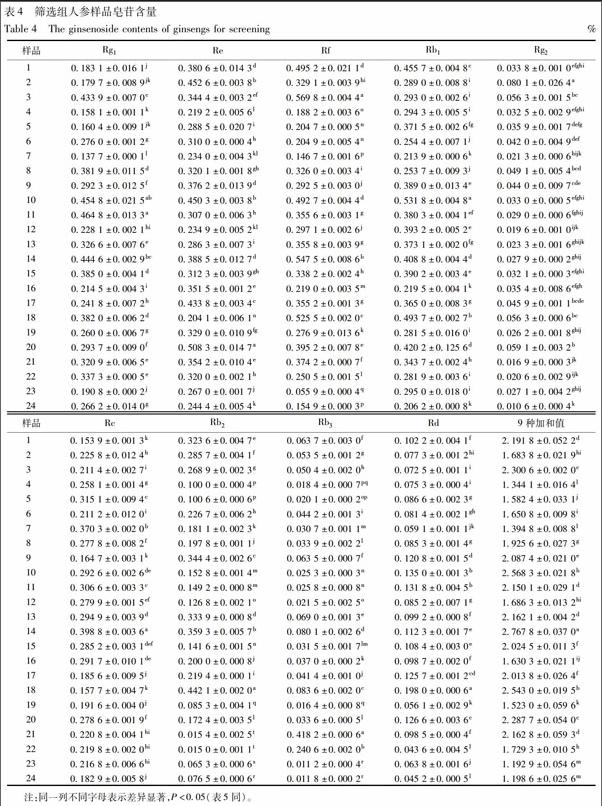
3.2 特异性引物筛选 引物扩增结果见图2,仅GC1引物的13,14号样品分别在约2 000,1 200 bp处各有1条特异性条带,14号人参样品9种皂苷加和值最高,见图3和表4。
3.3 特异性引物PCR反应体系优化 GC1引物的最优PCR体系为:DNA质量浓度2.60 mg·L-1,Mg2+1.44 mmol·L-1,dNTP 0.19 mmol·L-1,引物0.32 μmol·L-1、Taq酶0.076 U·μL-1,见图4。
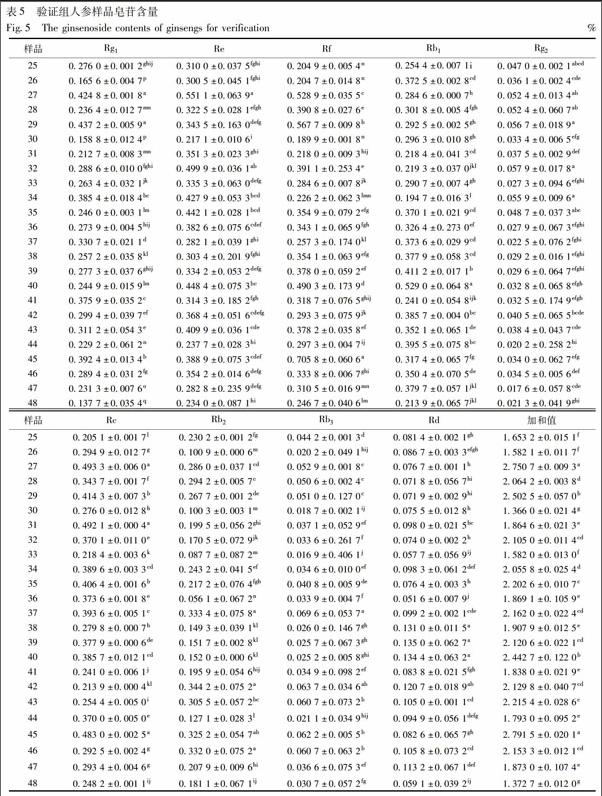
3.4 特异性引物PCR反应体系验证 27和45样品检测出1 200 bp特异性条带,其对应的人参样品9种皂苷加和值最高见图5和表5。
3.5 特异性片段测序及比对 该特异性条带测序为1 104 bp,经BLAST比对结果显示,与甘油-3-磷酸脱氢酶同源性较高,相似度达99%;对该序列进 行完整阅读框查找,见图6,从569~1 102 bp翻译177 aa蛋白质,经查阅为甘油-3-磷酸脱氢酶。
4 讨论
PCR技术致力于DNA,不受组织、生长时期及环境的影响,在人参真伪鉴定[7-10]、品种鉴定[11-12]、地域鉴定[13]、聚类分析[14-15]及DNA条形码[16-17]等 方面的应用也非常广泛。基于个体之间的基因差异,本研究利用PCR技术比较扩增图谱与皂苷含量之间的相关性,成功筛选出引物GC1,该引物及其PCR优化体系可用来检测人参幼苗,从而有利于快速、准确的筛选人参皂苷高产株系,为人参育种提供理论依据和参考。
在人参萜类化合物合成的过程中,同时存在甲羟戊酸途径(MVA)和丙酮酸途径(MEP)[18],其中MEP以糖酵解中间产物丙酮酸和甘油醛-3-磷酸为前体经酶作用合成IPP和DMAPP[19],而相关研究表明甘油-3-磷酸脱氢酶是催化糖酵解中间产物——磷酸二羟丙酮转化生成甘油-3-磷酸(Gly3p)和烟酰胺腺嘌呤二核苷酸(NAD+)的关键酶[20-22]。
本实验研究发现的特异性条带为人参的甘油-3-磷酸脱氢酶基因,其促使了磷酸二羟丙酮向甘油-3-磷酸转化,为人参皂苷合成的MEP提供前体物质,从而促进人参皂苷合成、积累。
甘油-3-磷酸脱氢酶为植物代谢途径的基本基因,完全缺失的可能性很小。本实验模板为人参DNA,作者考虑为个体或人参品种间的基因差异,可能为基因转座导致目标基因拷贝数增多,引起基因丰度差异;有可能为基因大片段重组,形成较强启动子或增强子,使目标基因过量表达,引起人参皂苷差异。
[参考文献]
[1] 刘彤. 高产人参皂苷相关基因筛选[D]. 长春:吉林农业大学,2015.
[2] 郭鑫,倪州献,罗建中,等. 桉树SSR-PCR体系优化及引物筛选应用[J]. 分子植物育种,2017,15(2): 626.
[3] 郭冲,郜玉钢,臧埔,等. HPLC法同时测定人参及其制剂中16种人参皂苷[J]. 中草药,2014,45(14): 2009.
[4] 任风鸣,胡开治,刘燕琴,等. 传统中药金钱草ISSR-PCR反应体系的正交优化研究[J]. 中国中药杂志,2014,39(12):2233.
[5] 许永华,王士杰,陈晓林,等. 人参SRAP-PCR体系优化条件的建立[J]. 安徽农业科学,2010,38(16):8419.
[6] 周桐,金东淳,伊旭,等. 人参基因组DNA的提取及RAPD-PCR反应条件的优化[J]. 延边大学农学学报,2009,31(3):189.
[7] 蒋超,罗宇琴,袁媛,等. 多重位点特异性PCR鉴别人参、三七、西洋参掺杂[J]. 中国中药杂志,2017,42(7):319.
[8] 刘丽,肖炳燚,罗晖明,等. 多重PCR方法同时鉴别人参、西洋参、三七[J]. 药物分析杂志,2016,36(4):668.
[9] 许成,张长城,李菁,等. 基于RAPD标记竹节参及其近缘植物的品种鉴别[J]. 时珍国医国药, 2016,27(1):101.
[10] 崔占虎,袁媛,张景景,等. 基于快速PCR方法的人参属药用植物鉴别研究[J]. 中药材,2015,38(8):1634.
[11] 王景,张甜甜,李萌,等. 利用SNP分子标记对人参品种大马牙的特异鉴定研究[J]. 中药材,2015,38(11):2298.
[12] 任跃英,高巍,郭影,等. 黄果及红果人参、西洋参基因组的RAPD分子标记研究[J]. 吉林农业大学學报,2005(1):39.
[13] 邵爱娟,李欣,黄璐琦,等. 用RAPD技术对人参栽培群体的遗传分析[J]. 中国中药杂志,2004,29(11):1033.
[14] 任跃英. 黄果、红果人参和西洋参种源的系统研究与鉴定[D]. 长春:吉林农业大学,2002.
[15] 许永华,金慧,金永昌,等. 人参种源遗传多样性和遗传关系的AFLP分析[J]. 西北农林科技大学学报:自然科学版,2010,38(7):203.
[16] 詹鑫婕,田程,张媛,等. 基于ITS2条形码SNPs的人参和西洋参PCR-SSCP分子鉴别研究[J]. 中国中药杂志,2012,37(24):3748.
[17] 陈士林,姚辉,韩建萍,等. 中药材DNA条形码分子鉴定指导原则[J]. 中国中药杂志,2013,38(2):141.
[18] 刘丽. 利用抑制剂对人参皂苷生物合成途径MVA与MEP的研究[D]. 长春:吉林农业大学,2012.
[19] 张松涛,陈红丽,崔红,等. 植物MEP途径的代谢调控机制[J]. 西北植物学报,2012,32(7):1500.
[20] 姚瑶. 三角褐指藻3-磷酸甘油脱氢酶的克隆及功能分析[D].广州:暨南大学,2013.
[21] 吴尚虹. 酵母甘油-3-磷酸脱氢酶(GPD)基因转化油菜的研究[D]. 长沙:湖南农业大学,2012.
[22] 薛婷,原雪,王斌,等. 酿酒酵母甘油-3-磷酸脱氢酶基因沉默表达[J]. 福建师范大学学报:自然科学版,2015,31(6):64.
[责任编辑 吕冬梅]endprint
