外源人参三萜皂苷对新林土中土壤微生物群落的影响
2018-01-29张爱华雷锋杰傅俊范周如军张连学
张爱华+雷锋杰+傅俊范+周如军+张连学
[摘要] 人参皂苷不仅是人参主要的药用活性物质,而且人参皂苷是人参化感作用的主要化感物质,其在人参植株生长及生态适应性方面发挥重要作用。为了研究人参皂苷对土壤微生物群落的影响,采用外源添加的方式研究人参总皂苷对新林土中微生物群落动态的影响,分析新林土中微生物群落代谢活性的变化趋势,探讨人参皂苷对土壤微生物群落的生态学效应。与对照相比,加入人参总皂苷10 d和40 d后新林土中土壤微生物群落的代謝活性均显著高于对照组,处理10 d后土壤微生物群落多样性指数除了均匀度指数(E)外,其他多样性指数随皂苷浓度升高呈现出先升高后降低的趋势,其中,低浓度处理碳源利用丰富度指数(S)与对照相比差异显著。后期除了均匀度指数(E)外,其他多样性指数高于对照。人参总皂苷可改变新林土中土壤微生物群落的组成和代谢活性,人参皂苷在土壤中的积累可以改变土壤微生态环境从而影响人参生长。
[关键词] 人参皂苷; 土壤微生物群落; Biolog法
[Abstract] Ginsenosides are the main active ingredient and allelochemicals of Panax ginseng, and they play an important role in ginseng growth and in ecological adaptation. To study the influence of ginsenosides on soil microbial communities, the method of given exogenous total ginsenosides of different concentrations were used to study the influence of ginsenosides on new forest soil microbial community, evaluate the change of metabolic activity of microbial community and investigate the ecological effect of ginsenosides on soil microbial community. Results showed that, exogenous total ginsenosides promoted metabolic activity of microbial community in new forest soil at different concentrations compared with the control after 10 d and 40 d treatment. After 10 d,except for the Evenness index, all of the other indices indicated that the functional diversity of the soil microbial community in the new forest firstly increased then decreased with increase of the total ginsenosides concentration. The Substrate richness for 0.01 g·L-1 soil treatment was significantly different from that of the control. After 20 d, 30 d and 40 d, except for the Evenness index, all of the other indices indicated that the functional diversity of the soil microbial community in the new forest increased with total ginsenosides. These results suggested that ginsenosids can change soil microbial community and microbial metabolic activity, which alter soil microbial ecology and accordingly affect the growth of ginseng with accumulation of ginsenosides in the soil.
[Key words] ginsenoside; soil microbial community; Biolog method
土壤微生物是土壤生态系统的重要组成部分,其在物质与能量循环、土壤结构及土壤微生态平衡等方面发挥着重要作用。人参是多年生宿根植物,对生境要求极其苛刻,野生人参多生长在海拔400~1 000 m的岗地或各种类型的山地半山坡上,土壤为微酸性(pH 5.5~6.5)的棕色森林土或山地灰化棕色森林土,坡度为5~44°的针阔叶混交林或杂木林下[1]。张梦昌等[2]发现老参地土壤微生物的生物量显著下降,生理类群发生明显改变;在人参根表面微生物种群中,真菌比例较根际有所增加,放线菌几乎为零。李勇等[3]报道随人参生长年限的增加,人参根区土壤中真菌数量逐年升高,其中以镰刀菌的增长最为显著,木霉菌含量反而明显降低;细菌和放线菌数量逐年降低,且细菌数量的变化较放线菌更为显著。研究表明,老参地土壤微生物群落的变化致使土壤微生物中有益菌对人参根腐病菌的拮抗作用降低,导致人参根部病害加重[4-5]。
人参、西洋参根系与根际土壤微生物的相互影响作用已经得到了广泛关注,人参皂苷作为人参、西洋参根系分泌物中主要的化感物质,其对土壤微生物的作用不容忽视[6-8],但未见相关研究报道。因此,为了进一步探讨人参皂苷对土壤微生物群落的影响作用,采用外源添加的方式研究人参总皂苷对新林土中微生物群落动态分布及影响。旨在通过观察新林土中的微生物群落的代谢活性的变化趋势,分析人参皂苷对土壤微生物种群的生态学效应,从而探究人参、西洋参合成、分泌人参皂苷在调节根际土壤微生态方面的作用和地位。endprint
1 材料
试验用人参总皂苷(纯度99%以上)由吉林省人参工程技术研究中心提供;新林土采自吉林省临江市大栗子镇望江村周边山上的阔叶林中(地理位置坐标,N126.861 902,E41.765 97),林区主要树种有蒙古栎、核桃楸、黄柏、紫椴、槭树等;主要草本植物有茜草、艾蒿、月见草、尾叶香茶菜等。采用五点取样法采集0~20 cm深的土壤。
2 方法
2.1 人参总皂苷溶液的配制
参考文献及前期实验确定人参皂苷浓度设计[8-9],精确称量人参总皂苷0.1 g,用蒸馏水溶解后定容至100 mL,即得到质量浓度为1.0 g·L-1的人参总皂苷溶液,依次稀释可得到质量浓度为0.1,0.01 g·L-1的人参总皂苷溶液,现用现配。
2.2 土壤微生物的培养
将采集的新林土过40目筛,去除石块和枯枝落叶等植物残体后,分装到玻璃培养皿中(Φ=15 cm),每个平皿装255 g(土壤含水量为21.5%,相当于200 g烘干土重)。然后向每个培养皿的新林土中加入50 mL不同质量浓度(1.0,0.1,0.01 g·L-1)的人参总皂苷溶液(使每100 g土中含有的人参皂苷量分别达到25,2.5,0.25 mg),用玻璃棒搅拌均匀后,加盖置于恒温培养箱内在26 ℃条件下黑暗培养40 d。采用五点取样法每10 d取1次土样,每次取样15.0 g,将土样装入灭菌的塑封袋内,放于4 ℃的冰箱内保存,备用。实验共设3个浓度梯度,每个梯度3个重复。以蒸馏水处理为对照。
2.3 Biolog-ECO法测定土壤微生物群落的功能多样性
具体步骤:①从塑封袋中准确称取7.35 g(相当于5.0 g干土,含水量31.97%)土放入盛有45 mL无菌水的三角瓶(150 mL)中接种,用涡旋振荡机振荡3 min,将土样充分打散;②振荡后立即吸取10 mL污泥到50 mL离心管中,在1万r·min-1下离心20 min,弃去上清液,再加入10 mL已灭菌的生理盐水 (0.85%NaCl);在振荡机上振动3 min,使之混匀;③然后,再于1万r·min-1下离心20 min,洗去其中的碳源;弃去上清液,加10 mL生理盐水,于振荡机上振动3 min,使之混匀,并在2 000 r·min-1条件下离心1 min。④用移液器吸取1 mL上清液加入装有9 mL已灭菌生理盐水的试管中,并使其A590维持在(0.13±0.02);⑤将加入菌悬液的试管在涡旋振荡机上振荡30 s,使之混匀。
用移液器将上述菌悬液加入Biolog-ECO微平板中,每孔150 μL,對照孔加无菌生理盐水;然后在温度为25 ℃,湿度为40%的条件下黑暗培养,每隔24 h用MicroStationTM-2读取数据,连续测定7 d。
2.4 数据处理与分析[10-11]
采用Excel (2007版)软件计算AWCD值,选取72 h的平均颜色变化率AWCD计算土壤微生物群落功能多样性指数,单因素方差分析采用SPSS 17.0软件进行。
3 结果分析
3.1 人参总皂苷对新林土中土壤微生物群落代谢活性的影响
ECO平板微孔内的平均颜色变化率(AWCD)反映了土壤微生物的代谢活性,是土壤微生物群落代谢活性的重要指标[12]。在平板培养期间,使用MicroStationTM-2每24 h测定1次AWCD,得到AWCD随时间的动态变化图(图1)。
以上结果表明,新林土中在加入人参总皂苷以后,微生物群落的代谢活性发生了明显变化,说明人参总皂苷改变了微生物群落的代谢活性,并且对土壤微生物群落的结构和组成产生了一定影响。在加入人参总皂苷第10天,新林土中土壤微生物群落的代谢活性显著增强,说明人参皂苷在处理的前期可以促进土壤微生物群落的生长,并且中质量浓度0.1 g·L-1处理的促进效果最为显著。在加入人参总皂苷第20天后,新林土中土壤微生物群落的代谢活性再次发生改变,中浓度的人参总皂苷对微生物代谢的促进作用相对减弱,而高浓度和低浓度处理中土壤微生物的代谢活性明显受到抑制。人参总皂苷加入到新林土中第30天以后,其对土壤微生物群落代谢活性的影响与对照相比,并无显著差异。但是,新林土中在加入人参总皂苷第40天后,不同处理的土壤微生物群落的代谢活性产生了新的变化,低浓度处理组中的土壤微生物代谢活性最强,且明显高于中、高浓度处理过的土壤。由此可见,采用不同浓度的人参皂苷处理新林土和土壤培养时间均与土壤微生物群落代谢活性有直接关系。
3.2 人参总皂苷对新林土中土壤微生物群落多样性指数的影响
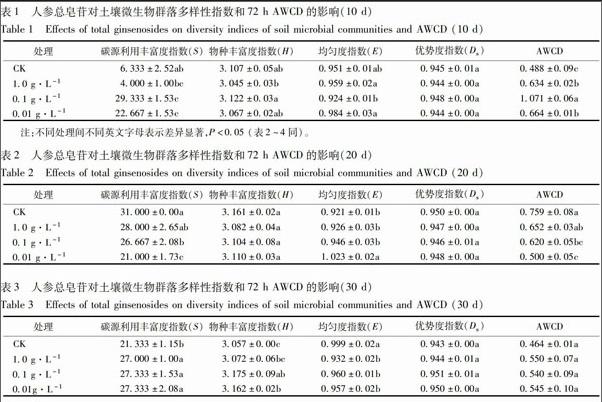
3.2.1 处理第10天土壤微生物群落多样性的变化 在加入人参总皂苷10 d以后,中浓度(0.1 g·L-1)处理的新林土中土壤微生物群落碳源利用丰富度指数、物种丰富度指数、优势度指数均高于对照和高浓度(1.0 g·L-1)、低浓度(0.01 g·L-1)处理,但均匀度指数最低,说明土壤微生物群落中的某些类群得到人参皂苷的刺激,迅速增殖,代谢旺盛,成为群落内的优势种群;低浓度(0.01 g·L-1)处理的均匀度指数最高,说明群落的组成变化较小,各种群对人参皂苷的反应不敏感;而高浓度(1.0 g·L-1)处理组各种指数均与低浓度处理组的差异均不显著(表1)。
3.2.2 处理第20天土壤微生物群落多样性的变化 在加入人参总皂苷20 d以后,对照组新林土中土壤微生物群落碳源利用丰富度指数、物种丰富度指数、优势度指数均高于不同浓度的总皂苷处理组,但均匀度指数最低,与第10天相比,碳源利用丰富度指数显著增加,代谢变得旺盛;低浓度(0.01 g·L-1)处理的均匀度指数仍然最高,碳源利用丰富度最小,推测可能是某些微生物种群受到人参皂苷的抑制,代谢活性较低的缘故,但物种丰富度仅低于对 照组,说明保留了相对较多的微生物种群;而高浓度(1.0 g·L-1)处理的碳源利用丰富度指数高于中浓度(0.1 g·L-1)处理,但物种丰富度和均匀度均低于中浓度处理,可能是高浓度的人参皂苷对某些微生物种群产生的抑制作用更强的缘故(表2)。endprint
3.2.3 处理第30天土壤微生物群落多样性的变化 加入人参总皂苷30 d以后,中浓度(0.1 g·L-1)处理的土壤微生物群落碳源利用丰富度指数、物种丰富度指数、优势度指数均高于其他处理,同时均匀度指数也高于高浓度(1.0 g·L-1)和低浓度(0.01 g·L-1)处理的土壤,可能此浓度的人参总皂苷对土壤微生物群落的抑制作用最弱,微生物种群比高浓度处理的微生物种群更丰富,而促进作用又较低浓度处理更强的缘故;对照组处理的均匀度指数最高,说明群落的组成变化较小,各种群落分布比较均匀;而高浓度(1.0 g·L-1)处理组均匀度指数最低,说明某些种群受到显著的抑制(表3)。
3.2.4 处理第40天土壤微生物群落多样性的变化 在40 d时,人参总皂苷低浓度(0.01 g·L-1)处理的新林土中土壤微生物群落碳源利用丰富度指数、物种丰富度指数、优势度指数均高于其他处理,说明此浓度处理的土壤微生物群落种群最为丰富,并且其代谢较对照组有显著的促进作用,但某些类群开始大量繁殖,占据了较多的生境,造成均匀度下降;此时高浓度(1.0 g·L-1)处理中人参皂苷的抑制作用开始减弱,物种丰富度增加,相应的受到促进的某些微生物种群降低了群落的均匀度;而中浓度(0.1 g·L-1)处理在40 d时对微生物的促进和抑制作用逐渐达到平衡,与对照相比总体表现出促进作用(表4)。
4 结果与讨论
人参皂苷作为人参的主要次生代谢产物,承担着重要的生态学作用,在人参与环境的相互作用中 扮演着重要角色[13]。
人参皂苷在一至四年生参根中的质量分数可达到3%~8%,主要分布于参根最外层的周皮中,这些化合物可以通过根系分泌以及须根的季节性脱落进入土壤;生长旺盛的根系或新根分泌能力较强。另外,在人参收获后大量参根残留于田间,也可释放人参皂苷至土壤中,因此,人参皂苷也被认为是人参中主要的化感物质,参地土壤中的人参皂苷可能会由于人参生理代谢而维持一个相对稳定的浓度。杨靖春报道,新林土栽参组为0.280 mg·g-1土,老参地连栽参为0.24 mg·g-1土,老參地轮作组为0.108 mg·g-1土[9]。Nicol[6]测得西洋参根际土壤中人参总皂苷的质量分数为200~980 mg·kg-1。在人参皂苷浓度设计中参考了前人的研究结果。加拿大学者Bernards对西洋参进行研究发现,其根系分泌物中含有的人参皂苷成分对土传病原菌——Phytophthora cactorum疫病菌和Pythium irregulare畸雌腐霉菌的生长有显著地促进作用;而相同条件下,对Trichoderma hamatum钩状木霉的生长则表现出轻微的抑制作用[6]。这表明,人参、西洋参产生的人参皂苷可对病原微生物的生长繁殖及根际微生物群落的动态变化产生显著地影响。
Biolog方法已越来越多的应用于土壤生态学的研究中。本实验测定的AWCD曲线的总体趋势符合微生物生长的“J”型曲线,反映了土壤微生物在平板上的代谢活性变化。实验结果表明,土壤微生物群落的代谢活性随时间的变化而略有差异,但在加入不同浓度的人参总皂苷以后,其代谢活性在时间上的变化十分显著;在实验初期,新林土中土壤微生物群落的代谢活性明显升高,说明人参总皂苷对微生物的生长具有促进作用,且中浓度(0.1 g·L-1)的促进作用最为显著;而随着处理时间延长,某些具有抑制作用的人参皂苷开始发挥作用,某些类群的生长受到抑制,土壤微生物代谢活性降低;但在处理40 d时,某些受到促进的土壤微生物类群又开始占据生境,成为优势种群,代谢活性又开始增强,高浓度处理尤为明显。
实验中AWCD和土壤微生物群落多样性指数的波动性变化可能与加入到新林土中的人参总皂苷被代谢掉有关,人参皂苷在土壤中的含量随着时间的增加而逐渐减少,因此对土壤微生物群落的定向选择压力也逐渐降低,从而呈现实验末期(40 d)所表现出的结果。这与人参实际生长情况不同。在栽培过程中,人参根系持续向环境中分泌人参皂苷,根际土中人参皂苷的含量是逐渐升高的,因此,其对土壤微生物群落的定向选择作用是持续增强的,土壤微生物群落结构的单一化趋势更为明显。
人参总皂苷对土壤微生物群落的功能多样性具有显著的影响。在实验初期,群落的物种丰富度增加,均匀度较好,但随着培养时间延长,土壤微生物群落的功能多样性发生显著变化,物种丰富度先降低,在实验末期(40 d)又开始升高,均匀度指数则一直降低。这说明人参总皂苷改变了土壤微生物群落的结构和组成,致使某些微生物类群大量增殖,成为土壤生境中的优势种,但同时群落的代谢类型趋于单一。这与前人的报道相符。人参根系分泌物对土壤微生物的定向选择压力可能是造成土壤微生物种群遗传多样性变化的主要原因,人参、西洋参根际土壤中微生物种群结构的变化是导致其生态功能紊乱进而产生连作障碍的关键因素[14]。
[参考文献]
[1] 王铁生.中国人参[M].沈阳:辽宁科学技术出版社, 2001:423.
[2] 张梦昌,金裕姬,马晶,等.老参地改良后微生物生态类群的变化[J].吉林农业大学学报,1990,12(4):42.
[3] 李勇,刘时轮,易茜茜,等.不同栽培年限人参根区土壤微生物区系变化[J].安徽农业科学,2010,38(2):740.
[4] 李世昌,刘梅娟,卢凤勇,等.栽参对土壤微生物生态及土壤酶活性的影响[J].生态学报, 1983, 3(1):29.
[5] 郭淑华,王玉香,耿运琪,等.栽参对土壤微生物生态的影响[J].生态学报,1990,10(3): 286.
[6] Nicol R W,Yousef L, Traquair J A,et al.Ginsenosides stimulate the growth of soilborne pathogens of American ginseng [J].Phytochemistry,2003,64:257.
[7] Nicol R W, Traquair J A, Bernards M A .Ginsenosides as host resistance factors in American ginseng (Panax quinquefolius)[J].Can J Bot,2002,80(5):557.
[8] 张爱华,彭洪利,雷锋杰, 等.人参根系分泌物的提取及鉴定[J].西北农林科技大学学报:自然科学版,2014,42(7):191.
[9] 杨靖春, 李治平,酒井斐子.人参根系分泌物及其对人参根际微生物作用的研究[J].东北师大学报:自然科学版, 1982(1): 71.
[10] 董立国,袁汉民,李生宝,等.玉米免耕秸秆覆盖对土壤微生物群落功能多样性的影响[J].生态环境学报,2010,19(2):444.
[11] 时鹏,高强,王淑平,等.玉米连作及其施肥对土壤微生物群落功能多样性的影响[J].生态学报,2010,30(22):6173.
[12] Zabinski C A, Gannon J E. Effects of recreational impacts on soil microbial communities [J].Environmen Manage, 1997, 21(2):233.
[13] 张爱华,雷锋杰,许永华,等.外源人参皂苷对人参种子和幼根抗氧化酶活性的影响[J].生态学报,2009,29(9):4934.
[14] 李勇,应益昕,赵东岳,等.人参及西洋参栽培土壤微生物种群遗传多样性的RAPD分析[J].中草药,2010, 41(11):1871.
[责任编辑 吕冬梅]endprint
