脑卒中与血小板活化因子及其受体拮抗剂
2018-01-29王志国王丹巧焦玥田昕孙明瑜
王志国+王丹巧+焦玥+田昕+孙明瑜
[摘要] 脑卒中是一种急性脑血管疾病,具有发病率高、致残率和致死率高的特点。全球脑卒中防治形势严峻,抗血小板聚集治疗能够有效防治脑卒中。血小板活化因子(PAF)是介导血小板聚集的另一重要介质,在脑卒中病理过程中起着重要作用。近年来,PAF受体拮抗剂在脑卒中防治领域逐渐引起国际关注。该文对PAF受体拮抗剂的分类、作用机制及药物特征进行综述,以期对临床用药及新药研发提供有价值的指导和方向。
[关键词] 脑卒中; 血栓; 抗血小板药物; 血小板活化因子; 受体拮抗剂
[Abstract] Stroke is an acute cerebrovascular disease with high morbidity, disability and mortality. The prevention and treatment conditions for stroke is severe all over the world. Antiplatelet aggregation is an effective treatment. Platelet activation factor (PAF) is another important medium in mediating platelet aggregation, which plays an important role in the pathogenesis of stroke. In recent years, PAF receptor antagonists have attracted international attention in the field of stroke prevention and treatment. In this review, we would summarize the classification, mechanism and drug characteristics of PAF receptor antagonists in order to provide the valuable guidance and direction for clinical medicine and research.
[Key words] stroke; thrombus; antiplatelet drug; platelet activating factor; receptor antagonist
腦卒中是由于脑部血管突然破裂或因血管阻塞导致血液不能流入大脑而引起脑组织损伤的急性脑血管疾病,包括缺血性和出血性脑卒中,其中缺血性脑卒中所占比例较高,具有发病率、死亡率、致残率高的特点[1]。《中国脑卒中防治报告2016》中指出,中国是全球卒中危险因素暴露水平较高的国家之一,脑卒中患病率、复发率和死亡率不断攀升,由此造成的直接和间接经济负担也在不断增长,脑卒中的防治已成为我国慢性病防控的重点[2]。
1 血小板活化与缺血性脑卒中
缺血性脑卒中属于血栓性疾病,血小板在脑缺血进程中具有重要位置,血小板活化是其主要病理机制之一。血小板通过其膜表面上的特异性受体与血管内皮下蛋白结合并粘附于内皮下。粘附的血小板被激活后,通过Ca2+介导的细胞内信号传导系统,引起血小板肌动蛋白重排、血小板伪足形成、胞体伸展、α和δ-颗粒膜与血小板膜融合,释放血栓素A2(TXA2)、腺苷二磷酸(ADP)、5-羟色胺(5-HT)等,诱导血小板聚集。同时,内皮下血管组织因子与血浆凝血因子Ⅶ/Ⅶa结合,激活因子Ⅸ,Ⅹ,Ⅹa,Ⅴa与磷脂等组成复合物,促使凝血酶原转变成凝血酶,诱导血小板聚集,纤维蛋白原转变为纤维蛋白,内皮细胞P-选择蛋白的表达,内皮细胞的通透性增加等。缺血性脑卒中后,活化的血小板通过其聚集,分泌神经毒性物质进而加重微循环障碍和缺血性脑组织损伤[3]。
2 缺血性脑卒中的抗血小板治疗
抗血小板治疗是缺血性脑卒中临床治疗方法的重中之重。抗血小板药物能够抑制血小板活化,阻止其参与血栓形成,这一作用在动脉血栓形成过程中尤为突出。抗血小板药物由此成为防栓、治栓的一类重要药物。目前,抗血小板药物主要分为以下几类。
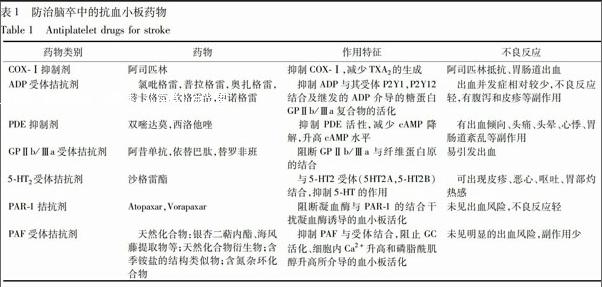
2.1 环氧化酶-Ⅰ抑制剂 此类药物的代表药物阿司匹林是目前脑卒中防治中最为广泛使用的抗血小板药物。阿司匹林作用于花生四烯酸(AA)的代谢,抑制环氧化酶(COX-Ⅰ),不可逆性减少血小板中TXA2的产生,从而抑制血小板聚集,抑制血栓形成。急性缺血性脑卒中或短暂性脑缺血(TIA)早期使用阿司匹林可预防脑卒中复发或血管危险事件[4]。阿司匹林作为二级预防措施的益处已获得肯定。然而,阿司匹林仅能预防不到1/4的严重血管事件,部分患者可产生“阿司匹林抵抗”,增加了出血风险。这可能与血小板激活的替代途径、COX蛋白的遗传变异、药物相互作用等因素有关[5]。同时,阿司匹林有胃肠道出血的副作用,长期服用低剂量阿司匹林(<325 mg)的患者中,平均每年出现严重的胃肠道出血的概率约是0.4%,是未服药患者的2.5倍[6-7]。
2.2 二磷酸腺苷受体拮抗剂 此类药物主要有氯吡格雷、普拉格雷、奥扎格雷等。氯吡格雷是二代ADP受体拮抗剂,可阻断二磷酸腺苷(ADP)介导的血小板聚集,降低脑卒中的危险性及严重并发症的发生。与一代药物相比,氯吡格雷具有出血并发症少,不良反应轻的特点[8]。对阿司匹林过敏或胃肠道不能耐受的患者,可使用氯吡格雷,尤其适用于心脑血管病高危患者和糖尿病患者。然而,也可产生“氯吡格雷抵抗”,且腹泻和皮疹的发生率较高[9]。普拉格雷、奥扎格雷等后续研发的药物在一定程度上克服了上述部分问题。
2.3 磷酸二酯酶抑制剂 主要包括双嘧达莫和西洛他唑,可通过抑制磷酸二酯酶(PDE)活性,减少环磷酸腺苷(cAMP)的降解,升高血小板cAMP的水平;还能抑制红细胞和血管内皮对腺苷的摄取和代谢,增加血管内皮中腺苷的浓度,激活腺苷酸环化酶(AC),使cAMP浓度升高,抑制血小板聚集。另外,双嘧达莫还可刺激PGI2的合成,增强其活性,从而抑制血小板聚集。双嘧达莫防治冠心病、心绞痛的疗效已得到肯定,但对缺血性脑卒中的治疗仍有争议。与阿司匹林相比较,现有研究不能证明单独服用双嘧达莫能更有效的预防脑卒中,不推荐单独服用,多与阿司匹林合用[10]。临床副作用多表现为头痛、头晕、心悸、胃肠道紊乱,降低了患者的依从性。endprint
2.4 血小板膜糖蛋白Ⅱb/Ⅲa受体拮抗剂 血小板膜糖蛋白(glucoprotein,GP)Ⅱb/Ⅲa是纤维蛋白原的受体,它与纤维蛋白原的结合是血小板聚集的终末和关键步骤。GPⅡb/Ⅲa受体拮抗剂通过特异性地阻断GPⅡb/Ⅲa与纤维蛋白原的结合抑制血小板聚集,可增加自发性血管再通率,促进微血管通畅[11]。现已通过美国FDA批准的3种静脉注射GPⅡb/Ⅲa受体拮抗剂是阿昔单抗、依替巴肽、替罗非班。此类药物较其他类别的药物容易引发出血,在缺血性卒中二级预防中的剂量、给药途径、时间、监护措施以及安全性等仍在探讨之中[12]。
2.5 5-羟色胺2受体拮抗剂 血管壁上存在的5-羟色胺2(5-HT2)受体被激动后可明显影响血管内皮细胞的完整及分泌功能,引起血管收缩,并可致动脉硬化的发生。沙格雷酯是一种5-HT2受体阻滞剂,它通过阻滞5-HT2受体而抑制血小板聚集和血管收缩,从而达到抗血栓形成的作用[13]。沙格雷酯副反應较少,部分患者可有皮疹、恶心、呕吐和胃部灼热感等。沙格雷酯在脑卒中的基础用药地位,有待进一步的临床试验。
2.6 蛋白酶激活受体-1拮抗剂 蛋白酶激活受体-1(PAR-1)属于G蛋白偶联受体家族成员,存在于细胞膜表面,通过介导细胞外信号调节激酶信号转导通路,引起细胞核反应,激活多种细胞转录因子。凝血酶是体内最强的血小板激活剂之一,PAR-1作为凝血酶的受体与凝血酶结合,激活血小板,促使血小板聚集形成血栓[14]。目前主要的PAR-1抑制剂有2种,即Atopaxar和Vorapaxar。二者选择性地干扰凝血酶介导的血小板活化,因而不增加出血风险,且更快地达到抗血小板效应,其预防脑卒中的效果及用药安全性有待进一步的临床试验[15]。
此外,联合抗血小板治疗旨在通过多种机制阻断血小板聚集,抑制血栓形成。大量研究表明,双联抗血小板在预防早期脑卒中复发及改善预后方面较单一用药更为有效,但考虑到效果及出血风险,不推荐抗血小板联合用药作为预防脑卒中的长期用药。
3 聚焦血小板活化因子(PAF)—介导血小板聚集的另一重要介质
1972年,Benveniste发现嗜碱性粒细胞在被IgE攻击后能产生一种可使血小板活化、聚集、释放组胺的可溶性脂质,称之为血小板活化因子(PAF)。PAF是目前发现的作用最强的脂质递质,广泛存在于各种组织,主要由中性粒细胞、血小板、肥大细胞、内皮细胞和巨噬细胞等产生,在体内具有广泛的生物活性。体内少量生理需求的PAF主要以烷基甘油磷酸为底物,经乙酰转移酶、磷酸胆碱转移酶等作用合成。病理过程中大量产生的PAF主要是由致炎物质激活磷脂酶A2(PLA2),在乙酰转移酶作用下生成,导致炎症类疾病的发生[16]。
不断深入的研究发现,在ADP清除系统或COX抑制剂存在时,PAF仍可诱导血小板聚集,两者合用时也不能对抗PAF对血小板的活化作用。此外,凝血酶脱粒的血小板不再被凝血酶刺激产生反应,但对PAF仍表现聚集敏感。上述研究提示,在已明确的介导血小板聚集的途径之外,显然还存在着引起血小板聚集的另一条重要途径。Vargafitg等提出,PAF是不依赖ADP及TXA2的血小板聚集的媒介,是继ADP、TXA2之后发现的介导血小板聚集的第三条途径的介质[17]。
4 PAF参与脑卒中的病理机制
PAF发挥生物学效应主要通过与细胞膜表面的PAF受体相结合而实现,其细胞内信息传递主要是由G蛋白介导。脑缺血时,PAF与其特异性受体相耦联的G蛋白结合,激活三磷酸鸟苷(GTP)及磷酯酰肌醇(PI)特异的磷脂酸(PLC),促进磷脂肌醇代谢增强,使二酰基甘油(DG)和三磷酸肌醇(IP3)水平增高,最终引起细胞内储存Ca2+增加,蛋白激酶C活化,继而激活和聚集血小板形成血栓,引起血管栓塞;促使血管活性物质的释放,增加血管通透性及炎性反应,引发和加重脑水肿;诱导细胞分化,扰乱细胞膜功能。各个环节相互影响和促进,形成恶性循环,加重了脑损害[18-21]。由此可见,PAF的产生和积聚是脑卒中病理过程中从血栓形成到缺血损害的“扳机点”,具有极其重要的作用。
5 PAF受体拮抗剂
1993年,一项IF高达17的动物实验研究数据表明,PAF是促使血小板聚集的重要介质。PAF与白细胞的相互作用可能有助于启动足够的血小板活化,导致动脉狭窄和内皮损伤部位的循环流动发生变化。该研究提出了一个重要结论:PAF受体拮抗剂可作为新途径的抗血小板药物[22]。近年来,PAF受体拮抗剂在防治脑卒中方面的优势逐渐引起国际广泛关注。最早发现的PAF受体拮抗剂是银杏内酯B,1985年柳叶刀报道银杏内酯B能很好地抑制PAF对血小板的聚集作用。随后大量的基础研究显示其拮抗活性很强,常作为标准的PAF受体拮抗剂,但由于种种原因,一直未开发成功[23]。其后,PAF受体拮抗剂不断涌现,均处在临床和临床前不同的研究阶段,但上市的较少。根据其来源分为天然和合成两大类,天然PAF受体拮抗剂主要来源于天然植物、微生物的代谢产物。合成的PAF受体拮抗剂化学结构类型繁多,主要是天然化合物的衍生物、含有季铵盐的PAF结构类似物以及含氮杂环化合物,见表1。
5.1 天然PAF受体拮抗剂 天然PAF受体拮抗剂具有疗效强、毒副作用少等特点。天然植物中很多成分都有PAF的拮抗作用,中草药中已发现具有拮抗PAF作用的植物有银杏、海风藤、川芎、山蒟、石楠藤、前胡、辛夷、防己、十大功劳叶等。萜类(银杏叶提取物)和新木质素类化合物(海风藤提取物)研究较多。其中,最受研究者关注的是萜类化合物—银杏叶中的二萜内酯类化合物。银杏Ginkgo biloba是一种在地球上存在了2亿多年的植物,是银杏科银杏属中唯一的生存物种,被誉为“活化石”。我国古代医籍中早已有银杏叶入药和食疗的相关记载。20世纪70年代初,国际上有文献报道用银杏叶提取物(extract of Ginkgo biloba,EGB)治疗中枢外周血流紊乱和脑血管动脉粥样硬化,使得银杏叶的药用价值逐渐受到重视。目前已明确的银杏叶化学成分多达180种,主要活性成分为萜内酯化合物和黄酮类化合物。其中银杏萜内酯类化合物中的银杏二萜内酯包括银杏内酯A,B,C,K,J和M等,均为PAF受体拮抗剂。endprint
近年来,国内外研究者相继展开对银杏叶活性成分及药效机制的深入研究。Bourgam等用PAF灌注豚鼠肠系膜动脉,在内皮细胞周围形成血小板血栓,BN 52021(GB)能够显著抑制血栓形成,表明GB具有良好的抗血小板聚集作用[24]。Lamant V等证实,银杏二萜内酯A、B等(BN 52020,52021)以剂量依赖的方式抑制PAF的代谢[25]。在临床试验中,Chung K F等评估了银杏二萜内酯混合物BN 52063(A,40%; B,40%; C,20%)对PAF的影响。结果显示,BN 52063显著抑制血小板富集血浆中PAF诱导的血小板聚集[26]。
楼凤昌等发现了二萜内酯中的一种新化合物银杏内酯K,该化合物对PAF介导的中性粒白细胞β-葡萄糖酸苷酶释放的抑制强于GB[27]。银杏二萜内酯葡胺注射液作为首个上市的强PAF受体拮抗剂,是基于将活性最强的PAF受体拮抗成分GA,GB,GK提取富集的思想开发而来的创新药物,临床主要用于脑梗死(中风病中经络痰瘀阻络证),已逐渐成为防治脑卒中抗血小板药物中的生力军。该药物是以银杏叶提取纯化后所得有效部位银杏二萜内酯(银杏内酯A,B,K等)为原料制成注射液,并在基础和临床方面开展了大量的研究工作,如制备工艺的优化和改进、药效及安全性的严密论证、作用机制的深入探索等方面。
陈春苗、章晨峰、张雯等人分别构建大鼠急性脑缺血再灌注损伤模型,从不同层面展开银杏二萜内酯葡胺注射液防治脑梗死的作用机制研究。研究结果显示,银杏二萜内酯葡胺注射液能显著减少脑梗死率,改善脑神经功能缺损症状,并且能够提高超氧化物歧化酶(SOD)的活性,升高磷酸肌酸激酶(CK)和乳酸脱氢酶(LDH)的水平,降低血清中丙二醛(MDA)、脑型同工酶(CK-B)的含量,减少细胞外游离Ca2+内流,降低脑脊液中氨基酸类(谷氨酸、天冬氨酸、甘氨酸、γ-氨基丁酸和单胺类(去甲肾上腺素、二羟苯乙酸、5-羟色胺、5-羟吲哚乙酸)神经递质的含量,抑制皮层内肾上腺素的减少,以及抑制脑组织中半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)的表达。上述研究结果提示,银杏二萜内酯葡胺注射液可能通过修复血脑屏障、抗自由基损伤、调节脑内氨基酸类和单胺类神经递质的水平、抑制神经细胞凋亡等相关机制干预脑缺血再关注损伤[28-30]。针对急性脑梗死及恢复期患者的大量临床观察表明,银杏二萜内酯葡胺注射液能够抑制患者血小板黏附和聚集,降低血液黏度,延迟血液凝固过程,防止血栓形成,改善血液循环及神经功能的缺损,是防治脑梗死安全、有效的药物[31-39]。
此外,海风藤提取物(海风藤新木脂素复合物以及海风藤酮)对PAF受体也有很高的拮抗活性。通过大鼠脑缺血再灌注研究发现,作为PAF受体拮抗剂的海风藤提取物主要通过以下环节发挥其缺血性脑保护作用:①直接抑制PAF引起的血小板聚集,血栓形成,改善大脑血流量,增加缺血半暗带的血液供给,恢复部分神经元功能,减少细胞凋亡;②拮抗PAF对神经细胞的直接毒性作用;③抑制PLA2的活性,减少PAF等磷脂代谢产物的生成和释放;④拮抗PAF激活的白细胞和黄嘌呤氧化酶系统,抑制自由基的大量释放,提高SOD的活性,增加自由基清除能力;⑤抑制磷酸肌醇代谢及受體调控的钙通道降低细胞内Ca2+的浓度,减轻神经元的损伤;⑥抑制脑缺血时PAF对白细胞、内皮细胞的活化及白细胞与内皮细胞间的粘附,减轻脑缺血后的炎性病理损害;⑦降低缺血后脑组织内兴奋性氨基酸(EEAS)的含量[40-45]。海风藤提取物作为PAF特异性受体拮抗剂,能通过多个途径来抑制PAF激活的病理损害,发挥显著的脑保护作用。
5.2 天然化合物衍生的PAF受体拮抗剂 Merck研究小组发现樟科植物外拉樟桂中提取的木脂素类化合物外拉樟桂脂素(veraguensin)是良好的PAF受体拮抗剂[46],并以其为先导物合成了一系列二芳基四氢呋喃类PAF受体拮抗剂,其中MK-287最受关注。它是一种强效、特异性的PAF受体拮抗剂,且具有口服活性。体内研究表明,MK-287提高了小鼠因PAF致死的存活率,并能增加血浆中N-乙酰-β-D-氨基葡糖苷(NAGA)的活性[47]。
5.3 含季铵盐的PAF结构类似物 Takeda研究小组最早合成了一系列含季铵盐的PAF结构类似物,其中CV-3988能够抑制PAF诱导的兔血小板凝聚和[3H] PAF与人血小板膜结合,但其口服活性很低,高浓度时具有激动活性和溶血性,临床应用受到限制[48]。该小组发现的另一个PAF受体拮抗剂CV-6209,其体外活性是CV-3988的100倍。动物试验显示,它能够显著抑制PAF诱导的低血压、提高动物存活率[49]。在CV-6209基础上进行结构改造,发现了TCV-309。其活性高于先前制备的PAF结构类似物,具有一定的口服活性,并克服了既往PAF结构类似物的诸多缺点[50]。日本卫材公司在改进CV-6209的过程中发现了E-5880。该化合物抑制PAF诱导的人血小板的聚和[3H] PAF与人血小板膜结合的作用非常强。动物试验表明,E-5880能有效抑制由PAF和内毒素诱导的病症[51]。
5.4 含氮杂环化合物 此类化合物结构为含氮杂环,氮原子能通过氢键与受体结合,有助于其发挥对PAF的拮抗活性。研究比较深入的是Boehringer-Ingelheim公司最先发现的WEB2086(Apafant),其口服给药能够抑制PAF诱导的低血压、支气管收缩。Y-24180的结构与WEB2086相似,但抑制PAF诱导的血小板聚集的活性较强,其抑制PAF诱导的小鼠死亡率也较WEB2086高,Y-24180抑制PAF诱导血小板凝聚的血药浓度在3 h达到峰值,48 h仍有作用。Pfizer公司发现的UK-74505(modipafant)也是良好的PAF受体拮抗剂[51]。
6 讨论与展望
近年来,随着社会人口老龄化的加速,脑血管疾病对于社会人类的危害已逐渐加剧。流行病学研究表明,我国脑卒中患病率、复发率和死亡率不断攀升,由此造成的直接和间接经济负担也在不断增长,脑卒中的防治已成为我国慢性病防控的重点。因此,对缺血性脑卒中进行及时、有效的防治,对改善预后、降低致残和死亡率至关重要。endprint
腦卒中是由各种诱发因素引起的急性脑血液循环障碍,脑内动脉管壁血栓形成及脑外形成的栓子阻塞于脑内动脉是其中2个主要因素。血小板在血栓形成中起着重要作用。血栓形成过程中血小板黏附在血管内皮损伤后裸露的胶原表面,血小板激活剂作用于黏附的血小板,促使AA代谢产生TXA2,同时释放出ADP,致使血小板GPⅡb/Ⅲa复合物发生构型变化,形成黏附分子受体,与纤维蛋白原结合,使血小板黏附、聚集形成血栓。同时,血小板的释放产物进一步引起血管收缩、刺激白细胞、损伤内皮细胞、促进血栓形成。因此,抗血小板治疗是脑卒中防治工作的重点。
抗血小板药物可通过多种途径减少血小板的黏附和聚集,抑制血栓形成从而达到防治脑卒中的作用。目前临床上应用的抗血小板药物种类繁多,主要为COX-Ⅰ抑制剂(阿司匹林)、ADP受体拮抗剂(氯吡格雷、普拉格雷、奥扎格雷等)、PDE抑制剂(双嘧达莫、西洛他唑等)、GPⅡb/Ⅲa受体拮抗剂(阿昔单抗、依替巴肽、替罗非班)等。其中,阿司匹林是抗血小板药物中唯一证据等级和循证依据最强的药物,其他药物虽然在临床和科研上具有一定的价值,但是临床证据等级不强,有效性和安全性还有待于进一步探索。抗血小板药物不断显示出其良好的药效,但临床使用过程中所表现出来的,如阿司匹林抵抗、出血倾向、胃肠道反应、过敏反应、个体差异性大等现象,限制了其临床应用,降低了患者的依从性,并未获得满意的治疗效果。
近年来新型的抗血小板药物不断涌现,PAF受体拮抗剂逐渐引起国内外关注。PAF是目前发现的作用最强的脂质递质,亦是介导血小板聚集的另一重要介质。研究发现,PAF是不依赖ADP及TXA2的血小板聚集的媒介,是继ADP、TXA2之后发现的介导血小板聚集的第三条途径的介质。脑缺血时,PAF与G蛋白结合,激活PLC,升高DG和IP3水平,促使细胞内Ca2+增加,活化蛋白激酶C,激活和聚集血小板形成血栓,引起血管栓塞。同时,促使血管活性物质释放,增加血管通透性及炎性反应,引发和加重脑水肿,并且诱导细胞分化,扰乱细胞膜功能。各个环节相互影响和促进,加重了脑损害。
国内外研究不断证实,PAF受体拮抗剂对血小板聚集有显著的抑制作用,是一种具有潜在治疗价值的抗血小板药物。PAF受体拮抗剂根据其来源分为天然和合成两大类。其中,天然PAF受体拮抗剂,如银杏二萜内酯类化合物已经开发成药,倍受国内外研究者关注。大量的基础和临床证据表明,天然PAF受体拮抗剂具有疗效强、毒副作用少,使用安全可靠的特点。因此,对现有的以银杏二萜内酯类化合物为代表的天然PAF受体拮抗剂的进一步深入研究和再评价,以及对新的天然PAF受体拮抗剂的积极探索和发现,都将有助于推动临床脑卒中的防治工作,给更多的患者带来光明。
[参考文献]
[1] 梅斯医学.盘点2016脑卒中重要指南共识回顾[J].心脑血管病防治,2017,17(1):1.
[2] 王陇德,王金环,彭斌,等.《中国脑卒中防治报告2016》概要[J].中国脑血管病杂志,2017,14(4):217.
[3] Reiter R A, Jilma B. Platelets and new antiplatelet drugs [J]. Therapy, 2016, 2(2):465.
[4] Manaktala R, Kluger J. Role of antiplatelet therapy in stroke prevention in patients with atrial fibrillation[J]. J Am Osteopath Assoc, 2017, doi:10.7556/jaoa.2017.148.
[5] Patrono C. Aspirin resistance: definition, mechanisms and clinical read-outs [J]. J Thromb Haemost, 2003, 1(8):1710.
[6] Weisman S M, Graham D Y. Evaluation of the benefits and risks of low dose aspirin in the secondary prevention of cardiovascular and cerebrovascular events [J]. Arch Intern Med, 2002,162: 2197.
[7] CAPRIE Steering Committee. A randomized, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE) [J]. Lancet, 1996, 348:1329.
[8] Guray Y, Guray U, Korkmaz S. Clopidogrel resistance [J]. Anadolu Kardiyol Derg, 2009, 9(3):231.
[9] Price M J. New antiplatelet therapies in development [J]. Am J Health Syst Pharm, 2008, 65(13 Suppl 5): S11.
[10] De Schryver E L, Algra A, van Gijn J. Dipyridamole for preventing stroke and other vascular events in patients with vascular disease [J]. Cochrane Database Syst Rev, 2003(1):CD001820.endprint
[11] Li X, Cong H. Platelet-derived microparticles and the potential ofglycoproteinIIb/IIIa antagonists in treating acute coronary syndrome [J]. Tex Heart Inst J, 2009, 36(2):134.
[12] 周志明. 缺血性卒中二級预防中的抗血小板治疗 [J]. 国外医学·脑血管疾病分册, 2005, 13(12): 915.
[13] 倪金迪, 沈国锋, 李响,等. 抗血小板药预防脑卒中的应用进展 [J]. 中国临床神经科学经科学, 2014, 22(4):412.
[14] Rollini F, Tello-Montoliu A, Angiolillo D J. Atopaxar: a review of its mechanism of action and role in patients with coronary arterydisease[J]. Future Cardiol,2012,8:503.
[15] O′Donoghue M L, Bhatt D L, Wiviott S D, et al. Safety and tolerabilityof atopaxar in the treatment of patients with acute coronary syndromes:the lessons from antagonizing the cellular effects of Thrombin-Acute Coronary Syndromes Trial[J]. Circulation,2011,123:1843.
[16] Satoh K. Plasma platelet-activating factor acetylhydrolase (PAF-AH) deficiency as a risk factor for stroke[J].Brain Nerve, 2008, 60(11):201.
[17] Vargaftig B B, Chignard M, Benveniste J. Present concepts on the mechanisms of platelet aggregation[J].Biochem Pharmacol, 1981, 30(4):201.
[18] Auchampach J A, Pieper G M, Cavero I, et al. Effect of PAF antagonist RP 59227 on myocardical ischemia reperfusion injury and neutrophil function [J]. Basic Res Cadiol, 1998, 93 (5):361.
[19] Keiji, Nishida, Markey S P. Platelet-activating factor in brain regions after transient ischemia in gerbils [J]. Stroke, 1996, 27:514.
[20] Kumark, Harrey, S A K, et al. Production and effects of PAF in the rat brain [J]. Biochem Biophys Acta, 1998, 963:375.
[21] Shi L C, Wang H Y, Friedman, et al. Involvement of PAF in cell death induced under ischemic/postichemia-like condition in an immortalized hippocampal cell line [J]. J Neurochem, 1998, 70(3):1035.
[22] P Golino, Ambrosio G, Ragni M, et al. Short-term and long-term role of platelet activating factor as a mediator of in vivo platelet aggregation [J]. Circulation, 1993, 88:1205.
[23] P Braquet, A Etlenne, C Touvay, et al. Involvement of platelet activating factor in respiratory anaphylaxis, demonstrated by PAF-acether inhibitor BN 52021 [J]. The Lancet, 1985, 325(8444):1501.
[24] Bourgain R H, Andries R, Esanu A, et al. PAF-acether induced arterial thrombosis and the effect of specific antagonists [J].Adv Exp Med Biol,1992, 316: 185.
[25] Lamant V, Mauco G, Braquet P, et al. Inhibition of the metabolism of platelet activating factor (PAF-acether) by three specific antagonists from Ginkgo biloba [J].Biochem Pharmacol, 1987, 36(17): 2749.endprint
[26] Chung K F, Dent G, Mc Cusker M, et al. Effect of a ginkgolide mixture (BN 52063) in antagonising skin and platelet responses to platelet activating factor in man [J]. Lancet, 1987, 1(8527):248.
[27] 楼凤昌, 凌娅, 唐于平,等. 银杏萜内酯的分离 、纯化和结构鉴定 [J]. 中国天然药物,2004, 2 (1):11.
[28] 陈春苗, 周军,陈健等. 银杏二萜内酯葡胺注射液对大鼠急性脑缺血再灌注损伤的影响[J]. 中国实验方剂学杂志, 2014, 20(17):133.
[28] 章晨峰, 曹亮, 邓奕,等. 银杏二萜内酯葡胺注射液对脑缺血再灌注大鼠行为学和脑脊液成分的影响[J]. 中国实验方剂学杂志, 2015, 21(20):118.
[30] 张雯, 宋俊科, 何国荣,等. 银杏二萜内酯对缺血再灌注大鼠脑组织中神经递质的影响[J].中国药理学通报, 2016,32(12):1648.
[31] 肖展翅, 倪小红, 李钢,等. 银杏二萜内酯葡胺注射液对脑梗死恢复期患者血液流变学的影响[J]. 中西医结合心脑血管病杂志, 2015, 13(16):1828.
[32] 邱斌, 肖展翅. 银杏二萜内酯葡胺注射液治疗急性脑梗死的临床观察[J]. 中西医结合心脑血管病杂志, 2015, 13(8):1033.
[33] 高聚, 姜华, 肖展翅等. 银杏二萜内酯葡胺注射液治疗急性脑梗死的临床疗效观察 [J]. 实用心脑肺血管病杂志, 2015, 24(3):133.
[34] 华玉凡. 银杏二萜内酯葡胺注射液治疗缺血性卒中恢复期(痰瘀阻络证)的临床研究 [D].武汉:湖北中医药大学,2015.
[35] 王敏,蔡胜男,李迪.银杏二萜内酯葡胺注射液对急性脑梗死患者神经功能的影响 [J].中国实用神经疾病杂志, 2016, 19(7):29.
[36] 张小罗,王位,陈亨平,等. 银杏二萜内酯葡胺注射液对急性脑梗死合并多发性颅内动脉狭窄患者血清NO、ET-1的影响及疗效观察[J]. 海峡药学, 2017, 29(4):78.
[37] 仲崇金, 华骏, 陈萌,等. 银杏二萜内酯葡胺注射液对缺血性脑卒中急性期损伤的保护作用 [J]. 药物评价研究, 2017,40(6):752.
[38] 王晓勇, 骆守真, 崔春丽. 银杏二萜内酯葡胺注射液治疗急性脑梗死临床研究 [J]. 河北中医, 2017, 39(9):1328.
[39] 骆继业, 谢永鹏, 陈晓兵,等. 银杏二萜内酯葡胺注射液治疗老年急性脑梗死疗效观察 [J]. 世界最新医学信息文摘, 2017,17(58):16.
[40] 刘振华, 冯建利, 杜怡峰,等. 海风藤提取物对大鼠脑缺血再灌注后神经细胞凋亡的影响[J]. 中国老年学杂志, 2008 (20):1977.
[41] 姚博, 冯建利, 阎鹏,等. 海风藤提取物对脑缺血再灌注模型大鼠神经细胞凋亡和线粒体膜电位变化的干预作用 [J]. 中国动脉硬化杂志, 2008 (4):278.
[42] 王雪松, 王伟, 阮旭中. 海风藤提取物对脑缺血保护作用的实验研究 [J]. 中国临床神经科学, 2003 (1):1.
[43] 王伟, 刘洋, 周清明,等. 海风藤醇提取物对血小板活化因子诱导血小板聚集作用的初步研究 [J]. 卒中与神经疾病, 2000 (4):193.
[44] 郭瑞友, 张苏明, 方思羽,等. 海风藤提取物对老龄大鼠缺血性脑损伤保护作用研究 [J]. 华中医学杂志, 2000 (4):177.
[45] 方思羽,张苏明,郭瑞友,等. 海风藤提取物对老龄大鼠缺血性脑损伤保护作用研究 [C]. 歙县:第三届全国中西医结合神经系统疾病学术会议,2000.
[46] Biftu T, Gamble N F, Doebber T, et al. Conformation and activity of tetrahydrofuran lignans and analogues as specific platelet activating factor antagonists [J]. J Med Chem, 1986, 29(10): 1917.
[47] Hwang S B, Lam M H, Szalkowski D M, et al. MK 287:a potent, specific, and orally active receptor antagonist of platelet-activating factor [J]. J Lipid Mediat, 1993, 7(2): 115.
[48] Terashita Z I, Tsushima S, Yoshioka Y, et al. CV-3988: a specific antagonist of platelet activating factor [J]. Life Sci, 1983, 32(17): 1975.
[49] Takatani M, Yoshioka Y, Tasaka A, et al. Platelet activating factor antagonists: synthesis and structure-activity studies of novel PAF analogues modified in the phosphorylcholine moiety [J]. J Med Chem, 1989, 32(1): 56.
[50] Takatani M, Maezaki N, Imura Y, et al. Platelet activating factor antagonists: development of a highly potent PAF antagonist, TCV-309 [J]. Adv Prostag Thromb Leuk Res, 1990, 21B:943.
[51] Negro Alvarez J M, Miralles López J C, Ortiz Martínez JL, et al. Platelet-activating factor antagonists [J]. Allergol Immunopathol (Madr), 1997, 25(5): 121.
[責任编辑 孔晶晶]endprint
