酒石酸美托洛尔与牛血清蛋白相互作用的光谱研究
2018-01-29兰秀风
俞 波, 兰秀风, 陈 奇
(南京航空航天大学 理学院,南京 211106)
蛋白质是人体的基石,承担着组成人体内一切细胞、组织的重任,研究蛋白质是生物医学领域不变的核心课题.其中,血清白蛋白因其本身能结合药物并搬运至靶处的特性,备受生物医学研究者的关注.研究药物与小分子的相互作用,有助于理解药物的传输、分配、生效的机理,也有助于新药的研发与改良.
牛血清蛋白因其具有和人血清蛋白相似的结构与特性,但又相比于人学清蛋白更易于获取,在生物医学领域常被用来作为人血清蛋白的可靠替代品.
酒石酸美托洛尔为β受体阻滞剂,对心脏有较大的选择性,主要用于心率失常、心绞痛、心肌梗塞等,具有减慢心率、减少心输出率、降低收缩压的效果[1].有效成分为美托洛尔,别名倍他乐克.市面上主要有酒石酸美托洛尔和琥珀酸美托洛尔两种,有效成分相同,只是琥珀酸美托洛尔是缓释药,溶解度低,因此我们选择溶解度较高的酒石酸美托洛尔.
1 实验部分
1.1 试剂与仪器
牛血清蛋白(Bovine serum albumin,BSA)购于南京奥多福尼生物科技有限公司,纯度大于80%,分子量66 430,称取适量BSA用含0.05 mol/L NaCl的0.2 mol/L磷酸盐缓冲溶液配制BSA溶液储存.
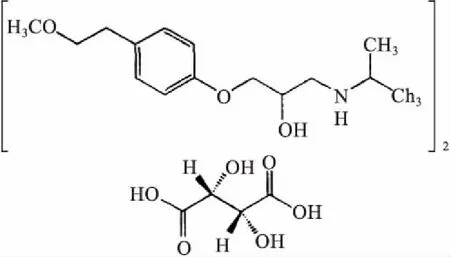
图1 酒石酸美托洛尔结构式
酒石酸美托洛尔(Metoprolol Tartaric Acid,Metoprolol)购于阿斯利康制药有限公司,分子式为(C15H25NO3)2·C4H6O6,分子量为648.82,结构式见图1.
实验用水为蒸馏水,实验用到的仪器为Perkins Elmer LS55荧光分光光度计.
1.2 实验方法
用移液枪取3 mL 5.2×10-7mol/L的BSA溶液转移到荧光比色皿中,水浴加热至25 ℃,在计算机上双击打开FLWINLAB软件并调节好光电倍增管电压.将荧光比色皿放入荧光光谱仪中扫描,采用285 nm激发光波长,激发和发射狭缝宽度为4 nm,扫描速度300 nm/min.先测量未加药时纯BSA溶液的荧光光谱,接着逐次加入5 μL、2.96×10-6mol/L酒石酸美托洛尔溶液测量其光谱(即测5组,每组加入的酒石酸美托洛尔溶液体积分别为0 μL、5 μL、10 μL、15 μL、20 μL).再将水锅温度调节至33 ℃和41 ℃,重复以上操作.
2 结果与讨论
2.1 荧光淬灭光谱
广义上来说,能令荧光强度或相关峰位发生变动的作用过程都可以被称为荧光猝灭(fluorescence quenching).荧光猝灭剂(quencher)是能与荧光物质分子发生相互作用,令荧光强度变化和相关的激发峰位和荧光峰位变化的物质[2].图2为酒石酸美托洛尔对BSA的荧光猝灭光谱.
图2中酒石酸美托洛尔的浓度从1到5依次递增,体系的荧光强度随着酒石酸美托洛尔溶液的滴入规律减小.实验过程中滴加试剂时对BSA溶液产生了稀释效果从而可能导致荧光降低,但每次操作只滴加5 μL酒石酸美托洛尔溶液,总量也只有20 μL,相对于3 mL的BSA溶液,产生的稀释效果可以忽略不计.同时只滴加缓冲溶液的对比实验证明了缓冲溶液本身不会对BSA溶液光谱产生影响,可以排除溶剂对实验的影响.
2.2 荧光猝灭类型
蛋白质和小分子相互作用的猝灭类型,通常被分为两类,分别是静态猝灭和动态猝灭[3].静态猝灭是荧光分子和猝灭分子在基态通过络合反应生成超分子化合物,从而使荧光基团的发光强度减弱;动态猝灭是指荧光物质的激发态分子与猝灭分子发生碰撞,经电荷或者能量的转移后返回到基态的过程.
辨别猝灭类型的方法,通常是根据温度改变前后,猝灭常数的变化趋势予以辨别.温度上升后,如果发生的是动态猝灭,那么粒子的碰撞将会加剧,猝灭常数会上升;相反,若是静态猝灭,结合物的稳定性会随着温度升高而降低,从而猝灭常数也会降低.因此,猝灭机理可以用温度变化来辨别[4-8].
猝灭机制可以由Stern-Volmer方程来描述:
F0/F=1+Kq·τ0·[Q]=1+KSV·[Q]
(1)
式中,[Q]为猝灭剂浓度;Kq为双分子猝灭过程的速率常数,τ0为没有猝灭剂存在下荧光分子的平均寿命(对大多数的生物分子τ0大约是5 ns),Ksv是Stern-Volmer猝灭常数,是双分子猝灭速率常数与单分子衰变速率常数的比率[9-10].
图3给出了不同温度下酒石酸美托洛尔与BSA相互作用的Stern-Volmer曲线.通过拟合得到了Stern-Volmer线性方程、相关系数和数率常数Ksv记录于表1中.
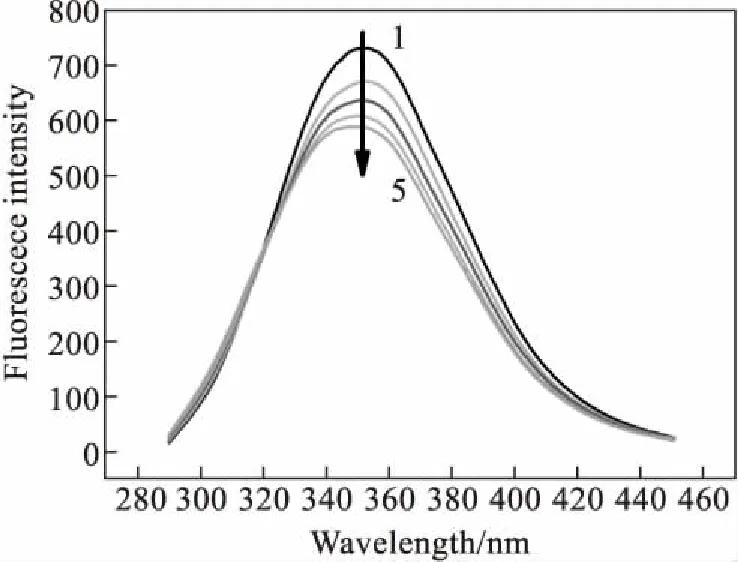
图2 酒石酸美托洛尔对BSA的猝灭光谱[BSA]=2.53×10-6 mol/L,VMetoprolol=0,5,10,15.20 μL(1→5); T=306 K,pH=7.4,λex=285 nm.
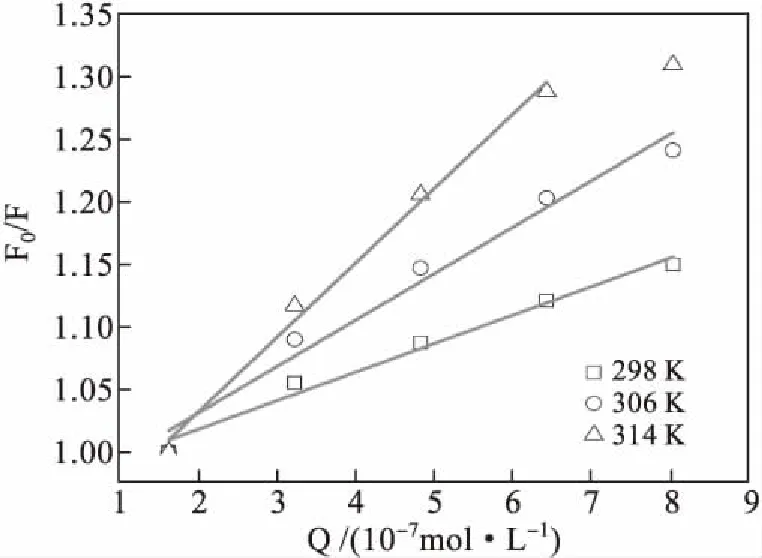
图3 酒石酸美托洛尔与BSA相互作用的Stern-Volmer线[BSA]=2.53×10-6 mol/L,pH=7.4,λex=285 nm.
通过分析图3和表1,我们发现,荧光强度比F0/F随着猝灭剂酒石酸美托洛尔浓度[Q]的增加线性上升,说明酒石酸美托洛尔与BSA相互作用存在单一猝灭类型;同时随着温度上升,Stern-Volmer方程斜率上升,即数率常数Ksv上升,说明酒石酸美托洛尔对于BSA的猝灭类型为动态猝灭.
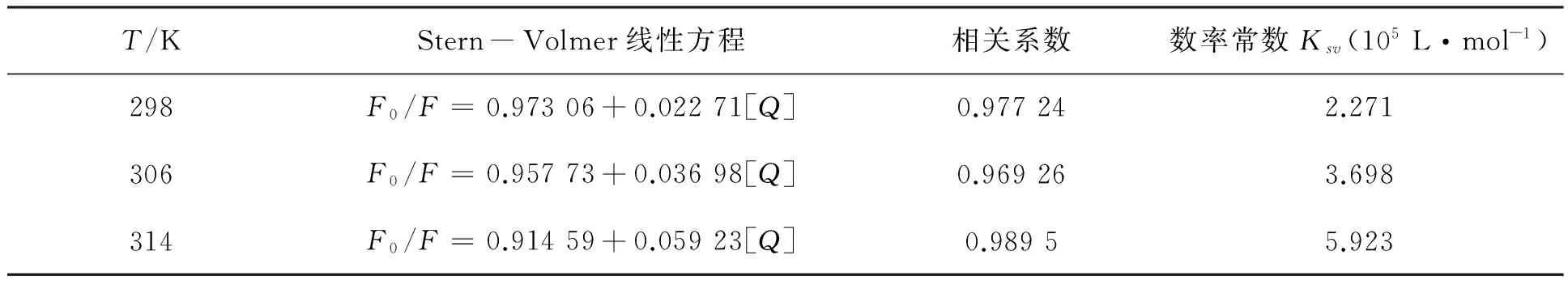
表1 酒石酸美托洛尔-BSA体系的Stern-Volmer方程及数率常数
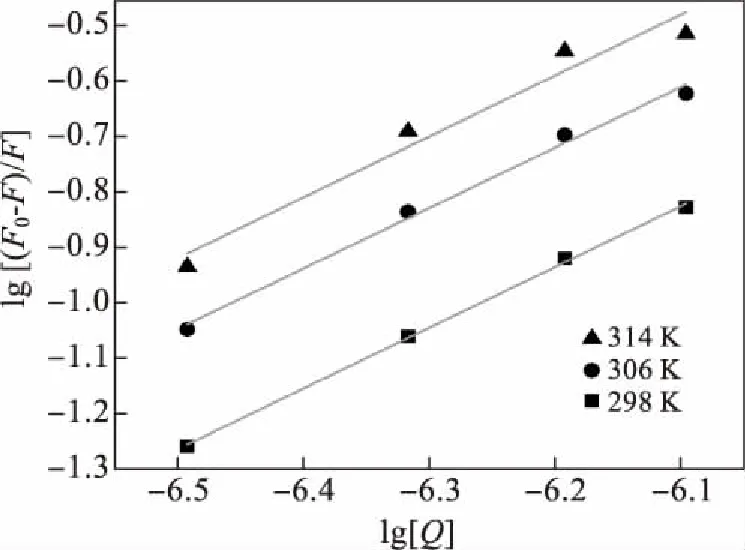
图4 不同温度下lg[(F0-F)/F]对 lg[Q]的拟合直线 [BSA]=2.53×10-6 mol/L,pH=7.4, λex=285 nm.
2.3 结合常数和结合位点
当药物与蛋白质结合形成不发荧光的复合物时,可以用下式计算结合常数和结合位点数:
lg[(F0-F)/F]=lgKA+lg[Q]
(2)
式2中,F0、F表示添加BSA前后体系的荧光强度,[Q]为添加的猝灭剂的浓度,KA为药物分子与蛋白质生物大分子的表观结合常数[11].当在BSA中逐滴加入猝灭剂酒石酸美托洛尔后,以lg[(F0-F)/F]对lg[Q]作图可以拟合得到一条直线,如图4.
从图4中可以看到不同温度下,双对数曲线均保持良好的线性关系.将各个温度的结合位点数n和表观结合常数汇总可得表2.
从表2可以看出,酒石酸美托洛尔与BSA的结合位点数为1,说明酒石酸美托洛尔与BSA有单一的结合位点且受温度影响较小.

表2 结合反应常数与结合位点
2.4 作用力类型的确定
药物与大分子之间的相互作用类型包括氢键、范德华力、静电引力和疏水作用等,通过反应前后的焓变ΔH和熵变ΔS可以判断药物与蛋白质分子之间的主要作用类型:当ΔH>0,ΔS>0时,主要作用力为疏水作用力;当ΔH<0,ΔS<0时,主要作用力为氢键和范德华力;当ΔH<0,ΔS>0时,主要作用力为静电引力[12-13].当温度变化不大时,这些数据可以用下列公式求出:
ΔG=-R·T·lnKA
(3)
ln(K2/K1)=(ΔH/R)·(1/T1-1/T2)
(4)
ΔG=ΔH-T·ΔS
(5)
其中R为理想气体常数,把体系中的表观结合常数对应着各自的温度带入上面3个公式中,即可得到各温度下对应的ΔH、ΔG、ΔS,见表3.

表3 热力学参数
从表3中可以看出,对于在酒石酸美托洛尔与BSA的作用过程中,ΔG<0,说明作用过程是一个熵增加、吉布斯自由能降低的自发过程;同时ΔH>0,ΔS>0,说明酒石酸美托洛尔与BSA之间的主要相互作用为疏水作用力[14-15].
3 结论
本文采用荧光光谱分析法对酒石酸美托洛尔-BSA系统相互作用机制、作用力类型进行了定性分析,根据研究结果可知,酒石酸美托洛尔对BSA的荧光淬灭类型为动态猝灭;依据双对数模型定量算出结合位点数和不同温度下的表观结合常数KA,酒石酸美托尔与BSA以1∶1比例结合,受温度影响较小;两者之间的作用力主要是疏水作用力,吉布斯自由能ΔG<0,表明结合过程是一个吉布斯自由能降低的自发过程.
[1] 程明静,周进才,张松闯.围生期心肌病心力衰竭患者使用酒石酸美托洛尔治疗的临床观察[J].中国实用医药,2014(32):137-138.
[2] 许金钩,王尊本.荧光分析法[M].北京:科学出版社,2006.
[3] BOLLI A,MARINO M,RIMBACH G,et al.Flavonoid binding to human serum albumin[J].Biochemical & Biophysical Research Communications,2010,398(3):444-449.
[4] 吴根华,汪春华.荧光法研究Pb2+与牛血清白蛋白的相互作用[J].光谱学与光谱分析,2005,25(2):246-248.
[5] 李春艳,阮冠宇,单丽,等.两种方法研究新型光敏剂五聚赖氨酸-2-羰基酞菁锌与牛血清白蛋白相互作用[J].福建医科大学学报,2010,44(4):244-248.
[6] 鞠鹏.半导体纳米材料的合成及其毒理作用和光电催化降解污染物的研究[D].泰安:山东农业大学,2012.
[7] 何丽君,霍彩霞,杨彩玲,等.绞股蓝皂苷与牛血清白蛋白相互作用的荧光光谱研究[J].化学研究,2012,23(1):67-70.
[8] 董丽红.植物生长调节剂与生物大分子相互作用光谱研究及其分析应用[D].济南:山东大学,2008.
[10] 周新记,陈坚.三杯法探讨基于荧光多猝灭响应原理光纤化学传感器的响应机制[J].分析科学学报,1997(4):300-303.
[10] 李改仙,李建晴,魏玉霞,等.四碘荧光素与牛血清白蛋白相互作用的荧光光谱研究[J].光谱学与光谱分析,2005,25(8):1277-1280.
[11] 曹团武,杨季冬,吴兴发,等.光谱法研究雷尼替丁与牛血清白蛋白的相互作用[J].化学研究与应用,2009,21(9):1255-1259.
[12] 高筱玲.血红蛋白与双十二烷基二甲基溴化铵相互作用的研究[D].太原:山西大学,2008.
[13] 敖登高娃,金迎春.芬布芬与牛血清白蛋白相互作用的荧光光谱检测[J].发光学报,2011,32(4):404-410.
[14] 刘雪锋,夏咏梅,曹玉华,等.香豆素类中药有效成分与牛血清白蛋白结合的构效关系[J].高等学校化学学报,2006,27(1):150-152.
[15] 领小,博日吉汗格日勒图,娜日苏,等.胡椒碱与牛血清白蛋白的作用及Cu2+、Fe3+影响的研究[J].分析测试学报,2008,27(10):1049-1053.
