深低温降低缺血大鼠大脑MMP- 9和NPY蛋白水平
2018-01-29黄秋玉
黄 清,徐 蔚,黄秋玉
(1.福建医科大学附属第二医院 神经外科,福建 泉州 362000;2.昆明医科大学第二附属医院 神经外科,云南 昆明 650101;3.福建医科大学附属第二医院 手术室,福建 泉州 362000)
中枢神经元对缺血缺氧耐受性极差,常温状态下缺血超过5~8 min[1]即可导致严重且不可逆性损伤,这是临床上缺血缺氧性脑病预后不良的重要原因。低温可以有效降低脑细胞新陈代谢和氧耗,改善缺血局部微环境,抑制神经干细胞凋亡的同时减少炎性因子的释放,从而提高神经元缺血缺氧耐受性[2- 3]。目前对其机制中损伤因子与保护因子的表达变化及其相互关系仍不清楚。基质金属蛋白酶家族重要成员MMP- 9和中枢神经核团重要递质NPY可间接反映脑神经元缺血缺氧的损伤程度[4- 5],本文研究不同温度下急性缺血大鼠大脑MMP- 9和NPY的表达变化,进一步揭示深低温对脑的保护机制。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级雄性SD大鼠63只,体质量250~300 g[上海斯莱克实验动物有限责任公司,实验动物合格证编号:SCXK(沪)2012- 0002]。
1.1.2 主要试剂:鼠抗大鼠β-action单克隆抗体、羊抗鼠MMP- 9单克隆抗体、兔抗鼠NPY多克隆抗体和ECL发光试剂(Santa Cruz公司);过氧化物酶标记的相应二抗(羊抗鼠IgG、兔抗羊IgG和羊抗兔IgG)(北京中杉金桥生物技术有限公司)。
1.2 主要方法
1.2.1 脑缺血模型的建立及取材:参考文献[6- 10]报道的方法建立脑缺血模型,大鼠体外循环各项参数设置见参考文献[11- 12]。随机分为对照(NC)组、常温缺血(NTCA)组和深低温缺血(DHCA)组,每组(n=21),另取10 只大鼠作为循环供血及后备使用。
1.2.2 脑含水量测定:取出新鲜右侧大脑半球后立即称湿重,后置入110 ℃恒温箱中,24 h后立即称干重。脑含水量=(湿重-干重)/湿重×100%。
1.2.3 检测MMP- 9和NPY的表达
1.2.3.1 HE染色及免疫组化:取制备好的额叶皮质100 mg,用OCT冰冻包埋后连续切片,厚度约2 μm,0.01 mol/L PBS液接片后在37 ℃下山羊血清封闭2 h,加一抗(1∶100),4 ℃下反应72 h,加二抗,37 ℃下作用2 h,PBS液漂洗4次,DAB显色10~15 min后漂洗4次,脱水透明,封片后烘干,分别行HE染色和免疫组化分析。随机选取各组大鼠脑切片10张,每张图像选取5个不同的高倍视野,计算每个视野下MMP- 9及NPY阳性细胞均数(棕黄色或褐色),并以胞核呈蓝色,胞质呈红色,胞膜、胞核和核仁完整者为存活神经元计算神经元存活率(神经元存活率=正常神经元/神经元总数×100)。
1.2.3.2 Western blot检测:MMP- 9蛋白表达取制备好的额叶皮质100 mg,剪碎后加入1mL含PMSF单去污剂裂解液进行匀浆,冰块上裂解30 min,裂解液在4 ℃ 12 000 r/min离心5 min,取上清液,BCA法行蛋白定量(以含100 μg蛋白的均浆液为上样量)。样本与1/3的4×SDS凝胶上样缓冲液混合,煮沸变性5~10 min,制成10% SDS-PAGE分离胶与4%浓缩胶后上样(总体积20 μL)。100 V电泳分离2~3 h,300 mA恒流1 h,湿转至0.45 mm PVDF膜上,5%脱脂奶粉TBS缓冲液室温封闭3 h。在分别与MMP- 9多抗(1∶500)、β-action单抗(1∶1 000)、NPY多抗(1∶500)溶液混合,4 ℃静置过夜,与HRP标记的相应二抗(1∶8 000)室温孵育1 h,一次与ECL试剂盒A液和B液反应,压片、X线片曝光显影,拍摄照片。用ImagePro-Plug6.0分析软件测定目的条带的IA,以β-action条带的IA值比值作为目的蛋白的相对表达量。
1.3 统计学分析
2 结果
2.1 脑组织含水量的变化
NTCA组大鼠脑组织含水量最高,DHCA组次之,NC组最低(P<0.05)(表1)。

表1 各组大鼠脑组织含水量及额叶皮质神经元存活率
*P<0.05 compared with NC;△P<0.05 compared with NTCA
2.2 脑组织形态学变化
2.2.1 HE 染色:1)NC组神经元未见明显病理学改变(图1A);2)NTCA组部分神经元胞体肿胀,核固缩,伴炎细胞浸润及胶质增生(图1B);3)DHCA组神经核染色略加深,少量神经元变性(图1C),细胞存活率较NTCA组提高(P<0.05)(表1)。
2.2.2 免疫组化结果:各组切片免疫组化显示,MMP阳性细胞呈棕黄色,大部分分布于神经元胞质中。NPY阳性细胞为棕褐色,多数分布于胞核内。
2.3 神经元胞核中NPY及MMP- 9表达的变化
1)免疫组化显示NC组大鼠额叶中仅有少量神经元表达MMP- 9,分布于皮质各区,染色物质均位于胞核内,染色浅(图2A);NTCA组可见部分神经元胞体破裂,阳性物质染色深,部分溢出于胞外(图2B);DHCA组神经元结构形态完整,染色较浅,阳性物质均位于胞质内(图2C)。Western blot显示NTCA组和DHCA组MMP- 9蛋白的表达均较NC组明显增多,其中,NTCA组的表达量要高于DHCA组(P<0.05)。

A.normal control group; B.normal temperature group; C.deep hypothermia group图1 低温对缺血大鼠额叶皮质神经元损伤的影响Fig 1 Effect of low temperature on the damage of rat frontal cortex neurons(×200)

A.normal control group; B.normal temperature group; C.deep hypothermia group; D.normal control group; E.normal temperature group; F.deep hypothermia group
2)免疫组化显示NC组大鼠额叶有稳定量的NPY表达,神经元胞体结构清晰,阳性产物位于胞核和胞质内,染色深(图2D);NTCA组和DHCA组中的NPY阳性物质较NC组明显减少(图2E, F)。Western blot 显示NTCA组和DHCA组大鼠额叶NPY蛋白的表达与NC组比较均有明显降低,但NTCA组中NPY表达的减少要比DHCA组更为显著(P<0.05)(图2,3,表2,3)。
*P<0.05 compared with NC;△P<0.05 compared with NTCA.
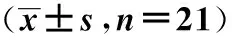
表3 深低温对缺血大鼠大脑MMP- 9及NPY表达的影响
*P<0.05 compared with NC;△P<0.05 compared with NTCA.

*P<0.05 compared with NC; #P<0.05 compared with NTCA图3 3组大鼠大脑皮质MMP- 9和NPY蛋白的表达Fig 3 Expression of MMP- 9 and NPY proteins in the cerebral cortex of the three groups of rats
3 讨论
脑缺血后,氧气和葡萄糖大量消耗,神经元能量枯竭,胞膜内外离子梯度失调等,引起细胞兴奋毒性、钙超载和氧自由基损伤等,导致蛋白质和DNA等裂解,促使细胞凋亡或坏死[13]。低温则通过降低组织代谢率增强了神经元的缺氧耐受性。其中,MMP- 9和NPY发挥了重要作用。
本实验中,常温状态下体外停循环导致的急性脑缺血缺氧诱发了严重的脑水肿,同时MMP- 9的表达明显增高。低温在相同条件下改善了脑部缺血微环境,强化了抗缺血半暗带细胞的凋亡作用,诱导缺血耐受的同时有效地减少了炎性因子的过度释放,抑制了MMP- 9的过度表达,从而为修复损伤的内源性神经干细胞的增殖和激活提供了有利条件[14]。低温还可能通过阻断金属蛋白酶对细胞外基质和基底膜的降解,维持血管内皮微结构完整,大大减轻了脑水肿的发生[15]。
本实验从相反方向揭示了低温的脑保护作用。NPY在正常脑细胞中达到稳态,而缺血导致胞膜内外离子梯度失调诱发胞膜去极化[14,16],使细胞间传导功能障碍从而导致病理性损伤。NPY的急剧减少就是一个有力的证据。我们观察到,常温缺血导致的NPY下降与脑水肿程度及MMP- 9的表达水平呈高度负相关,这表明NPY作为急性应激相关性神经肽在神经元损伤中扮演着保护性因子的作用,低温则能够在相同条件下维持NPY的表达在一个相对较高的水平,有报道[16]低温诱导EPO游离受体表达、促进神经元再生并调控血管内皮生长因子(VEGF)介导缺氧预适应,从而发挥脑保护作用。
综上所述,缺血可诱导大鼠大脑皮质损伤因子MMP- 9的表达,及抑制保护因子NPY的表达,而低温在相同条件下降低了NPY的下降幅度及减少了MMP- 9的表达,从而发挥脑保护作用。
[1] Li Y, Chopp M. Temporal profile of nestin expression after focal cerebral ischemia in adult rat[J]. Brain Res, 1999, 838: 1- 10.
[2] Shoshani T, Faerman A, Mett I,etal. Identification of a novel hypoxia-inducible factor 1-responsive gene, RTP801, involved in apoptosis[J]. Mol Cell Biol, 2002, 22: 2283- 2293.
[3] Behringer W, Prueckner S, Kentner R,etal. Rapid hypothermic aortic flush can achieve survival without brain damage after 30 minutes cardiac arrest in dogs[J]. Anesthesiology, 2000, 93: 1491- 1499.
[4] Rosenberg GA, Cunningham LA, Wallace J,etal. Immunohistochemistry of matrix metalloproteinases in reperfusion injury to rat brain: activation of MMP- 9 linked to stromelysin- 1 and microglia in cell cultures[J]. Brain Res, 2001, 893: 104- 112.
[5] Iwai M, Sato K, Kamada H,etal. Temporal profile of stem cell division, migration, and differentiation from subventricular zone to olfactory bulb after transient forebrain ischemia in gerbils[J]. J Cerebr Blood F Met, 2003, 23: 331- 341.
[6] Czyz J, Wiese C, Rolletschek A,etal. Potential of embryonic and adult stem cellsinvitro[J]. Biol Chem, 2003, 384: 1391- 1409.
[7] Behringer W, Safar P, Wu X,etal. Survival without brain damage after clinical death of 60-120 mins in dogs using suspended animation by profound hypothermia[J]. Crit Care Med, 2003, 31: 1523- 1531.
[8] An Y, Xiao YB. The preventative role of growth hormone on acute liver injury induced by cardiopulmonary bypass in a rat model[J]. Eur J Cardio Thorac, 2007, 31: 1037- 1043.
[9] Zhu J, Yin R, Shao H,etal. N-acetylcysteine to ameliorate acute renal injury in a rat cardiopulmonary bypass model[J]. J Thorac Cardiov Sur, 2007, 133: 696- 703.
[10] An Y, Xiao Y, Zhong Q. Good recovery after nontransthoracic cardiopulmonary bypass in rats[C]. Heart Surg Forum, 2006, 10: E73- 77.
[11] Khaladj N, Peterss S, Oetjen P,etal. Hypothermic circulatory arrest with moderate, deep or profound hypothermic selective antegrade cerebral perfusion: which temperature provides best brain protection?[J]. Eur J Cardio Thorac, 2006, 30: 492- 498.
[12] Tatemoto K, Carlquist M, Mutt V. Neuropeptide Y—a novel brain peptide with structural similarities to peptide YY and pancreatic polypeptide[J]. Nature, 1982, 296: 659- 660.
[13] Fujimoto M, Takagi Y, Aoki T,etal. Tissue inhibitor of metalloproteinases protect blood—brain barrier disruption in focal cerebral ischemia[J]. J Cerebr Blood F Met, 2008, 28: 1674- 1685.
[14] 江基尧, 徐蔚, 杨朋范,等. 选择性脑超深低温技术对猴颈动脉血流阻断时限的研究[J]. 中华神经外科杂志, 2003, 19:304- 306.
[15] Power C, Henry S, Del Bigio MR,etal. Intracerebral hemorrhage induces macrophage activation and matrix metalloproteinases[J]. Ann Neurol, 2003, 53: 731- 742.
[16] Gradin KA, Li JY, Andersson O,etal. Enhanced neuropeptide Y immunoreactivity and vasoconstriction in mesenteric small arteries from spontaneously hypertensive rats[J]. J Vasc Res, 2003, 40: 252- 265.
