CD11c+DCs促K14-VEGF转基因小鼠银屑病样发病
2018-01-29郭政宏严亨秀
张 怡,周 彪,郭政宏,龙 虎,严亨秀
(西南民族大学, 四川 成都 610041)
FLT3配体(ligand of FMS-like tyrosine kinase 3,FL)是刺激树突状细胞(dendritic cells,DCs)成熟的主要的几种生长因子之一[1],FL/FLT3信号使DCs维持特定的功能。因此,FLT3可以作为靶分子,通过影响DCs调节,进而调节免疫应答。有研究使用FLT3抑制剂治疗急性髓性白血病[2];还有使用FLT3抑制剂CEP- 701抑制DCs治疗C57小鼠的实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)[3],有效改善了发病小鼠的症状,但其作用机制仍不清楚。
DCs是机体内最强的专职抗原递呈细胞,可以有效刺激初始性T细胞活化,是机体免疫反应的主要启动者。DCs作为T细胞的上游,特定的DCs亚型刺激T细胞分化为特定亚型。比如,DCs可以分泌IL- 23、TGF-β和IL- 6等细胞因子,刺激T细胞分化为Th17细胞,Th17细胞在特定的免疫机制中发挥重要的作用[4]。因此,以DCs为靶细胞改善机体的免疫力将是一种比以T细胞为靶细胞更为精确和有效的治疗免疫性疾病的方法。
本研究通过向K14-VEGF转基因小鼠皮下注射FMS样酪氨酸激酶3阳性树突状细胞(CD11c+DCs),观察并分析CD11c+DCs在银屑病模型鼠中的作用及其免疫机制。
1 材料与方法
1.1 材料
SPF级K14-VEGF转基因小鼠,6周龄雄性,体质量约为25 g(四川大学生物治疗国家重点实验室馈赠)是自身性免疫性疾病银屑病的转基因鼠模型[5]。K14-VEGF转基因小鼠具有稳定的银屑病临床表现,幼鼠在最初不会表现银屑病的临床症状,3月龄小鼠的耳朵和颈部小部分皮肤开始出现银屑病样改变,包括表皮增生,表皮分化能力改变,血管黏附分子上调等特征。5月龄以上小鼠银屑病样症状加重,背部发病,病理区逐渐扩大,直至最后红斑结痂渗出液覆盖耳朵和背部大面积皮肤。
饲养小鼠的动物房温度为(25±1)℃,相对湿度为60%±10%,自由摄食与饮水。
小鼠白细胞介素4(IL- 4),小鼠粒细胞巨噬细胞集落因子(GM-CSF)和小鼠FLT3配体(FL)(PeproTech公司);亚美尼亚仓鼠抗小鼠CD11c抗体(Abcom公司);兔抗小鼠FLT3抗体(Santa Cruz公司);羊抗兔-FITC荧光标记二抗和蛋白A荧光-TRITC荧光标记二抗(武汉博士德生物工程有限公司).
1.2 方法
1.2.2 体外CD11c+DCs的诱导培养:为了获得纯度较高的CD11c+DCs,用IL- 4、GM-CSF和FL等细胞因子诱导DCs定向分化及成熟,采用半量换液法去除漂浮的非树突状细胞,弃去的悬浮细胞中主要包括T细胞、B细胞、粒细胞、死细胞、细胞碎片及少量单核细胞和树突状细胞。具体方法是取BABL/c小鼠双侧股骨和胫骨内骨髓细胞。细胞计数,调整细胞为(1~2)×10-6/mL,使用含有IL- 4(20 ng/mL)、GM-CSF(20 ng/mL)和FL(FLT3配体)(10 ng/mL)的RPMI 1640(含血清&抗生素)培养基培养细胞,2、4、6和8 d吸取最上层培养基半量换液,第9天收细胞,流式抗体CD11c-PerCP和FLT3-PE染色,使用流式细胞计量术分析。
1.2.3 K14-VEGF小鼠皮下注射CD11c+DCs:选取12只6周龄未发病K14-VEGF转基因小鼠,随机分为对照组(n=6)和实验组(n=6)。重复1.2.2中的方法培养CD11c+DCs细胞,分别于第1天和第8天注射入实验组小鼠颈部皮下[6],对照组小鼠皮下注射培养基作为对照。
1.2.4 对实验小鼠进行分析:观察小鼠临床表现以及病理区变化情况,依据小鼠银屑病样皮损面积和疾病严重程度(psoriasis area and severity index,PASI)评分标准给予小鼠皮损处红斑(erythema)、鳞屑(scales)和浸润增厚程度(thickness)0~4的积分: 0,无;1,轻度;2,中度; 3,重度; 4,极重度。将3者积分相加得到总积分(0~12),红斑根据颜色深浅,鳞屑根据覆盖面积占发病皮肤总面积的比例计算,对各组小鼠皮损总积分取平均值后绘制趋势线。
注射后第21天取小鼠耳部、颈部以及颈部至背部约1.5 cm的皮肤做石蜡切片,进行HE染色,检测组织学变化;流式细胞术分析实验组和对照组小鼠骨髓、血液、脾脏和颌下淋巴结中的T淋巴细胞和DCs的变化;免疫荧光法分析小鼠皮损中CD4、CD8、IL- 17a、IFN-γ和CD31的变化;HE染色方法观察小鼠心、肝、脾、肺和肾的变化。
1.3 统计学分析

2 结果
2.1 CD11c+DCs表型鉴定
成熟DCs形状似星形、多边形或梭形, FLT3分子和CD11c分子分布于成熟CD11c+DCs表面。图1C为荧光双染图片,绿色荧光(图1A)标记的FLT3分子和红色荧光(图1B)标记的CD11c分子同时在CD11c+DCs细胞膜显色,反映FLT3分子和CD11c分子在DCs膜上表达阳性。K14-VEGF小鼠皮损中90% FLT3阳性细胞表达CD11c。

A. FLT3-FITC; B. CD11c-PE; C. merge image of double immunofluorescence图1 免疫荧光双染法对CD11c+DCs进行表型鉴定Fig 1 Phenotype identification of CD11c+DCs by immunofluorescence
2.2 CD11c+DCs对K14-VEGF转基因小鼠的影响
2.2.1 CD11c+DCs流式细胞术检测:图2A为培养中的DCs,可见明显的树突状分支和模糊的细胞核。
诱导培养至第9天,CD11c+DCs细胞比率为80.23%±3.10%(n=6)(图2B)。
选取适合的截止高度角,保障算法的可用性,设置好检测门限阈值,可以有效地进行周跳的探测。成功探测到周跳后,利用Chebyshev多项式拟合进行计算修复。值得注意的是,本文的方案可以有效地对独立的单频接收机发生的周跳进行探测和修复,减小了对接收机性能的要求,增强系统的可靠性。

A.form of DCs; B.purity detection of bone marrow cells by flow cytometry图2 IL- 4、GM-CSF和FL诱导分化后的CD11c+DCsFig 2 CD11c+DCs induced by IL- 4, GM-CSF and FL
2.2.2 K14-VEGF转基因小鼠注射CD11c+DCs后的临床表现:实验组小鼠在第3天耳朵面部出现少量红斑,对照组小鼠无变化。随着时间延长,实验组小鼠银屑病样皮损逐渐加重,在第7天已有小鼠两耳间出现明显红斑,少量的结痂,皮肤的增厚。对照组小鼠仍无任何银屑病样临床症状。第8天进行第2次细胞注射,注射部位与第1次相同,继续观察小鼠。在第21天时实验组小鼠耳朵背部皮肤出现红斑,结痂较多,皮肤有渗出液且较厚,严重的有血点出现,而对照组只有部分小鼠耳朵面部刚刚出现红斑(图3)。
实验组小鼠比对照组小鼠发病快,且发病程度十分严重。第21天时,实验组小鼠红斑平均积分、鳞屑的平均积分和浸润增厚程度的平均积分均显著高于对照组。实验组小鼠PASI的平均总积分显著低于对照组(P<0.01)(表1)。
2.2.3 小鼠皮损处组织学变化:第21天所有实验小鼠的耳朵和背部皮肤切片组织学观察并统计结果如下。
2.2.3.1 实验组小鼠耳部和背部表皮层厚度增加。第21天实验组小鼠耳朵皮肤表皮厚度为(29±4)μm,显著高于对照组的(11±2)μm(P<0.01)(图4A)。
实验组小鼠背部皮肤表皮厚度为(25±3)μm,显著高于对照组(9±1)μm(P<0.01)(图4B)。
2.2.3.2 实验小鼠耳朵棘突明显增加。皮肤中发现棘突结构是人类银屑病患者最典型且最容易识别的组织学表现,只在K14-VEGF转基因模型鼠中才有棘突结构的出现。
棘突结构表现在K14-VEGF发病小鼠耳朵腹侧面皮肤表皮层。伴随棘突结构的出现,银屑病症状会加重,如炎性细胞浸润增加,角化过度和局灶性角化不全增强。实验组小鼠单位长度棘突数量为11.9±4.1,显著高于对照组的2.0±1.3(P<0.01,n=6),表明实验组小鼠已具有一种典型银屑病样变化(图4C)。
2.2.4 多个免疫器官中CD11c+DCs和T淋巴细胞减少:1)与对照组相比,实验组小鼠骨髓和淋巴结中CD11c+CD11c+DCs显著降低 (图5,表2)。2) 实验小鼠T淋巴细胞明显降低,其中Th17和Th1均下降。
实验组小鼠血液中CD3+CD4+T淋巴细胞数为(17.87±0.23)个,明显低于对照组(31.77±0.54)(P<0.01,n=6)(图6A)。
与对照组相比,实验组小鼠骨髓、血液、脾脏及颌下淋巴结中的CD3+CD4+IL- 17a+Th17细胞及CD3+CD4+IFN-γ+Th1细胞数量均显著降低(P<0.01)(图6B,表3)。
2.2.5 皮损处CD4+、CD8+、IL- 17a+和IFN-γ+淋巴细胞和血管改变:实验组小鼠CD4+、CD8+、IL- 17a+或IFN-γ+细胞数显著高于对照组(P<0.01,n=6);实验组小鼠血管数也较对照组明显增加(P<0.01,n=6)(图7,表4)。

图3 实验小鼠临床表现和PASI积分Fig 3 Clinical manifestation and PASI scores of mice skin lesions

grouperythemascalesthicknessPASIcontrol 0.83±0.41 0.50±0.55 0.17±0.41 1.50±1.05experiment 2.67±0.52* 2.33±0.52* 2.00±0.63* 7.00±0.89*
*P<0.01 compared with control.

A.ear skin; B.back skin; C.epidermal rete ridge structures from ear skin图4 细胞注射后21 d时小鼠耳部和背部受损皮肤Fig 4 Mice ear and back skin lesions on day 21 after injecting DCs

图5 小鼠骨髓和颌下淋巴结内的CD11c+DCs数量显著变化Fig 5 Significient change of the number of CD11c+DCs from bone marrow and submaxillary lymph nodes in mice
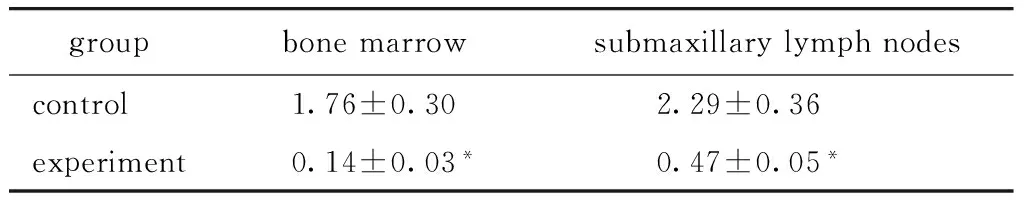
groupbonemarrowsubmaxillarylymphnodescontrol1.76±0.302.29±0.36experiment0.14±0.03*0.47±0.05*
*P<0.01 compared with control.
2.2.6 实验组小鼠心、肝、脾、肺和肾的组织学特征无明显改变:实验组小鼠与对照组小鼠比较,各脏器组织形态无明显变化,表明CD11c+DCs注射对内脏无明显不良反应。
3 讨论
在银屑病中,pDCs和mDCs分泌IFN-α、IL- 12和IL- 23,进而刺激初始T细胞分化为Th1和Th17细胞[7]。在注射CD11c+DCs后,皮损处的CD4+T淋巴细胞、CD8+T淋巴细胞、IL- 17a+细胞、IFN-γ+细胞和CD31分子均显著增多。CD8+T淋巴细胞增多提示,CD8+炎性淋巴细胞渗出增多;CD31分子染色显示,血管数量增多:提示皮损区血管扩张和数量增加。银屑病皮损中CD4+T淋巴细胞和CD8+T淋巴细胞产生IL- 17[8]。银屑病是由Th17/Th1混合介导的自身免疫性疾病[6,9]。Th1和Th17细胞为CD4+T细胞分化而来,INF-γ由Th1产生,且是Th1的标志性细胞因子;IL- 17由Th17产生,且是Th17的标志性细胞因子。IL- 17具有致炎性[10],可以诱导促炎细胞因子、趋化因子和基质金属蛋白酶的表达,引起组织细胞浸润和组织破坏。IL- 17协同IFN-γ通过人类角质形成细胞增加前炎性细胞因子的产生,也许会参与中性粒细胞在银屑病皮损中的浸润(血管周围中性粒细胞的浸润和表皮中性粒细胞微脓疡的形成)。

A.number of CD3+CD4+T lymphocytes cells; B.number of Th1, Th17 cells from bone marrow, spleen, submaxillary lymph nodes and blood in mice

图6 K14- VEGF转基因小鼠骨髓、脾脏、颌下淋巴结和血液中的T淋巴细胞数
*P<0.05,**P<0.01 compared with control.

All the data between the experimental group and the control group is significantly图7 小鼠皮损处CD4+, CD8+, IL- 17a+, IFN-γ+和CD31+细胞的免疫荧光Fig 7 CD4+, CD8+, IL- 17a+, IFN-γ+ and CD31+ immunofluorescence in the lesion skins of K14-VEGF mice

groupCD4+CD8+IL-17a+IFN-γ+CD31+control7.12±1.455.64±1.226.43±1.219.76±2.4424.50±4.53experiment21.32±2.31*13.43±2.12*19.86±2.87*25.54±11.68*53.30±9.86*
*P<0.01 compared with control.
在骨髓的流式细胞术分析中,实验组CD11c+FLT3+DCs少于对照组。颌下淋巴结在小鼠的颈部,距K14-VEGF小鼠发病皮肤较近。实验组CD11c+FLT3+DCs细胞数少于对照组。实验组中的脾脏和血液中的CD11c+FLT3+DCs细胞数量与对照组相比未见差异。
对骨髓、脾脏、颌下淋巴结和血液的流式细胞术分析表明,血液中的CD3+CD4+双阳性细胞数量减少,其他组的CD3+CD4+双阳性细胞数量无显著性差异。在CD3+CD4+IL- 17a+和CD3+CD4+IFN-γ+的流式细胞术分析中,实验组细胞数量均减少,且具有极显著差异。
皮损处CD4+T淋巴细胞、CD8+T淋巴细胞、IL- 17a+细胞、IFN-γ+细胞和血管数均增多,致使小鼠皮肤表皮层和颗粒层增厚,出现棘突,皮肤出现鳞屑、红斑和结痂等临床特征。证明CD11c+DCs通过直接或间接对CD4+T淋巴细胞、CD8+T淋巴细胞、IL- 17a+细胞、IFN-γ+细胞和CD31分子等产生作用促进K14-VEGF小鼠发病。
背部注射CD11c+DCs后,小鼠体内DCs和T细胞数量减少。被激活的DCs可以通过分泌IL- 6,增强效应T细胞的功能,限制调节性T细胞的数量[11]。调节性T细胞抑制效应T细胞用来维持免疫平衡状态。反过来,不受限制的效应T细胞会减少调节性T细胞的数量或降低功能,引起自身免疫性疾病[12]。有报道,银屑病中的调节性T细胞机能下降,抑制能力减弱[13]。或许CD11c+DCs与体内DCs和T细胞之间有一种抑制机制,但是作用通路尚不可知,还有待进一步研究。
[1] O’Keeffe M, Hochrein H, Vremec D,etal. Effects of administration of progenipoietin 1, Flt- 3 ligand, granulocyte colony-stimulating factor, and pegylated granulocyte-macrophage colony-stimulating factor on dendritic cell subsets in mice[J]. Blood, 2002, 99:2122- 2130.
[2] Mark L, Donald S. Novel FLT3 tyrosine kinase inhibitors[J]. Int J Hematol, 2005, 82:100- 107.
[3] Whartenby KA, Calabresi PA, Erin MC,etal. Inhibition of FLT3 signaling targets DCs to ameliorate autoimmune disease[J]. Proc Natl Acad Sci, 2005, 102: 16741- 16746.
[4] Huh JR, Leung MW, Huang P,etal. Digoxin and its derivatives suppress TH17 cell differentiation by antagoniz-ing RORγt activity[J]. Nature, 2011, 472:486- 490.
[5] Xia YP, Li B, Hylton D,etal. Transgenic delivery of VEGF to mouse skin leads to an inflammatory condition resembling human psoriasis[J]. Blood, 2003, 102:161- 168.
[6] Singh TP, Schon MP, Wallbrecht K,etal. 8-methoxypsoralen plus ultraviolet A therapy acts via inhibition of the IL- 23/Th17 axis and induction of Foxp3+ regulatory T cells involving CTLA4 signaling in a psoriasis-like skin disorder[J]. J Immunol, 2010, 184:7257- 7267.
[7] Lee MR, Cooper AJ. Immunopathogenesis of psoriasis[J]. Exp Dermatol, 2007, 16:779- 798.
[8] Consuelo O, Silvia FA, Carrillo JM,etal. IL- 17-producing CD8+T lymphocytes from psoriasis skin plaques are cytotoxic effector cells that secrete Th17-related cytokines[J]. J Leukocyte Biol, 2009, 86:435- 443.
[9] Fitch EL, Rizzo HL, Kurtz SE,etal. Inflammatory skin disease in K5.hTGF-beta1 transgenic mice is not depend-ent on the IL- 23/Th17 inflammatory pathway[J]. J Invest Dermatol, 2009, 129: 2443- 2450.
[10] Park H, Li Z, Yang XO,etal. A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J]. Nat Immunol, 2005, 6:1133- 1141.
[11] Goodman WA, Levine AD, Massari JV. IL- 6 signaling in psoriasis prevents immune suppression by regulatory T cells[J]. J Immunol, 2009, 183:3170- 3176.
[12] Buckner JH. Mechanisms of impaired regulation by CD4+CD25+FOXP3+regulatory T cells in human autoimmune diseases[J]. Nat Rev Immunol. 2010,10: 849- 859.
[13] Hideaki S, Rolland G, Eiko T,etal. Dysfunctional blood and target tissue CD4+CD25 high regulatory T cells in psoriasis: mechanism underlying unrestrained pathogenic effector T cell proliferation[J]. J Immunol, 2005, 174:164- 173.
