中国134例黑色素瘤患者P16INK4a、CDK4和CCND1基因突变及其临床意义
2018-01-29吴晓雯闫君雅
吴晓雯,闫君雅,代 杰,孔 燕,郭 军
(北京大学肿瘤医院 肾癌黑色素瘤内科,北京 100142)
近年来肿瘤发病率与病死率不断增加,已经成为中国人群死亡率最高的疾病[1]。黑色素瘤在我国每年新发病人数超过二万人,属发病率不高但致死率极高的恶性肿瘤[2]。尽管黑色素瘤靶向药物进展迅速,但仍有多数患者不能从中获益。目前临床已有明确疗效的药物靶点主要是BRAF基因和KIT基因[3- 4],但两者的突变率在中国黑色素瘤患者中仅占50%[5- 6]。而P16INK4a-cyclinD1-CDK4信号通路异常在黑色素瘤中可高达22%~78%[7],提示该通路可能成为黑色素瘤靶向治疗新的突破点。由于黑色素瘤基因突变存在人种差异,中国黑色素瘤患者P16INK4a、CDK4、CCND1基因突变情况尚缺乏证据。本研究拟通过检测中国黑色素瘤患者的P16INK4a、CDK4、CCND1基因突变情况,探索其与临床预后的关系,为探寻中国黑色素瘤患者的个体化靶向治疗策略提供线索。
1 材料与方法
1.1 材料
1.1.1 研究对象:收集2010年1月至2014年12月在北京肿瘤医院肾癌黑色素瘤内科接受诊治的134例黑色素瘤患者的肿瘤组织石蜡包埋标本及外周血淋巴细胞。所有石蜡标本均经病理组织学(HE染色,免疫组化)明确诊断。随访收集相关临床资料,包括年龄、性别、初诊时间、亚型、TNM分期、肿瘤厚度、溃疡和生存情况。所有患者均签署了本研究的知情同意书。
1.1.2 主要试剂仪器:DNA提取试剂:QIAamp DNA FFPE Tissue Kit (德国QIAGEN GmbH公司);Universal Genomic DNA Kit和PCR相关试剂:2×GoldStar Best MasterMix(北京康为世纪生物科技有限公司);BSA及引物(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 肿瘤组织石蜡标本全基因组DNA提取:分离石蜡包埋组织中的肿瘤细胞,按照QIAamp DNA FFPE Tissue Kit说明书提取基因组DNA,将DNA置于-20 ℃保存备用。
1.2.2 淋巴细胞DNA提取及基因扩增:分离患者外周血淋巴细胞,使用试剂盒提取淋巴细胞DNA,-20 ℃保存备用。
1.2.3 巢式PCR:应用巢式PCR技术扩增CDK4基因2号外显子,P16INK4a基因 1α、2、3号外显子,CCND1基因4、5号外显子,灭菌超纯水代替模板DNA作为阴性对照。
1.2.4P16INK4a、CDK4、CCND1基因测序:将PCR产物送至北京天一辉远生物科技有限公司进行基因纯化和Sanger测序。使用Chromas和Gene Runner软件对测序结果进行判读。
1.2.5P16INK4a、CDK4、CCND1基因突变风险预测:使用Uniprot 数据库(http://www.uniprot.org)和Polyphen(http://genetics.bwh.harvard.edu/pph2/index.shtml)对突变进行功能预测。
1.3 统计学分析
应用SPSS 20.0软件进行统计学分析,采用双侧概率检验法。连续变量的均值比较采用成组t检验,多样本率的比较采用Pearson卡方、连续校正卡方检验、Kruskal-Wallis秩和检验;生存分析采用Kaplan-Meier法、COX回归分析进行单因素和多因素分析。
2 结果
2.1 患者基本信息
研究共纳入黑色素瘤患者134例,其中男性62例(46.3%),女性72例(53.7%)。年龄分布为(55.1±12.7)岁,肿瘤平均厚度为5.42 mm,总体溃疡发生率63.9%(78/122)。中国黑色素瘤患者各病理亚型比例为:肢端型27.6%(37/134),黏 膜 型 64.2%(86/134)和非肢端皮肤型8.2%(11/134)。
2.2 P16INK4a、CDK4、CCND1基因突变情况
2.2.1P16INK4a基因突变情况:134例黑色素瘤组织标本共检测到P16INK4a基因错义突变11例,突变率为8.2% (11/134),其中肢端型、黏膜型黑色素瘤P16INK4a基因突变率分别为10.8% (4/37 ) , 8.0%(7/87)。经外周血淋巴细胞DNA重复上述测序证实,以上突变均不是遗传性突变。局灶性黑色素瘤(Ⅰ-Ⅱ期)P16INK4a基因突变频率为8.7%(4/46),转移性黑色素瘤(Ⅲ-Ⅳ期)P16INK4a基因突变频率为8.0%(7/88)。
P16INK4a的编码序列覆盖1α、2、3号外显子,1α外显子检测到2个错义突变,突变类型为E33A(g98c) 、G45D(g135a), COSMIC数据库未见报道。2号外显子检测到9例错义突变:其中6例为D74A(a221c),其余点突变分别为:N71K(c213g)1例,G101R(g301a)1例,A109S(g325t)1例。其中G101R(g301a),A109S(g325t)为新发现突变,COSMIC数据库未见报道。3号外显子未检测到错义突变。
肢端型黑色素瘤中发现的P16INK4a基因突变均为2号外显子D74A(a221c)型突变,突变率为10.8%(4/37 )。黏膜型黑色素瘤中发现的P16INK4a基因突变分布在1α和2号外显子。经Polyphen数据库功能预测,81.8%(9/11)的P16INK4a基因突变可能对蛋白质功能造成影响。P16INK4a基因突变类型和分布区域见表1。
2.2.2CDK4基因突变情况:研究仅检测到1例CDK4基因错义突变(0.75%), 突变类型为L60R,既往未见报道。经Polyphen数据库功能预测,此突变为有害突变可能性大(score=1.000, effect: probably damaging)。
2.2.3CCND1基因突变情况:在134例标本未检测到CCND1基因错义突变,但4号外显子发现同义替换SNP位点(rs9344:g723a,P241P)在75.6%(90/119)的样本中重复出现。
2.3 P16INK4a基因突变与临床病理特征之间的关系
携带P16INK4a基因突变的患者年龄为(54.9±14.9)岁。在临床分期上,P16INK4a基因突变组患者包括Ⅰ期0例、Ⅱ期4例、Ⅲ期2例、Ⅳ期5例。在病理亚型上,P16INK4a基因突变组包括肢端型4例(36.4%)、黏膜型7例(63.6%)、非肢端皮肤型0例(0%)。P16INK4a基因突变型组溃疡发生率(45.5%),P16INK4a基因野生型组溃疡发生率(65.8%)(表2)。
2.4 P16INK4a基因突变与OS之间的关系
2.4.1 总体生存情况:134例患者中,共有74.6%(100/134)因肿瘤进展死亡,25.4%(34/134)患者失访。患者总体预后不佳,中位生存时间28个月(范围:3~168个月,95%CI:20.6~35.3个月),1年、3年、5年生存率分别为83.6%、41.6%、24.3%。
2.4.2P16INK4a基因突变与OS:P16INK4a基因突变型患者的中位生存期为14个月(95%CI:9.1~18.9 个月),P16INK4a基因野生型患者的中位生存期为30个月(95%CI:22.3~37.7 个月),远高于突变患者,差异有统计学意义 (P< 0.01)(图1)。处于不同TNM分期的患者的总生存期差异有统计学意义(P<0.001),P16INK4a基因突变(P<0.05)、TNM分期(P<0.001)是黑色素瘤的独立预后因素。P16INK4a基因发生错义突变后不良预后风险提高2.8倍(HR=2.841,95%CI:1.481~5.450),TNM分期越晚,预后越差(HR=1.734,95%CI:1.351~2.225)。根据统计学预后模型h(t)=0.550*stage+1.081*P16INK4a(突变型=1,野生型=0)将患者进行风险分组,低危组h(t)<2、高危组h(t)≥2患者中位生存期分别为43个月(95%CI:27.7~58.3个月), 21个月(95%CI:16.7~25.3个月),差异有统计学意义(P<0.001)(图2)。
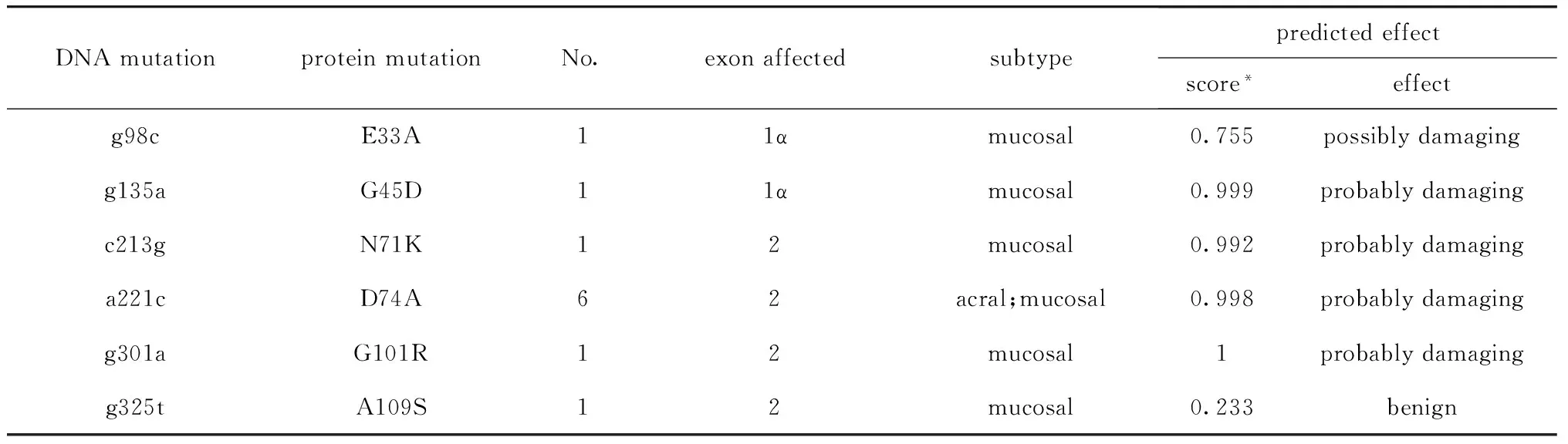
表1 134例黑色素瘤患者P16INK4a基因突变类型分析Table 1 P16INK4a mutations indentified in 134 patients with melanoma
Annotation:*the score was calculated by computer and can measure the predicts possible impact of an amino acid substitution on the structure and function of a human protein.
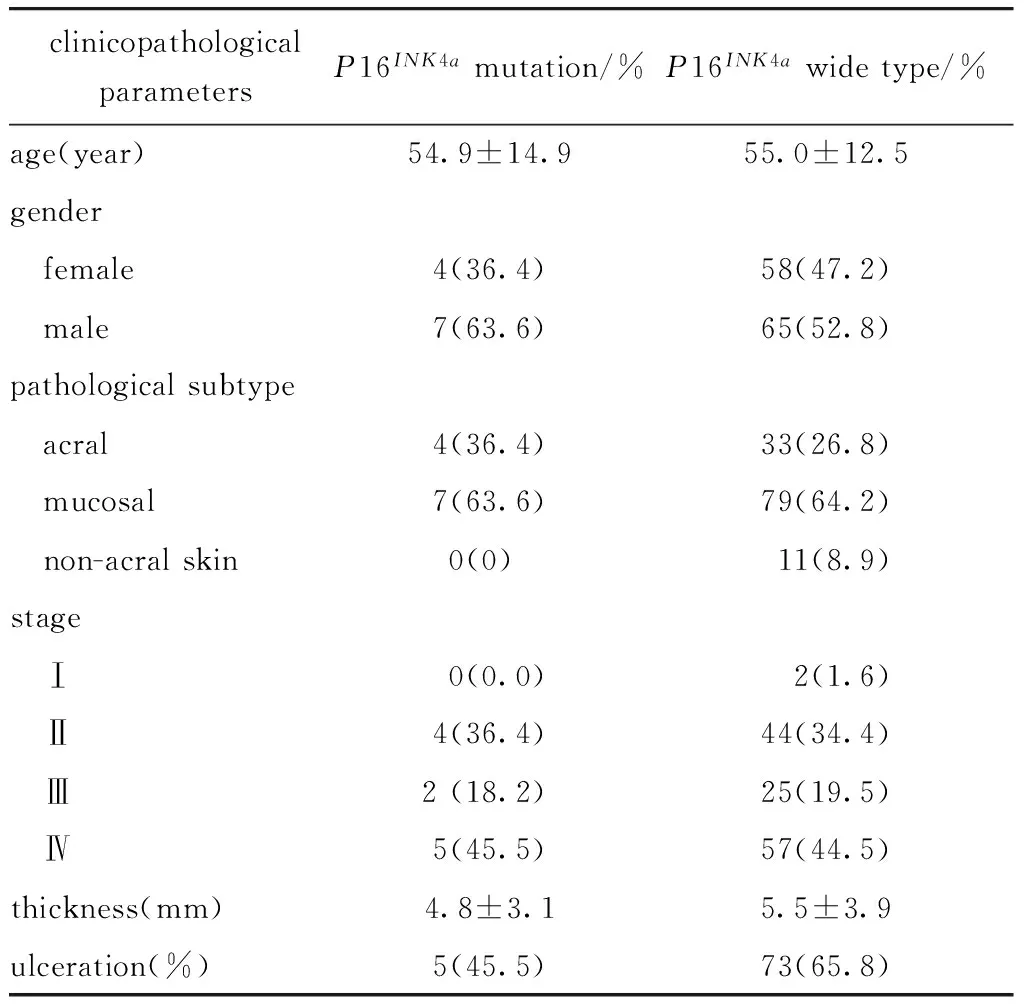
表2 P16INK4a突变与临床病理参数
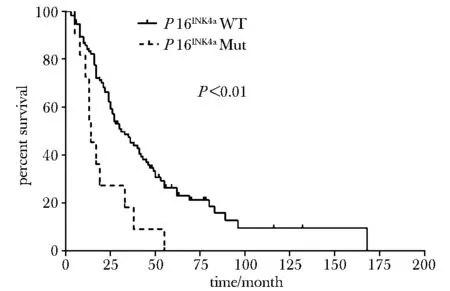
annotation:solid line.wild type (WT); dottedline.mutation(Mut)图1 P16INK4a突变与总生存期分析Fig 1 Overall survival of melanoma patients in relation to P16INK4a mutations
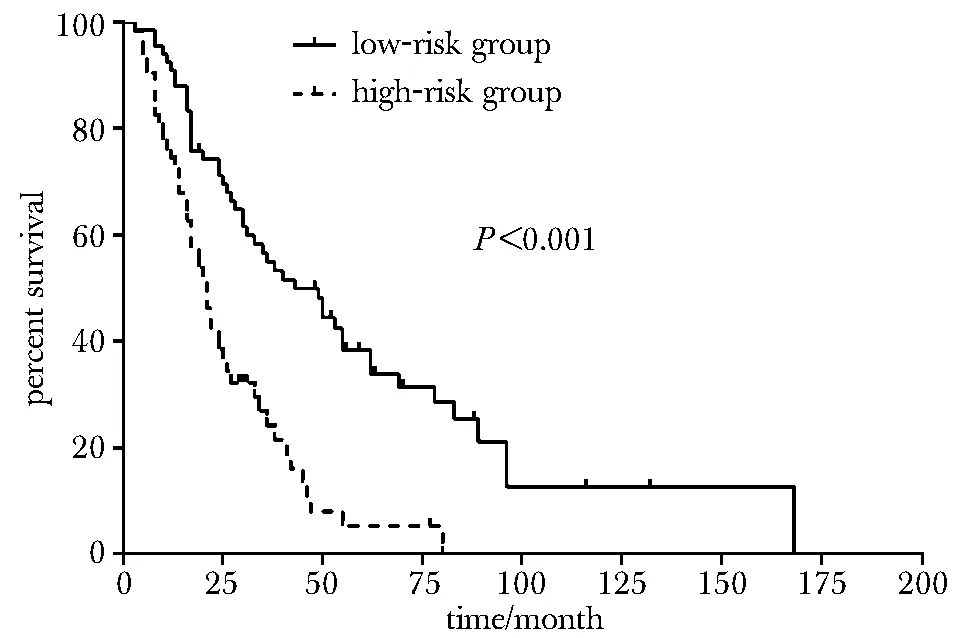
annotation:solid line.low-risk group; dottedline.high-risk group图2 风险分组与总生存期分析Fig 2 Overall survival of melanoma patients in relation to risk
3 讨论
P16INK4a-cyclinD1-CDK4信号通路参与调节细胞周期中G1/S期转换,该通路异常会引起细胞周期调控失控,在黑色素瘤发生和发展中具有重要作用[8]。国外研究表明黑色素瘤基因突变具有人种差异,而P16INK4a、CDK4和CCND1基因在中国黑色素瘤人群中的突变情况尚无报道。本研究结果显示中国黑色素瘤患者CDK4基因突变率为0.75%,与COSMIC数据库报道相近,再次证实该基因在黑色素瘤中较少发生突变,发现的1例CDK4突变类型为L60R(a179c),为有害突变可能性极大,其他研究中尚未见报道,其功能学有待进一步研究探索。中国黑色素瘤患者CCND1基因错义突变率为0%,但4号外显子检测到高频SNP位点,功能学意义值得深入探索。中国黑色素瘤患者P16INK4a基因突变率8.2%(11/134),与白种人黑色素瘤突变率结果相近[9],低于黑色其中高达81.8%的P16INK4a错义突变可能会对P16INK4a蛋白功能造成影响,该比例远高于白种人黑色素瘤人群的相关研究[10],提示中国黑色素瘤患者P16INK4a错义突变可能在P16INK4a-cyclinD1-CDK4信号通路异常起到重要作用。突变引起的肿瘤细胞功能学改变需要进一步研究证实。
肢端型和黏膜型黑色素瘤是中国黑色素瘤患者的主要亚型[5],本研究发现,肢端型和黏膜型黑色素瘤患者P16INK4a基因突变率分别为10.8%,8.0%,尚未见报道。肢端型黑色素瘤P16INK4a基因点突变均为2号外显子D74A(a221c)型突变,突变率高达10.8%,随着细胞周期抑制剂临床试验的开展,P16INK4aD74A 热点突变可能是肢端型黑色素瘤的潜在治疗靶点。
肿瘤分期、厚度和溃疡是目前已知的影响黑色素瘤预后的因素[11]。本研究发现,P16INK4a基因突变与肿瘤分期、厚度和发生溃疡无相关性,但却是影响黑色素瘤患者预后的重要因素。P16INK4a突变型患者的预后较差,对黑色素瘤患者进行P16INK4a基因检测并对患者进行风险评估,有助于制定合理的治疗方案,及时采取干预措施。针对P16INK4a基因突变的功能学研究将有可能为临床以P16INK4a-cyclinD1-CDK4为靶点的干预策略提供线索。
[1] Chen W, Zheng R, Baade PD,etal. Cancer statistics in China, 2015 [J]. CA Cancer J Clin,2016,66: 115- 132.
[2] Lo JA, Fisher DE. The melanoma revolution: from UV carcinogenesis to a new era in therapeutics [J]. Science,2014,346: 945- 949.
[3] Carvajal RD, Antonescu CR, Wolchok JD,etal. KIT as a therapeutic target in metastatic melanoma [J]. JAMA,2011,305: 2327- 2334.
[4] Flaherty KT, Puzanov I, Kim KB,etal. Inhibition of mutated, activated BRAF in metastatic melanoma [J]. N Engl J Med,2010,363: 809- 819.
[5] Kong Y, Si L, Zhu Y,etal. Large-scale analysis of KIT aberrations in Chinese patients with melanoma [J]. Clin Cancer Res,2011,17: 1684- 1691.
[6] Si L, Kong Y, Xu X,etal. Prevalence of BRAF V600E mutation in Chinese melanoma patients: large scale analysis of BRAF and NRAS mutations in a 432-case cohort [J]. Eur J Cancer,2012,48: 94- 100.
[7] O’Leary B, Finn RS, Turner NC,etal. Treating cancer with selective CDK4/6 inhibitors [J]. Nat Rev Clin Oncol,2016,13:417- 430.
[8] Yadav V, Chen SH, Yue YG,etal. Co-targeting BRAF and cyclin dependent kinases 4/6 for BRAF mutant cancers [J]. Pharmacol Ther,2015,149: 139- 149.
[9] Sheppard KE, McArthur GA. The cell-cycle regulator CDK4: an emerging therapeutic target in melanoma [J]. Clin Cancer Res,2013,19: 5320- 5328.
[10] Yang G, Rajadurai A, Tsao H. Recurrent patterns of dual RB and p53 pathway inactivation in melanoma [J]. J Invest Dermatol,2005,125: 1242- 1251.
[11] Jiang X, Zhou J, Yuen NK,etal. Imatinib targeting of KIT-mutant oncoprotein in melanoma [J]. Clin Cancer Res,2008,14: 7726- 7732.
