基于斑马鱼幼鱼模型的甘遂毒性评价*
2018-01-29冯娅茹索亚然李二文王昭懿马志强林瑞超
梅 雪,罗 隽,夏 青,冯娅茹,索亚然,李二文,王昭懿,马志强,林瑞超
甘遂为大戟科植物甘遂(Euphorbia kansui T.N.Liou ex T.RWang)的干燥块根,可泻水逐饮,消肿散结。常用于肝硬化腹水、胸腔积液、水肿等病症[1],现代临床也用于治疗晚期食道癌、乳腺癌等肿瘤及慢性支气管炎等疾病[2]。药理研究表明,甘遂具有抗肿瘤、抗病毒、治疗胰腺炎、免疫抑制等多种药理活性[3-4],但其毒性作用却严重制约着它的临床应用。
斑马鱼具有繁殖速度快、子代数量多、胚胎透明等生物学特性,目前已在药理和毒理研究方面得到了广泛的应用[5]。利用斑马鱼模型可以高效、直观地评价药物的心血管、肝脏、肾脏和神经等靶器官毒性[6],研究数据表明该模型对药物的心血管、肝脏、胃肠道和神经毒性的评价结果与人体试验结果的一致性平均达到了80%以上[7-9]。斑马鱼模型系统既具有细胞等体外实验用药量少、费用低、周期短、高通量等特点,又具备整体动物实验可观察多个器官[10]、涵盖体内代谢与内环境变化对药物的毒性影响等优势。斑马鱼幼鱼模型克服了细胞和化学筛选模型的局限性,从整体水平直观地评估药物的毒性作用,很好填补了细胞模型和啮齿动物模型过渡的空白[11]。
目前关于甘遂的毒性评价比较混乱,有关实验证明其确实存在较强的毒性作用,但均存在对其毒性特征描述不确切,靶器官研究不充分,毒性可逆性研究缺失等问题[12-15]。故本实验拟用斑马鱼幼鱼为模型,评价甘遂不同极性溶剂提取物毒性差异,完善对甘遂的毒性评价,同时为该模型在中药毒性评价中的应用提供参考。
1 实验材料
1.1 药物和试剂 去离子水、石油醚、二氯甲烷、乙酸乙酯、95%乙醇、氯化钠、氯化钾、磷酸二氢钾、磷酸氢二钠、碳酸氢钠等为分析纯,购自北京化工厂。氯化钙、三卡因、甲基纤维素等购自Sigma公司。干酵母片购自北京同仁堂。
1.2 动植物 甘遂购自河北安国药材市场,经北京中医药大学杨瑶珺教授鉴定为大戟科植物甘遂的干燥块茎。
野生型AB系斑马鱼,购自国家斑马鱼资源中心。丰年虾,购于天津丰年水产养殖有限公司。草履虫,实验室养殖。
1.3 仪器 斑马鱼循环水养殖系统(北京爱生科技公司),恒温培养箱LRH-250Z(广州瑞明仪器有限公司),蔡司体式荧光显微镜(Zeiss,Axio Zoom V16),数显恒温水浴锅(天津泰斯特有限公司),ZDHW电热套(北京中兴伟业仪器有限公司),OSB-2100型旋转蒸发仪(上海爱朗仪器有限公司),真空干燥箱(上海一恒科学仪器有限公司)。
2 方法
2.1 甘遂提取物及幼鱼暴露液的制备 称取甘遂生品50 g,粉碎,过40目筛,置于索氏提取器中,依次按顺序以10倍质量的石油醚、二氯甲烷、乙酸乙酯、95%乙醇为溶剂,进行连续提取。每个溶剂提取6 h,更换提取溶剂时,挥干药材粉末中所含上一溶剂。所得提取液经浓缩干燥后,存于干燥器中备用。
以二甲基亚砜(DMSO)为溶剂,制备500 mg/mL的提取物母液。实验时用幼鱼养殖水将母液稀释至所需浓度。
2.2 斑马鱼幼鱼的繁育 斑马鱼成鱼养殖于斑马鱼循环水养殖系统中,控制水温(28.0±0.5)℃,光照周期为明暗14∶10 h交替,系统水pH为6.8~7.2,电导率为400~500μs,每日喂食新孵化的丰年虾3次。产卵前1 d晚上按雌雄1∶2比例配鱼,第2天待产卵完成后,收集受精卵,挑除死卵及杂质,用幼鱼养殖水清洗3次,置于28.5℃光照培养箱中培养,光照周期为明暗 14∶10 h。
2.3 甘遂不同提取物毒性比较 显微镜下挑选发育正常的受精后3 d(dpf)幼鱼,置于12孔板中,每孔20条幼鱼,给予暴露液3 mL,连续给药72 h,每24 h 更换暴露液。预实验以 0.01、0.1、1、10、100、200、500μg/mL提取物为给药浓度,根据实验结果,调整给药浓度,确定甘遂暴露给药72 h(hpe)的最大不致死浓度和最小全致死浓度,并在此区间选择设定成等差数列的6~8个药物浓度建立致死曲线。实验重复3次。实验以给药后72 hpe斑马鱼幼鱼死亡率与实验浓度梯度呈良好线性关系(r2≥85%),且半数致死浓度(LC50)的RSD≤0.1为有效值。
根据致死曲线计算各提取物半数致死浓度,根据LC50及所含原生药量比较不同溶剂连续提取物的毒性差异,并根据致死曲线计算最毒提取物的最小致死浓度(LC1)、和 10%致死浓度(LC10)。
2.4 毒性指标及可逆性观察 以幼鱼养殖水为空白对照组,以含助溶剂0.1%DMSO的幼鱼养殖水为溶剂对照组,选用 1/10 LC1、1/3 LC1、LC1、LC104 个浓度作为毒性指标及可逆性观察的给药浓度。实验设立6个重复组,其中3组给药72 h后,观察暴露液对各个脏器系统毒性指标产生的影响,另外3组给药72 h后,吸除暴露液并用养殖水清洗3次,置于12孔板中以养殖水培养恢复48 h,观察毒性可逆性。各给药组及恢复组于体式显微镜下观察并拍照,记录各毒性观察指标的变化。
2.5 苏木精-伊红(HE)染色观察 给药和恢复结束后,存活幼鱼以磷酸缓冲盐溶液(PBS)清洗3次,置于离心管中,加4%多聚甲醛于4℃固定24 h,常规切4μm切片。染色步骤如下:1)切片用二甲苯脱蜡,经各级乙醇至水洗:二甲苯(I)6 min→二甲苯(Ⅱ)6 min→100%乙醇6 min→95%的乙醇6 min→80%乙醇6 min→75%乙醇6 min→蒸馏水洗6 min。2)苏木素染色5 min,自来水冲洗。3)盐酸乙醇分化10 s。4)自来水浸泡15 min。5)置伊红液2 min。6)常规脱水,透明,封片:95%乙醇(I)1 min→95%乙醇(Ⅱ)1 min→100%乙醇(I)1 min→100%乙醇(Ⅱ)1min→二甲苯石碳酸(3∶1)1 min→二甲苯(I)1 min→二甲苯(Ⅱ)1 min→中性树脂封固。
2.6 统计学方法 采用SPSS20.0统计软件。所有数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
3 结果
3.1 甘遂提取率 按照上述实验方法制备得到甘遂不同溶剂提取物,提取率依次分别为石油醚6.32%、二氯甲烷1.92%、乙酸乙酯1.85%、95%乙醇3.31%。
3.2 甘遂不同提取物毒性差异 按上述2.2及2.3方法,根据预实验结果,确定了甘遂不同提取部位的实验浓度,重复给药3次,统计斑马鱼幼鱼死亡数,根据斑马鱼幼鱼死亡率建立致死曲线,见图1,并计算LC50。实验结果显示甘遂不同提取部位毒性依次为石油醚>二氯甲烷>乙酸乙酯>乙醇提取物;LC50依次为(0.107±0.006)、(0.416±0.005)、(4.516±0.035)、(24.281±1.370)μg/mL。故在后续的实验中,将主要以石油醚提取物为研究对象,评价甘遂毒性。
3.3 甘遂毒性及可逆性观察
3.3.1 心脏毒性 如图2所示,给药组和恢复组斑马鱼幼鱼心脏未出现心包水肿、出血瘀血等异常现象,显微镜下观察心脏形态正常,心区血流正常、无心律不齐。根据统计,给药组和恢复组均与对照组心率差异无统计学意义,说明甘遂无心脏毒性。见表1。
3.3.2 神经毒性 如图2所示,斑马鱼脑部未出现水肿、畸形等异常形态,脑区颜色正常,说明脑部未发生变性,说明甘遂无脑毒性。
3.3.3 胃肠道刺激性 如图2所示,结合镜下观察,斑马鱼胃肠道区域颜色略有变化,变得灰暗,显示可能出现轻微肠变性,镜下肠褶皱无明显变化。0.050 和0.070μg/mL组肠腔略有变小,可能为毒性变化所致。肠道尼罗红排泄实验显示排泄率呈剂量依赖性增高(荧光强度越低说明排泄率越高),说明甘遂具有胃肠道刺激性。见表2。
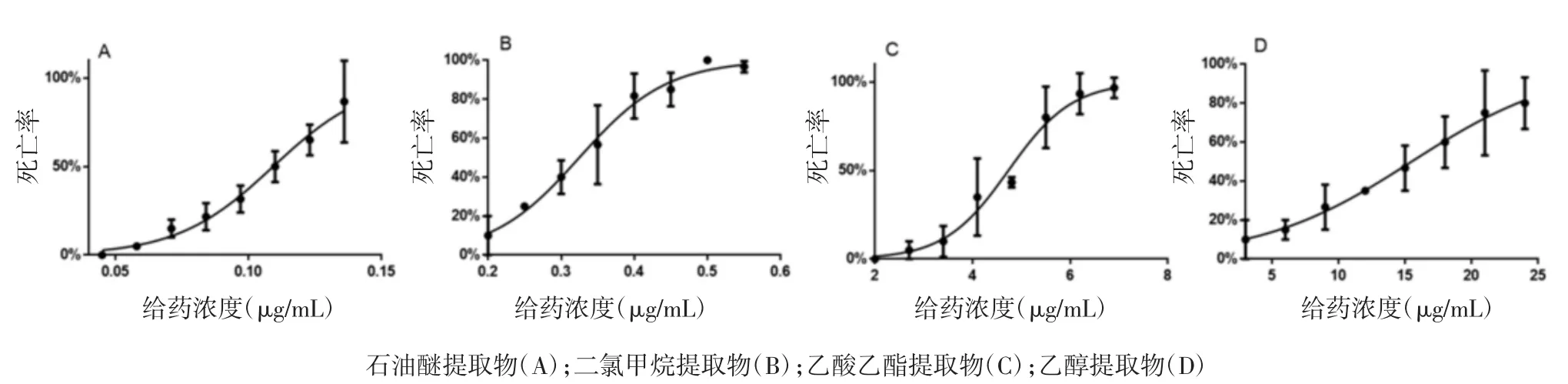
图1 甘遂不同溶剂提取物致死曲线Fig.1 Lethal curve of Radix Kansuiextracted with different solvent
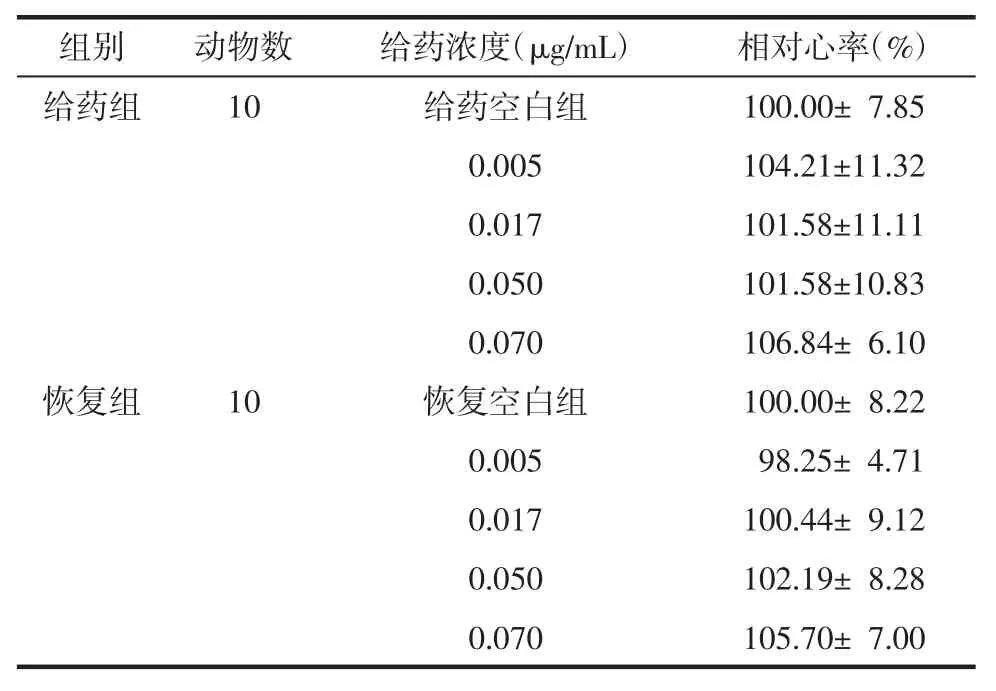
表1 甘遂给药组及恢复组相对心率(x±s)Tab.1 Relative heart rate in Radix Kansuitreatment and recovery group(x±s)
3.3.4 肝脏毒性 如图3所示,正常的斑马鱼肝脏界限清晰,纹理清晰均匀,给药后肝脏界限变模糊且肝区颜色变为灰暗色,纹理混乱。统计数据见表3和表4,给药组肝脏面积在0.070μg/mL给药组中显著增大,停药后恢复48 h,相对肝面积进一步增大,说明甘遂高浓度使幼鱼肝脏肿大,且停药后肝肿大未出现可逆性;给药组肝脏面积在0.050μg/mL给药组中未显著增大,但停药后恢复48 h,相对肝面积进一步增大,说明此浓度会造成持续性肝损伤;给药后肝区光强度在 0.005、0.050、0.070 μg/mL 给药组中显著降低,停药后恢复48 h光强度出现可逆性。综上所述,说明甘遂具有肝毒性,可使肝肿大和肝变性,肝肿大不可逆,而肝变性具有可逆性。
3.3.5 肾毒性 如图4所示,斑马鱼躯体形态正常,未出现肾性水肿等异常现象,说明甘遂无肾脏毒性。3.3.6 其他毒性特征观察结果 如图4所示,与对照组相比,给药后斑马鱼眼、下颌、身体着色、鱼鳔、肌肉和鱼鳍等均无异常,全身无出血、淤血等现象。

图2 甘遂心脏区域、脑区和肠区形态变化(×80)Fig.2 Morphological changesof heart,nervoussystem and gastrointestinal tract in Radix Kansui(×80)

表2 甘遂给药组肠染色相对荧光强度(x±s)Tab.2 Relative fluorescenceintensity of intestinal staining in Radix Kansuitreatment group(x±s)

图3 甘遂肝脏形态变化(×80)Fig.3 Morphological changes of liver in Radix Kansui(×80)
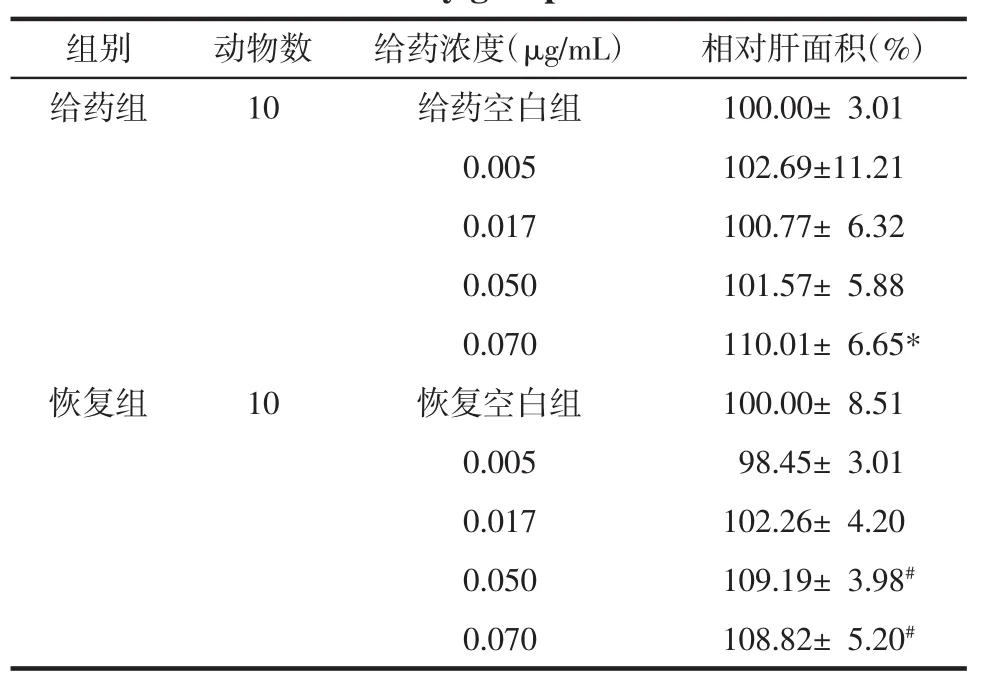
表3 甘遂给药组及恢复组肝区相对肝面积(x±s)Tab.3 Relative liver area of Radix Kansuitreatment and recovery group(x±s)
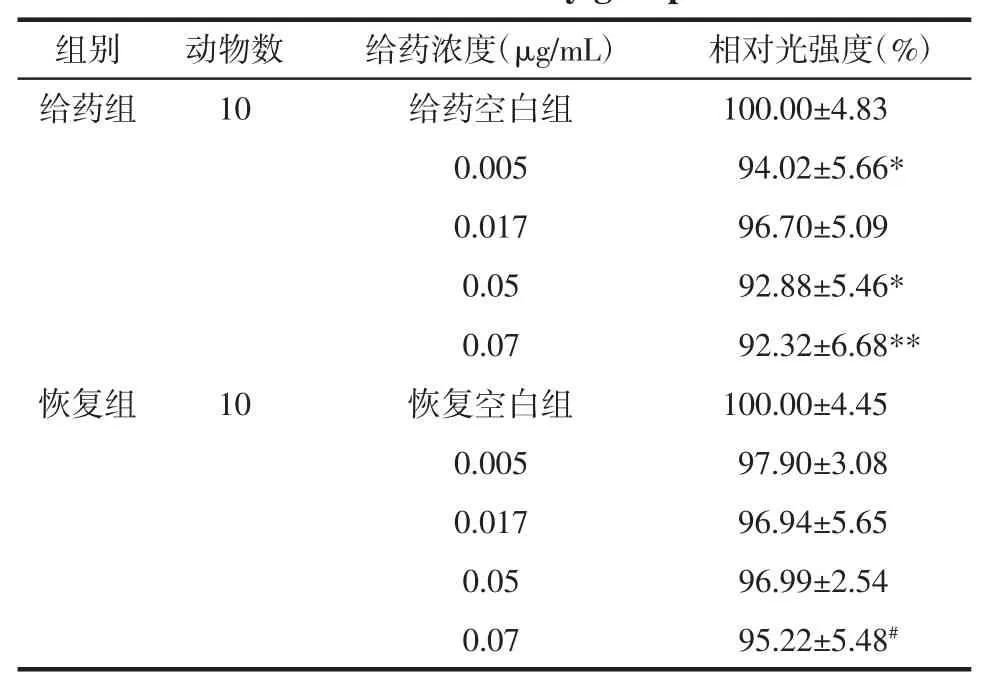
表4 甘遂给药组及恢复组肝区相对光强度(x±s)Tab.4 Relative liver light intensity of Radix Kansui treatment and recovery group(x±s)
3.3.7 HE染色结果 如图5所示,甘遂给药后对肝脏组织损害较大。空白组和溶剂对照组中,肝脏、肠道等区域细胞完整,细胞核明显,细胞质均匀。在甘遂LC10浓度给药组中,肝脏细胞排列松散,肝实质细胞减少,空泡现象增多,细胞界限不明晰。在恢复组中,虽略有所好转,但肝细胞毒性损害仍比较明显。
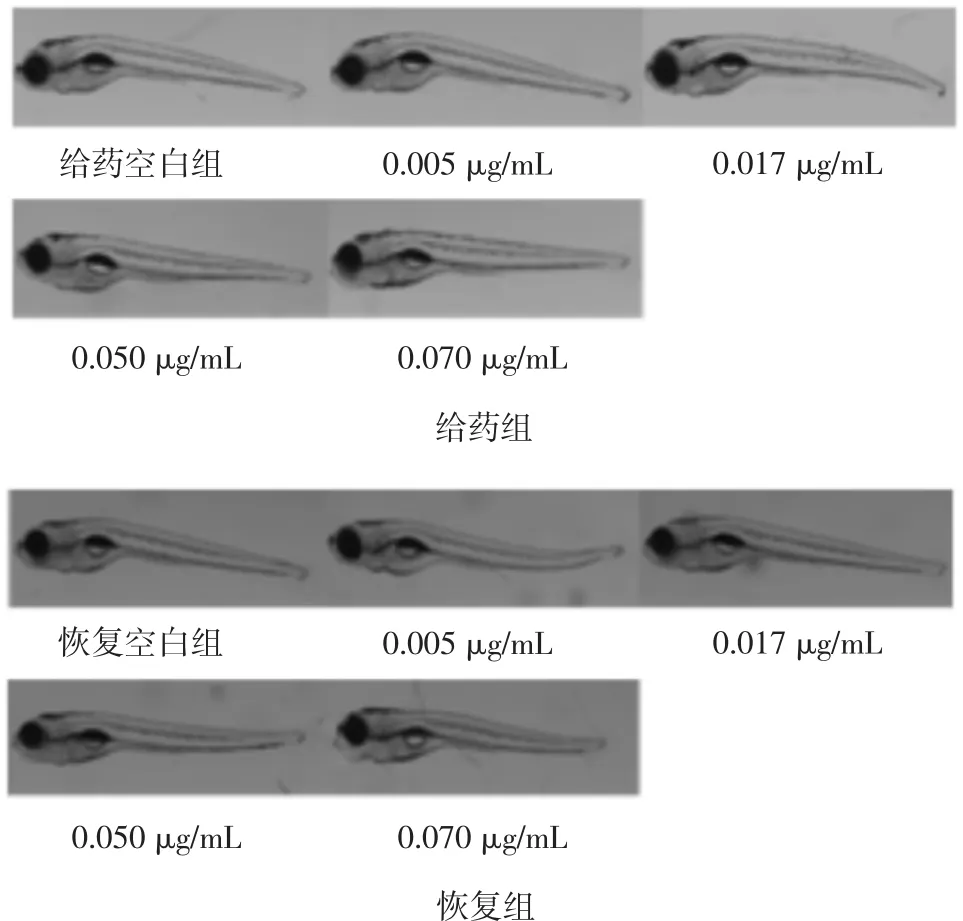
图4 甘遂肾性水肿观察结果及其他毒性指标形态变化(×30)Fig.4 Nephrogenic edema and morphological changesof other toxic index in Radix Kansui(×30)
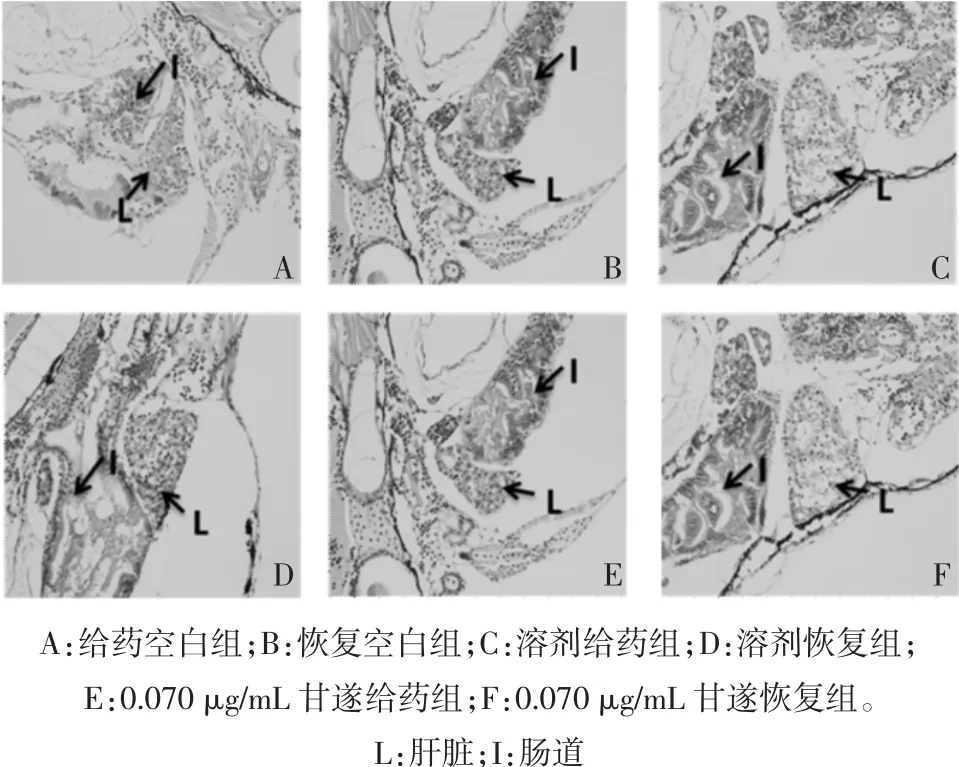
图5 甘遂对斑马鱼幼鱼的毒性影响(HE染色,×400)Fig.5 Toxic effectsof Radix Kansuion zebrafish larvae(HE stain,×400)
4 小结
本实验首次以斑马鱼幼鱼为模型,单次给药,同时评价了甘遂毒性对机体心脏、肝脏、肾脏、神经系统、胃肠道等脏器系统的毒性作用及可逆性,并证实了甘遂可对肝脏和胃肠道造成实质性损伤,为斑马鱼模型在中药毒性评价中的应用提供了参考。
[1]李 燕.有毒中药甘遂炮制前后化学成分及减毒作用的研究[D].济南:济南大学,2011.
[2] 王立岩.甘遂的化学成分及其生物活性的研究[D].本溪:沈阳药科大学,2003.
[3] 修彦凤,曹艳花,张永太.甘遂的药理作用研究进展[J].上海中医药杂志,2008,42(4):79-81.
[4]束晓云,丁安伟.甘遂的炮制及其化学成分,药理作用研究进展[J].中国药房,2007,18(24):1904-1906.
[5] Delvecchio C,Tiefenbach J,Krause HM.The zebrafish:a powerful platformfor in vivo,HTSdrug discovery[J].Assay Drug Dev Technol,2011,9(4):54.
[6] Jyotshna K,Elvic C,Ali SF,et al.Zebrafish model in drug safety assessment[J].Curr Pharm Design,2014,20(34):5416-5429.
[7]He JH,Guo SY,Zhu F,et al.A zebrafish phenotypic assay for assessingdrug-induced hepatotoxicity[J].JPharmacological Toxicol,2013,67(1):25-32.
[8]Zhu JJ,Xu YQ,He JH,et al.Human cardiotoxic drugs delivered by soaking and microinjection induce cardiovascular toxicity in zebrafish[J].JAppl Toxicol,2014,34(2):139-148.
[9]Ou H,Simon JA,Rubel EW,et al.Screening for chemicals that affect hair cell death and survival in the zebrafish lateral line[J].Hearing Res,2012,288(1-2):58-66.
[10]陈汝家,朱俊靖,周盛梅.斑马鱼模型在药物毒性与安全性评价中的应用[J].毒理学杂志,2012,26(3):224.
[11]田丽莉,朱国福.斑马鱼在中药研究中的应用[J].中国中药杂志,2015,40(5):822-827.
[12]Zhang L,Gao L,Li Z,et al.Bio-guided isolation of the cytotoxic terpenoidsfromtheroots of Euphorbia kansuiagainst human normal cell lines L-O2 and GES-1[J].Int JMol Sci,2012,13(9):11247.
[13]曹雨诞,李征军,陈海鹰,等.甘遂不同炮制品及提取物对斑马鱼的急性毒性研究[J].中国现代应用药学,2013,30(2):140-143.
[14]姜 玮,王新敏,唐于平,等.甘遂不同提取物对斑马鱼急性毒性的初步观察[J].南京中医药大学学报,2012,28(1):53-56.
[15]曹亮亮,王文晓,张 丽,等.基于"有故无殒"思想的醋甘遂毒性研究[J].中国中药杂志,2015,40(16):3249-3255.
