临床分离万古霉素耐药肠球菌van基因型及分子分型
2018-01-27郑永贵徐晓刚
周 迎, 杨 洋, 郭 燕, 郑永贵, 吴 湜, 徐晓刚
万古霉素耐药肠球菌(vancomycin-resistant Enterococcus,VRE)已经逐渐成为医院感染的重要病原菌,可引起尿路、腹腔、伤口感染,以及血流感染、心内膜炎等严重感染性疾病。中国大陆地区VRE主要携带vanA和vanM 两型耐药基因簇[1-2],vanA与vanM耐药基因簇均属于D-丙氨酸:D-乳酸连接酶(D-Ala:D-Lac ligase)基因簇,常介导宿主菌对万古霉素等糖肽类抗菌药物耐药。本研究对2016年分离自上海地区6所医院的17株VRE进行耐药基因及多位点序列分型(MLST)分析,为此类耐药菌感染防治提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株来源 17株VRE均于2016年分离自上海地区。vanM基因型VRE阳性对照株Efm-HS0661以及质控菌株粪肠球菌ATCC29212均为本研究所保存菌种。vanA基因型VRE参考菌株由香港中文大学凌建华博士惠赠。
1.1.2 主要试剂及仪器 Mueller-Hinton 琼脂、Columbia 琼脂、BHI琼脂及肉汤(OXOID,英国);阳离子调节MH肉汤(Cation-Adjusted Mueller Hinton II Broth, CAMHB)(BD,美国)。氨苄西林、左氧氟沙星、万古霉素、红霉素、克林霉素、利奈唑胺、甲氧苄啶-磺胺甲唑、替考拉宁、呋喃妥因和利福平等药敏卡购自温州康泰公司。引物由上海生工生物工程技术服务有限公司合成;限制性内切酶TaKaRa Ex Taq、TaKaRa Taq™ HS PCR Kit(UNG plus)及PCR仪购自大连宝生物公司;质粒提取试剂盒购自天根生化科技(北京)有限公司;琼脂糖、电泳系统及凝胶成像系统为美国Bio-Rad公司产品。
1.2 方法
1.2.1 菌种确认 根据参考文献合成通用引物8F、1492R[3],扩增17株临床分离VRE的16S rRNA基因,测序后与GenBank序列进行比对,以进一步确认菌种。
1.2.2 药敏试验 采用微量肉汤稀释法测定VRE对氨苄西林、左氧氟沙星、万古霉素、红霉素、克林霉素、利奈唑胺、甲氧苄啶-磺胺甲唑、替考拉宁、呋喃妥因和利福平的MIC值。采用琼脂稀释法测定磷霉素对VRE的MIC值。根据CLSI 2017版标准[4]对结果进行判读。
1.2.3 DNA模板制备和MLST分型 将冻存菌株转种哥伦比亚血平皿,37 ℃过夜培养后挑取菌落至已注入500 μL TE(pH8.0)的1.5 mL Eppendorf离心管,调节菌液浊度至2麦氏单位,100 ℃ 加热10 min后5 000 g离心5 min取上清液备用。
扩增屎肠球菌基因组上的7个管家基因:AtpA、Ddl、Gdh、Purk、Gyd、PstS和Adk,将PCR产物纯化后测序。参照屎肠球菌MLST分型数据库(http://efaecium.mlst.net/)提供的步骤进行MLST分型。
1.2.4 van基因分型 参照参考文献进行多重PCR扩增[5],扩增所需引物见表1。PCR产物采用2%琼脂糖凝胶,电压6 V/cm电泳30 min后染色读取结果。
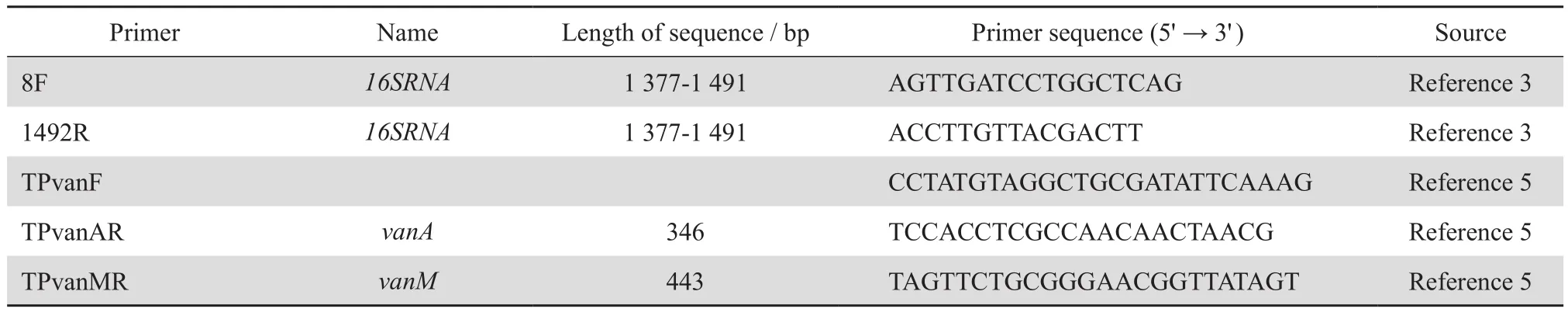
表1 本研究所采用的PCR引物Table 1 Primers used in this study
2 结果
2.1VRE临床株菌种鉴定及药敏测定
17株VRE临床株经16S rRNA基因测序确认均为屎肠球菌。常用抗菌药物对17株临床分离VRE的MIC结果见表2。本研究所测VRE对万古霉素及替考拉宁耐药率高,分别为100%(17/17)和70.6%(12/17);但对于磷霉素和甲氧苄啶-磺胺甲唑耐药率低,分别为29.4%和5.8%;所有分离株对利奈唑胺均敏感。
2.2 VRE临床分离株van基因分型
17株VRE中,13株检出vanA基因,9株检出vanM基因,其中5株同时检出vanA和vanM基因,见图1。
2.3VRE临床分离株MLST分型
通过MLST分型,17株VRE中ST78型8株(47.1%)、ST80型4株(23.5%)、ST555型2株(11.8%),其余3株分别为ST117型、ST262型和ST341型。分型结果显示,2016年上海地区分离VRE以ST78型为主。
3 讨论
VRE自1988年首次报道以来[6],已在全球播散,成为最重要的医院感染病原菌之一。VRE对医院内环境适应性强[7],且治疗药物有限。VRE的耐药性可通过携带耐药基因的移动元件在肠球菌属细菌中传播,甚至跨种属传播,例如传递至致病性更强的金黄色葡萄球菌,产生万古霉素耐药金黄色葡萄球菌。根据2009年至2012年美国国家医疗安全监测网络(NHSN)数据显示[8],肿瘤患者血流感染的主要病原菌中,肠球菌(11.4%)仅次于凝固酶阴性葡萄球菌和大肠埃希菌位列第3,其中耐万古霉素屎肠球菌占82.5%。VRE在中国地区耐药率一直较低,但是近年来有逐年增多的趋势。根据2005-2014年CHINET耐药性监测数据显示,屎肠球菌对万古霉素的耐药率由0.6%上升至4.2%[9]。
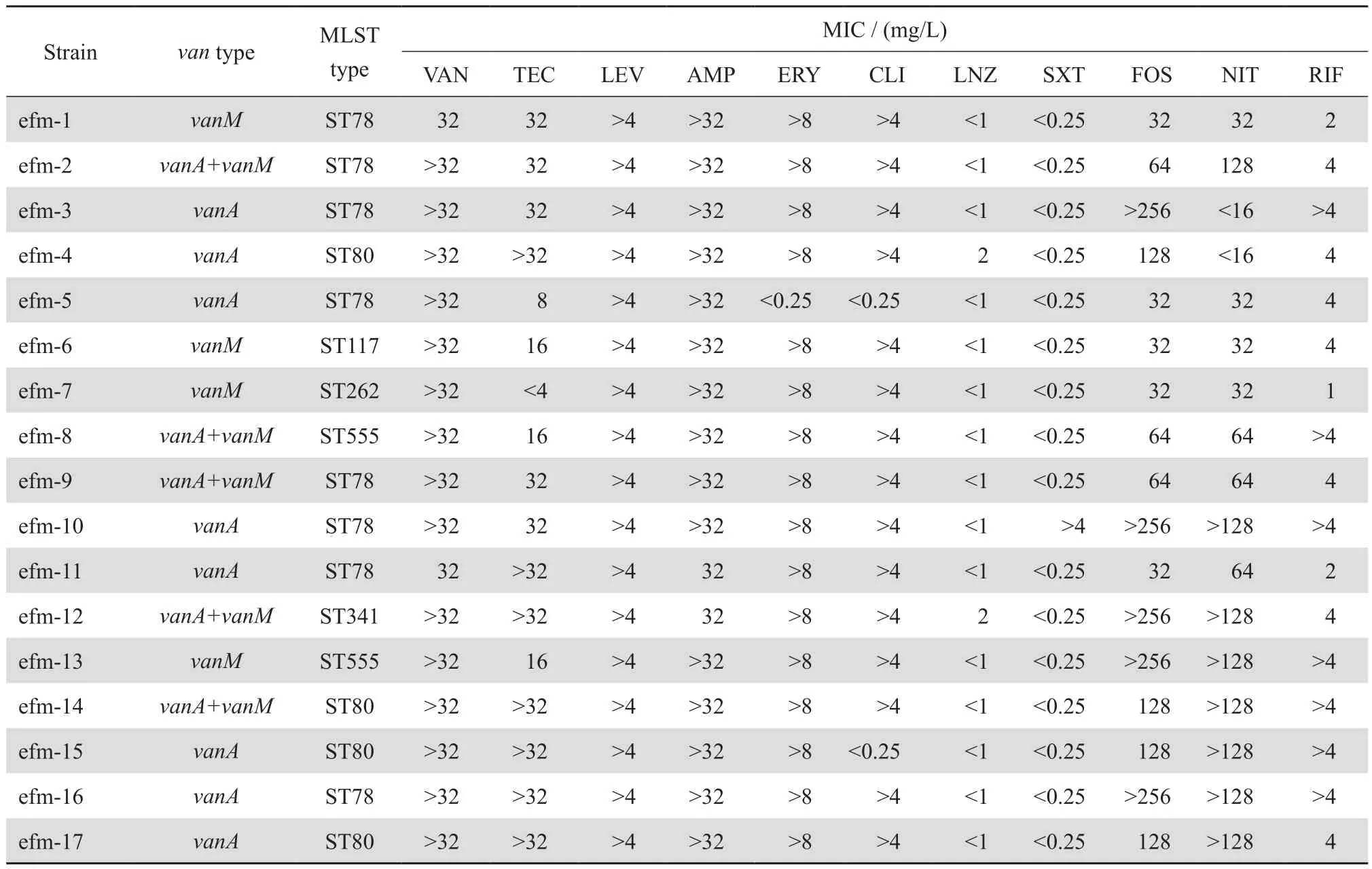
表2 17株万古霉素耐药肠球菌基因型及其对抗菌药物的敏感性Table 2 Genotypes and antimicrobial susceptibility of 17 vancomycin-resistant Enterococcus strains
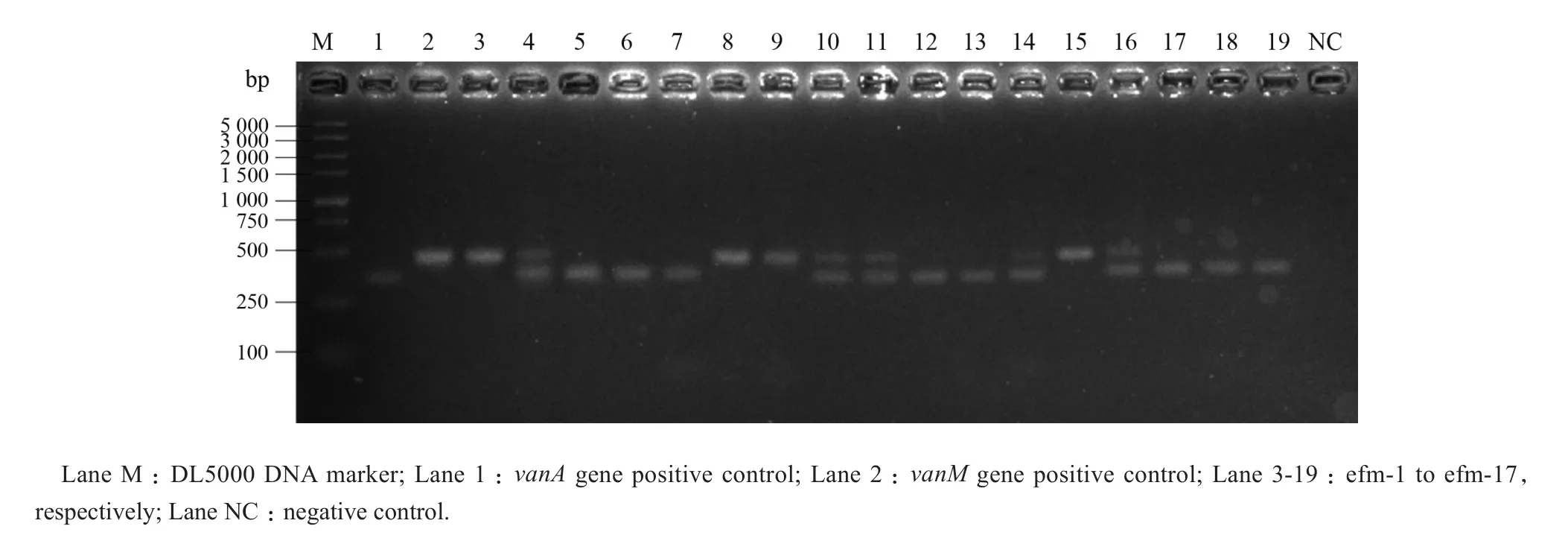
图1 van基因PCR产物琼脂糖凝胶电泳Figure 1 Agarose gel electrophoresis of van gene PCR products
根据VRE耐药表型和van基因簇结构的特点,已有9型肠球菌van基因型被命名,分别是vanA、vanB、vanC、vanD、vanE、vanG、vanL、vanM和vanN[10-11]。它们对万古霉素和替考拉宁的耐药水平各不相同,但是耐药机制相似:通过合成与万古霉素亲和力下降的新细胞壁前体而形成耐药。vanA、vanB、vanD和vanM型介导VRE菌株产生含D-丙氨酸-D-乳酸(D-Ala-D-Lac)末端的细胞壁前体,导致细菌对万古霉素高度耐药(MIC≥64 mg/ L)。国外流行病学数据显示,vanA及vanB型最为常见[12],但我国分离VRE的基因型有所不同,主要为vanA型,vanB型少见。上海地区vanM较为常见[1-2]。
我们前期已建立一种基于多重PCR技术的VRE万古霉素高水平耐药基因快速分型方法[5],对2016年上海地区临床分离的17株VRE进行van基因及分子分型。分型结果显示临床分离株中van基因型仅有vanA和vanM型两型,首次发现同时携带vanA及vanM 的VRE菌株。对VRE菌株进行进一步药敏分析,结果显示,17株VRE菌株均对万古霉素耐药,但对替考拉宁耐药率仅为70.6%(12/17)。本研究已对这些VRE菌株的van基因簇进行了初步分析,在van基因簇中发现了一些插入及缺失变异(待发表结果),但这些变异是否会导致细菌对替考拉宁敏感性变化还有待证实。由于携带单一van基因VRE与携带vanA及vanM两型van基因的VRE菌株相比,其耐药表型无明显差异,目前van基因检测方法常不包括vanM基因,故当前国内外van基因分子流行病学研究可能漏检vanM基因,低估vanM型VRE的危害。
总之,2016年上海地区临床分离的VRE基因型仍仅有vanA和vanM 两型,MLST分型显示17株VRE分属6种ST型,提示vanA和vanM 两种耐药基因可在不同属肠球菌株之间进行水平传播。首次发现了同时携带vanA和vanM 2种高水平耐药基因的VRE,携带2种耐药基因的VRE检出率高达29.4%(5/17),值得关注。
[1]胡付品, 朱德妹, 汪复, 等. 2015年 CHINET 细菌耐药性监测[J]. 中国感染与化疗杂志, 2016,16(6):685-694.
[2]胡付品, 朱德妹, 汪复, 等. 2014年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2015,15(5):401-410.
[3]GEE JE, DE BK, LEVETT PN, et al. Use of 16S rRNA gene sequencing for rapid confirmatory identification of Brucella isolates[J]. J Clin Microbiol, 2004,42(8):3649-3654.
[4]Institute Clinical And Laboratory Standards. Performance standards for antimicrobial susceptibility testing:27th informational supplement. CLSI document M100-S27[S].Clinical and Laboratory Standards Institute, Wayne, PA, 2017.
[5]林东昉, 陈春辉, 周迎, 等. 肠球菌万古霉素高水平耐药基因vanA、vanB、vanD和vanM快速分型检测[J]. 中华传染病杂志, 2017,35(2):99-104.
[6]LECLERCQ R, DERLOT E, DUVAL J, et al. Plasmidmediated resistance to vancomycin and teicoplanin in Enterococcus faecium[J]. N Engl J Med, 1988,319(3):157-161.
[7]KRAMER A, SCHWEBKE I, KAMPF G. How long do nosocomial pathogens persist on inanimate surfaces? A systematic review[J]. BMC Infect Dis, 2006,6 :130.
[8]SEE I, FREIFELD AG, MAGILL SS. Causative organisms and associated antimicrobial resistance in healthcare-associated,central line-associated bloodstream infections from oncology settings, 2009-2012[J]. Clin Infect Dis, 2016,62(10):1203-1209.
[9]杨青, 俞云松, 林洁, 等. 2005-2014年CHINET肠球菌属细菌耐药性监测[J]. 中国感染与化疗杂志, 2016,16(2):146-152.
[10]徐晓刚, 吴湜, 叶信予, 等. 新型肠球菌万古霉素耐药基因簇——vanM基因簇[J]. 中国感染与化疗杂志, 2009,9(6):436-439.
[11]XU X, LIN D, YAN G, et al. vanM, a new glycopeptide resistance gene cluster found in Enterococcus faecium[J].Antimicrob Agents Chemother, 2010,54(11):4643-4647.
[12]MARCADE G, MICOL JB, JACQUIER H, et al. Outbreak in a haematology unit involving an unusual strain of glycopeptideresistant Enterococcus faecium carrying both vanA and vanB genes[J]. J Antimicrob Chemother, 2014,69(2):500-505.
