2016年东莞东华医院细菌耐药性监测
2018-01-27谢树金郭主声陈桂铃
谢树金, 郭主声, 周 静, 陈桂铃, 冯 森, 张 莉
抗菌药物的不规范使用,甚至滥用,导致了耐药菌株的日益增多,给临床抗感染治疗带来极大的挑战[1],目前已成为感染领域中的严重问题。为了更好地开展细菌学监测工作,为临床合理用药提供细菌学依据。现将2016年全年东莞东华医院细菌耐药监测的资料总结如下。
1 材料与方法
1.1 材料
1.1.1 菌株来源 收集2016年1月1日-12月31日本院从住院和门诊患者标本分离的细菌。去除同一患者同一部位分离的重复菌株。
1.1.2 抗菌药物和培养基 抗菌药物纸片均为英国OXOID公司商品。VITEK 2-Compact配套药敏卡为法国生物梅里埃公司产品;头孢他啶-克拉维酸、头孢噻肟-克拉维酸和头孢硝噻吩纸片为OXOID公司商品。青霉素E试验条为法国生物梅里埃公司产品。万古霉素E试验条为温州市康泰生物科技有限公司产品。药敏试验用MH平皿、血MH平皿及HTM平皿均购自广州市迪景生物公司。
1.2 方法
1.2.1 菌种鉴定与药敏试验 菌种鉴定均采用全自动细菌鉴定分析系统VITEK 2-Compact,细菌鉴定到种。药敏试验采用纸片扩散法和自动仪器法,相关操作均按全国临床检验操作规程第3版规定[2]和仪器相关操作说明书进行。质控菌株为大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853、金黄色葡萄球菌(金葡菌)ATCC 25923、肺炎链球菌ATCC 49619、粪肠球菌ATCC 29212和流感嗜血杆菌ATCC 49247。按CLSI 2016年版标准判断结果[3]。
1.2.2 β内酰胺酶测定 采用头孢硝噻吩纸片检测流感嗜血杆菌和卡他莫拉菌中的β内酰胺酶。用CLSI 2016年版推荐的纸片筛选法和酶抑制剂增强纸片确证法(头孢他啶和头孢他啶-克拉维酸,头孢噻肟和头孢噻肟-克拉维酸)测定产ESBL株。
1.2.3 青霉素不敏感肺炎链球菌的检测 经苯唑西林纸片法测定抑菌圈直径≤19 mm的肺炎链球菌菌株,采用青霉素E试验条测定其肺炎链球菌的MIC。脑膜炎分离株和非脑膜炎株分别按CLSI 2016年标准判定为青霉素敏感(PSSP)、中介(PISP)和耐药(PRSP)。
1.2.4 耐甲氧西林葡萄球菌检测 采用自动化仪器法结合头孢西丁纸片法检测甲氧西林耐药金葡菌(MRSA)和凝固酶阴性葡萄球菌(MRCNS)。
1.2.5 碳青霉烯类耐药肠杆菌科细菌(CRE)的定义 对亚胺培南、美罗培南等碳青霉烯类抗生素任何一种耐药的肠杆菌科细菌。
1.2.6 不敏感革兰阳性菌的检测 仪器法检测到对万古霉素、替考拉宁或利奈唑胺不敏感的革兰阳性菌经菌种复核无误后,采用相应E试验条测定其MIC值。
1.2.7 统计分析 采用WHONET 5.6软件进行数据处理和统计分析。
2 结果
2.1 细菌及其分布
3 482株临床分离菌,革兰阳性菌1 199株,占34.4%;革兰阴性菌2 283株,占65.6%。具体临床分离株见表1。92.1%(3 207/3 482)的菌株分离自住院患者,7.9%(275/3 482)分离自门诊患者。
3 482株细菌在各类标本中的分布为呼吸道分泌物45.2%(1 575株)、尿液16.2%(564株)、血液13.8%(480株)、伤口脓液8.8%(307株)、各种无菌体液(胆汁、胸水、腹水、脑脊液等)8.5%(297株)、生殖道分泌物和粪便等6.4%(224株)、其他标本1.0%(35株)。呼吸道标本中最常见的分离菌为克雷伯菌属、铜绿假单胞菌、不动杆菌属、流感嗜血杆菌、大肠埃希菌、金葡菌、肺炎链球菌等;大肠埃希菌和肠球菌属是尿液和脑脊液等无菌体液标本中的主要分离菌;凝固酶阴性葡萄球菌是血培养中的主要分离菌;粪便中沙门菌属占98.1%。
门诊患者分离275株细菌中主要为无乳链球菌31.3%、大肠埃希菌13.8%、金葡菌8.0%和沙门菌属7.6%。住院患者3 207株中大肠埃希菌16.4%、克雷伯菌属11.6%、铜绿假单胞菌9.1%、金葡菌8.7%和不动杆菌属6.4%。
2.2 革兰阳性菌对抗菌药物的敏感率和耐药率
2.2.1 葡萄球菌属 金葡菌中MRSA的检出率为28.7%(86/300)。凝固酶阴性葡萄球菌中,MRCNS的检出率为77.7%(300/386)。金葡菌中MRSA对各类受试抗菌药物的耐药率均明显高于MSSA,但其对甲氧苄啶-磺胺甲唑的耐药率较低;MRSA对红霉素、克林霉素和四环素耐药率高;MSSA除对青霉素和红霉素的耐药率较高外,对β内酰胺类、庆大霉素、利福平以及左氧氟沙星、克林霉素的耐药率均<16.9%。MRCNS对受试的抗菌药物的耐药率亦高于MSCNS,对甲氧苄啶-磺胺甲唑的耐药率较MRSA高。葡萄球菌属中未发现对万古霉素、替考拉宁和利奈唑胺耐药的菌株,见表2。

表2 葡萄球菌对抗菌药物的耐药率和敏感率Table 2 Susceptibility of Staphylococcus strains to antimicrobial agents(%)
2.2.2 肠球菌属 152株肠球菌属细菌中粪肠球菌92株(60.5%)、屎肠球菌50株(32.9%),其他肠球菌10株(6.6%)。粪肠球菌未出现耐替考拉宁和万古霉素的菌株,发现1株耐万古霉素屎肠球菌,并经万古霉素E试验重新复核确认。见表3。
2.2.3 链球菌属 353株链球菌属中α溶血链球菌96株,占27.2%;β溶血链球菌124株,占35.1%,肺炎链球菌133株,占37.7%,其中儿童株86株,成人株47株。儿童株中PSSP、PISP和PRSP分别为98.8%、1.2%和0;成人分离株PSSP、PISP和PRSP分别为100%、0和0。β溶血链球菌对青霉素、利奈唑胺和万古霉素的耐药率均为0,对红霉素的耐药率为76.4%。肺炎链球菌对红霉素和克林霉素的耐药率分别为94.2%和80.0%。未发现对万古霉素和利奈唑胺耐药的菌株。见表4。
2.3 革兰阴性杆菌对抗菌药物的敏感率和耐药率
2.3.1 肠杆菌科 大场埃希菌和克雷伯菌属中产ESBL菌株的检出率分别是59.6%(337/565)和29.8%(115/386),产ESBL菌株对青霉素类、头孢菌素类、氨基糖苷类、喹诺酮类、甲氧苄啶-磺胺甲唑的耐药率均明显高于非产ESBL株,见表5。大肠埃希菌对左氧氟沙星、庆大霉素和甲氧苄啶-磺胺甲唑的耐药率均≥39.3%。肠杆菌科细菌对亚胺培南和阿米卡星的耐药率大多在3%以下,对β内酰胺酶抑制剂复方制剂(头孢哌酮-舒巴坦和哌拉西林-他唑巴坦)的耐药率大多在5%以下,除外沙雷菌属对头孢哌酮-舒巴坦的耐药率为14.8%。见表6。

表3 粪肠球菌和屎肠球菌对抗菌药物的耐药率和敏感率Table 3 Susceptibility of E. faecalis and E. faecium to antimicrobial agents(%)

表4 链球菌属对抗菌药物的耐药率和敏感率Table 4 Susceptibility of Streptococcus strains to antimicrobial agents(%)

表5 产与非产ESBL大肠埃希菌和克雷伯菌属对抗菌药物的耐药率和敏感率Table 5 Susceptibility of ESBLs-producers and non-ESBLs-producers to antimicrobial agents(%)
2.3.2 不发酵糖革兰阴性杆菌 铜绿假单胞菌对亚胺培南和美罗培南的耐药率分别22.2%和23.2%,对多黏菌素B的敏感率高达99.7%,对β内酰胺酶抑制剂复方制剂、喹诺酮类和氨基糖苷类的耐药率均<25%。鲍曼不动杆菌对亚胺培南和美罗培南的耐药率分别是42.2%和40.0%,对米诺环素的耐药率最低(6.5%)。嗜麦芽窄食单胞菌对甲氧苄啶-磺胺甲唑、米诺环素和左氧氟沙星的敏感率均在90%以上。见表7。

表5 (续)Table 5(continued)(%)

表6 肠杆菌科细菌对抗菌药物的耐药率和敏感率Table 6 Susceptibility of Enterobacteriaceae species to antimicrobial agents(%)

表6 (续)Table 6(continued)(%)
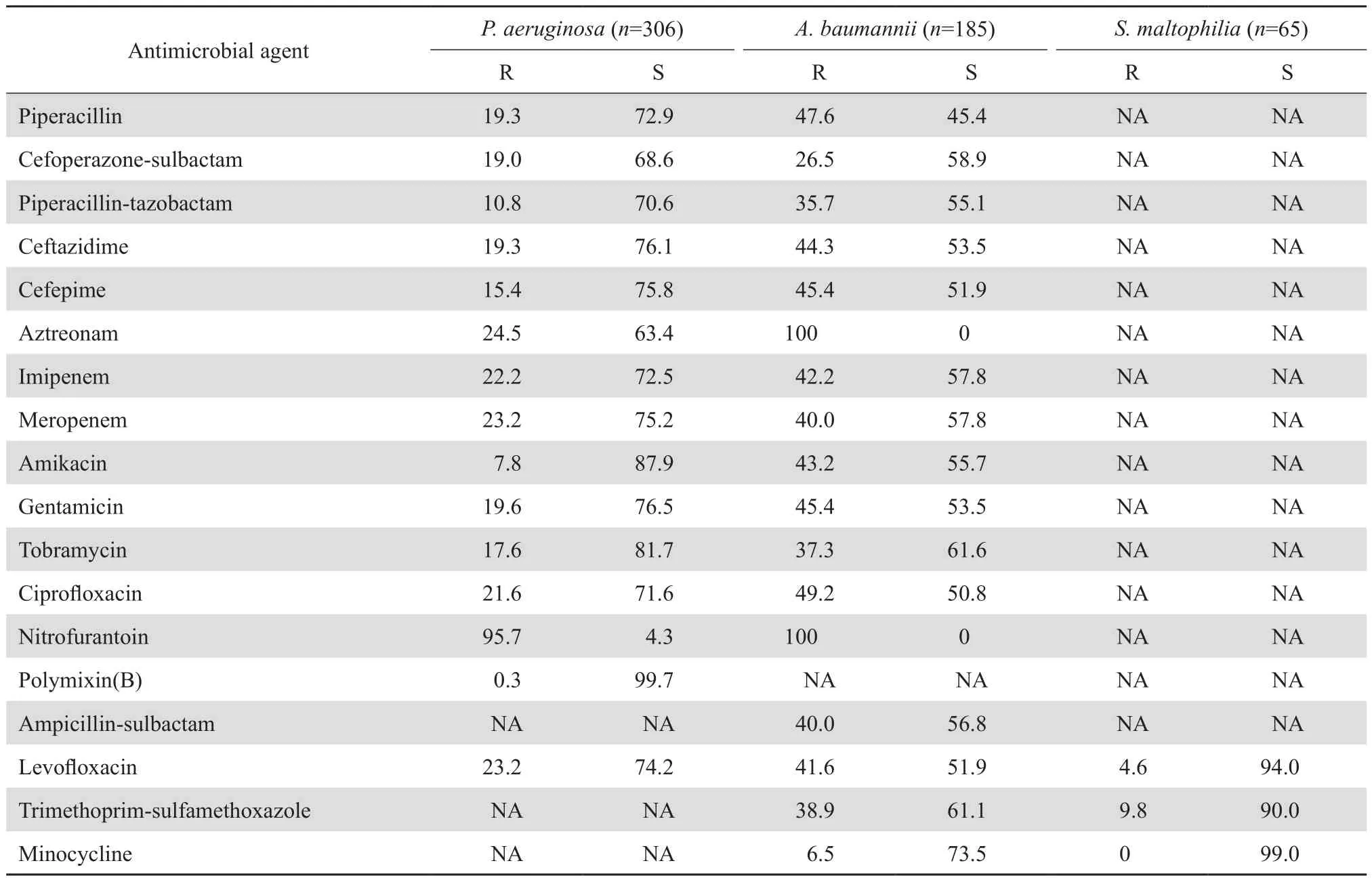
表7 不发酵糖革兰阴性杆菌对抗菌药物的耐药率和敏感率Table 7 Susceptibility of non-fermentative gram negative bacilli to antimicrobial agents(%)
2.3.3 其他革兰阴性杆菌 218株流感嗜血杆菌中检出84株(38.5%)β内酰胺酶阳性,对氨苄西林、氨苄西林-舒巴坦、头孢呋辛的耐药率>30%,对头孢曲松、阿奇霉素、美罗培南、左氧氟沙星和氯霉素的敏感率均>86%,见表8。
2.3.4 CRE 本次共分离出CRE 6株,占肠杆菌科细菌的0.4%(6/1 371),其中肺炎克雷伯菌4株,阴沟肠杆菌1株,奇异变形杆菌1株。CRE对亚胺培南的耐药率高达83.3%,对头孢哌酮-舒巴坦和哌拉西林-他唑巴坦的耐药率分别为66.7%和50.0%。除对阿米卡星的敏感率为66.7%,对其他抗菌药物的耐药率均高于50%。

表8 流感嗜血杆菌对抗菌药物的耐药率和敏感率Table 8 Susceptibility of H. influenzae to antimicrobial agents(%)
3 讨论
本次监测显示,我院MRSA和MRCNS的检出率比2015年CHINET细菌耐药性监测数据稍低[4]。MRSA和MRCNS对β内酰胺类抗生素和其他抗菌药物的耐药率均显著高于MSSA和MSCNS,但MRSA对甲氧苄啶-磺胺甲唑的耐药率较MSSA低。葡萄球菌属中未发现对万古霉素、替考拉宁和利奈唑胺耐药的菌株。肠球菌属中粪肠球菌的检出率高于屎肠球菌,屎肠球菌对大多数抗菌药物的耐药率显著高于粪肠球菌,但对四环素耐药率低于粪肠球菌,粪肠球菌未出现耐替考拉宁和万古霉素的菌株,屎肠球菌发现1株耐万古霉素的菌株,并经万古霉素E试验重新复核确认。万古霉素是糖肽类抗菌药物,通过干扰细胞壁的合成起作用。万古霉素的耐药基因有5种:vanA,vanB,vanC,vanD和vanE型,分别具有不同耐药基因簇编码,其中vanC为天然耐药,其余4型均为获得性耐药[5-7]。
本次数据显示,大肠埃希菌和克雷伯菌属中ESBL的检出率与2015年CHINET细菌耐药性监测数据相近。CRE常常带有多种耐药基因,导致对多种抗菌药物耐药,成为临床治疗的难题[8-9]。其主要的耐药机制为:①细菌产碳青霉烯酶,包括Ambler β内酰胺酶分类中A组酶,如KPC、IMI;B组金属酶,如IMP、NDM;D组酶,如OXA-23。②高产β内酰胺酶联合外膜孔蛋白缺失或低表达。③产ESBL联合外膜孔蛋白缺失或低表达。此外,CRE菌株常同时携带多种其他耐药基因,成为多重耐药或对现有抗菌药物全部耐药的全耐药株,导致有效治疗药物少,发病率和病死率高。有研究表明,患者病房和床位的频繁更换、使用广谱抗菌药物、侵袭性诊疗操作及患者本身严重的基础疾病是CRE传播或定植菌感染的危险因素[10]。Hu等[11]报道77株CRE菌经PCR检测,84.4%菌株含碳青霉烯酶基因,78.3%的菌株含KPC-2基因,个别菌株还带有VIM、IMP-1、IMP-2等基因;84.4%的菌株含CTX-M酶基因(CTX-M-2、-14、-15);40.3%菌株含DHA-1和CMY-2型AMPC酶基因;75.3%菌株至少缺失一种外膜孔蛋白(Omp K335、Omp K36或Omp K37)。以上资料显示CRE已在国内肠杆菌科细菌中广泛存在。由于部分碳青霉烯酶仅导致细菌对碳青霉烯类低度或中度耐药,国内实验室中对此类菌株可能漏检,应加注意[12-13]。目前有研究显示,多黏菌素、替加环素、磷霉素和阿米卡星对CRE菌株有良好的抗菌活性,推荐上述抗菌药物联合治疗,可采用的给药方案如黏菌素或阿米卡星联合碳青霉烯类,黏菌素联合替加环素,阿米卡星联合磷霉素等,但不推荐多黏菌素与阿米卡星的联合[14-15]。
从药敏结果来看,两种肠球菌的耐药谱有很大的差异。氨苄西林和青霉素G对粪肠球菌有良好的抗菌活性,但对屎肠球菌几乎无效。奎奴普丁-达福普汀对粪肠球菌有较好的抗菌活性。因此,临床应依据细菌药敏鉴定及药敏结果合理选择抗菌药物。
不发酵糖革兰阴性杆菌是医院感染的常见病原菌。尤其是多重耐药铜绿假单胞菌和鲍曼不动杆菌所致感染是临床面临的新挑战。近年来各种导管、插管、机械通气等应用增多,此类菌检出率不断增高。对于鲍曼不动杆菌,除了头孢哌酮-舒巴坦、米诺环素和替加环素,其他耐药率均高于35%。
因此,面对日愈严重的细菌耐药性问题,定期进行细菌耐药性监测有助于了解细菌耐药性变迁,为临床合理规范使用抗菌药物提供依据,指导医院感染管理防控措施的制定和避免耐药菌株的传播流行。
[1]ARIAS CA, MURRAY BE. Antibiotic-resistant bugs in the 21st century a clinical super-challenge[J]. N Engl J Med, 2009,360(5):439-443.
[2]叶应妩,王毓三,申子瑜,等.全国临床检验操作规程[S]. 3版.南京:东南大学出版社,2006:917-918.
[3]Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing[S]. Twenty-sixth informational supplement, 2016,M100-S26.
[4]胡付品,朱德妹,汪复,等. 2015年CHINET细菌耐药性监测[J]. 中国感染与化疗杂志,2016,16(6):685-694.
[5]PATEL R. Clinical impact of vancomycin-resistant enterococci[J]. J Antimicrob Chemother,2003,51(Suppl 3):iii13-21.
[6]应春妹,项明洁,倪语星. 耐万古霉素肠球菌表型检测及基因分析[J]. 中华检验医学杂志,2001,24(6):367-368.
[7]余晓君,段荣,周红平. 耐万古霉素肠球菌表型测定及基因分型[J]. 中华医学杂志,2006,16(12):1328-1330.
[8]NORDMANN P, NAAS T, POIREL L. Global spread of carbapenemase-producing Enterobacteriaceae[J]. Emerg Infect Dis,2011,17(10):1791-1798.
[9]NORDMANN P,DORTET L,POIREL L. Carbapenem resistance in Enterobacteriaceae: here is the strom [J]. Trends Mol Med,2012,18(5):263-272.
[10]QIN X,YANG Y ,HU F, et al. Hospital clonal dissemination of Enterobacter aerogenes producing carbapenemase KPC-2 in a Chinese teaching hospital[J]. J Med Microbiol ,2014,63(Pt 2):222-228.
[11]HU F, CHEN S, XU X, et al. Emergence of carbapenem resistance clinical Enterobacteriaceae isolates from a teaching hospital in Shanghai,China[J]. J Med Microbiol,2012,61(Pt 1):132-136.
[12]BRATU S, LANDMAN D, ALAM M. Detection of KPC Carbapenem-hydrolyzing enzymes in Enterobacter spp. from Brooklyn, New York[J]. Antimicrob Agents Chemother,2005,49(2):776-778.
[13]NORDMANN P, GNIADKOWSKI M, GISKE CG, et al.Identification and screening of carbapenemase-producing Enterobacteriaceae[J]. Clin Microbiol Infect,2012,18(5):432-438.
[14]VAN DUIN D, KAYE KS, NEUNER EA, et al. Carbapenemresistance Enterobacteriaceae: a review of treatment and outcomes[J]. Diagn Microbiol Infect Dis, 2013,75(2):115-120.
[15]FALAGAS ME, KARAGEORGOPOULOS DE, NORDMANN P. Therapeutic options for infections with Enterobacteriaceae producing carbapenem-hydrolyzing enzymes[J]. Future Microbiol,2011,6(6):653-666.
