低度鲜地瓜酒生产工艺研究*
2018-01-26张文森
张文森
(福建师范大学福清分校 发酵食品应用技术研究所,福建 福清 350300)
地瓜又名“红薯”,是一种非常重要的食材。地瓜耐早、耐瘠、稳产高产、适应性强、容易栽培,在我国主要的食品作物中,仅次于水稻、小麦和玉米[1],居第4位。地瓜营养丰富,地瓜中含有10%~30%的淀粉,5%左右的糖分及少量蛋白质、油脂、纤维素、半纤维素、果胶、灰分等[2]。我国明代著名医药家李时珍在《本草纲目》中记载“白薯蒸、切、晒、收,充作粮食,使人长寿少病”,并指出地瓜性味甘平,有补脾胃、养心神、益力气[3]、活血化瘀、清热解毒等功效。地瓜含有一种特殊功能的黏蛋白,能维持人体心血管壁的弹性,抑止动脉硬化发生,使皮下脂肪减少,防止肝肾中结缔组织萎缩、预防胶原病发生,并对呼吸道、消化道、关节腔和浆膜腔有很好的润滑作用[4]。总之,地瓜对防止影响人类寿命最重要的疾病—癌症和心血管疾病,都有独到之功效,是真正的绿色保健食品,深受广大消费者的青昧[5]。
近年来,国内外对地瓜的深加工进行了许多研究,如日本萨摩酒造公司开发的甘薯发酵啤酒风味饮料[6],韩国的“真酿”低度饮料酒,均采用甘薯加麦芽发酵而成。国内以连城地瓜产业为例,其地瓜主产品以红心地瓜干加工为主[7],但产品深加工程度低,附加值不高,高附加值的地瓜加工新产品及功能性深加工产品未得到有效的开发生产。尤其是加工过程中产生的边角料等副产品均以直接扔掉或者喂猪这样的简单方式处理,造成资源的浪费,地瓜资源得不到合理的配制和利用[8]。
传统的地瓜酒工艺采用地瓜干进行酿造,民间特别是东南沿海地区也有人用鲜地瓜酿造地瓜酒,却因工艺落后,酿造出来的地瓜酒出现出酒率低,蒸馏时未截头去尾、未勾兑而导致喝了易上头等缺点。
本实验选用餐用型脱水地瓜加工过程产生的边角料等副产品为原料,并对传统地瓜酒的工艺进行改进、优化。通过单因素试验和正交试验确定糖化酶的最佳试验参数和最佳发酵工艺参数,研制开发出高附加值的低度鲜地瓜酒,提高了地瓜资源的利用率,实现地瓜资源的高效利用。
1 材料与方法
1.1 主要材料与设备
1.1.1 材料
鲜地瓜 福清市农机协会
耐高温α-淀粉酶(酶活力≥2000U/g) 江苏锐阳生物科技有限公司
糖化酶(酶活力≥5万U/g) 江苏锐阳生物科技有限公司
红曲 福建古田红曲厂
安琪耐高温酿酒高活性干酵母 安琪酵母股份有限公司
氢氧化钠、乙醇等试剂(分析纯) 福州申辉化学试剂有限公司
1.1.2 设备
酒坛 市售
精宏DK-S24恒温水浴锅 上海精宏实验设备有限公司
BPH9-9272电热恒温培养箱 金坛市信诚实验仪器有限公司
PHS-3E型pH 计 上海仪电科学仪器股份有限公司
打浆机 美的电器有限公司
酒精计 上海科学仪器有限公司
蒸馏器等玻璃仪器 福州玻璃仪器有限公司
1.2 方法
1.2.1 工艺流程

1.2.2 操作要点
(1)原料选择
选用餐用型脱水地瓜加工后剩余的地瓜边角料和等外品。
(2)清洗
将一定量的地瓜边角料和等外品去霉烂,去杂质,清洗干净。
(3)混料、打浆
将清洗好的地瓜边角料与地瓜等外品切块后混合,加入50%的蒸馏水打浆,加热至100℃,保温5min。
(4)液化
在自然pH条件下往地瓜浆中加入8u/g耐高温α-淀粉酶,液化工艺条件为:(92±2)℃,酶解30min。
(5)糖化
糊化完成后,地瓜浆隔水冷却至(59±1)℃时,用2mol/L的柠檬酸调 pH(4.25±0.25) 后,加入糖化酶,糖化工艺条件为:(59±1)℃,酶解89min 。
(6)发酵剂的活化
红曲:将所需红曲置于8~10倍水中常温浸泡活化14~16h。
酵母:将所需干酵母置于25~30倍2%糖液中38~43℃复水活化2h后备用。
(7)接种
糖化结束后,冷却酶解液至28~30℃,接种事先活化好的红曲和酵母,搅拌均匀,装料量需≤2/3的酒坛容量,坛口用两层报纸封住。
(8)发酵
发酵温度控制在25~30℃,落缸后12~14h开头耙,头耙后每隔12h开二耙、三耙、四耙。当醪液拱起并出现开裂时应及时开耙排放二氧化碳,发酵过程注意控制品温不可超过32℃,发酵周期为72h。
(9)蒸馏
发酵结束后,将发酵液并入蒸馏瓶中,加入数颗沸石,缓慢加热蒸馏,分别收集酒头(1%)、基酒(88%~90%)、酒尾(9%~11%)。
(10)勾兑
按配方分别取酒头,基酒,酒尾混合后经错流膜过滤,备用。
(11)灌装、杀菌
地瓜酒灌装封口后,经巴氏杀菌(80℃,20min)获得低度鲜地瓜酒。
1.2.3 分析方法
1.2.3.1 还原糖的测定:按GB/T 5009.7-2008《食品中还原糖的测定》中相关规定执行。
1.2.3.2 酒精度、总酸、总酯的测定:按GB/T 10345-2007《白酒分析方法》中相关规定执行。
1.2.3.3 pH的测定:采用GB/T 10345-2007《白酒分析方法》pH计法 。
1.2.3.4 出酒率的计算方法
发酵醪液采用200目尼龙绢布过滤,测量地瓜酒体积(L),蒸馏后测定其酒精度数,按公式(1-1)计算出酒率:
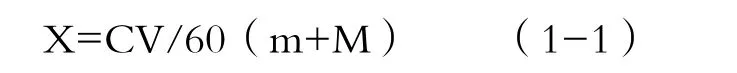
式中:X——出酒率(%);
C——酒液的酒精度%(v/v);
V——过滤后酒液的体积(L);
m——地瓜皮边角料(kg);
M——地瓜等外品(kg)。
1.2.3.5 感官评定
按GB/T 20821—2007《液态法白酒》中感官评价的方法,从香气、外观、口味、风格4个方面进行评价。组织10位对白酒有品评经验的人按表1评分标准进行感官评价,取平均值为最终评分。
1.2.3.6 产品品质标准
酒精度(V/V):4%~12%
其他理化指标按GB/T 20821-2007《液态法白酒》中相关规定执行。

表1 感官评价表
1.2.4 实验方法
1.2.4.1 液化工艺的研究
采用淀粉酶添加量为8u/g、液化温度为90~95℃(厂家提供技术参数),选择酶解时间作为考察因素,以酶解液遇碘液显色情况作为参考指标,确定最佳液化时间。
1.2.4.2 糖化工艺条件的研究
通过单因素实验分析糖化酶添加量、糖化时间对糖化工艺的影响,在单因素实验的基础上,选择糖化酶添加量和糖化时间作为考察因素,以地瓜酶解液中还原糖含量作为参考指标,进行2因素2次回归正交旋转组合确定糖化最佳工艺条件。
1.2.4.3 发酵工艺条件的研究
通过单因素实验分析料水比、酵母添加量、红曲添加量、发酵周期对发酵工艺的影响,在单因素实验的基础上,选择料水比、酵母添加量、红曲添加量、发酵周期作为考察因素,以出酒率和感官评价作为考察指标,进行正交试验确定最佳发酵工艺条件。
1.2.4.4 验证实验
采用最佳的糖化和发酵工艺条件,以500g地瓜投料量进行3批次验证实验,对产品进行感官评价和产品理化指标的测定,验证产品的最佳发酵工艺条件。
1.3 数据统计方法
实验所得数据采用SPSS和Excel软件统计分析
2 结果与分析
2.1 液化工艺的研究
取200g地瓜边角料和50g地瓜等外品,洗净切块混合后加入50%蒸馏水打浆,煮开后保温5min。冷却至(92±2)℃时加入8u/g耐高温α-淀粉酶。每隔5min用碘液测试酶解液呈色情况,结果如图1所示:
由图1可知,随着酶解时间的增加,酶解液显色情况从黑色逐渐变成无色。当酶解时间为30min时,酶解液经碘液测试呈无色,继续增加酶解时间,酶解液显色变化不明显。故确定最佳液化时间为30min。即最佳液化工艺条件为:淀粉酶添加量为8u/g在(92±2)℃条件下酶解30min。
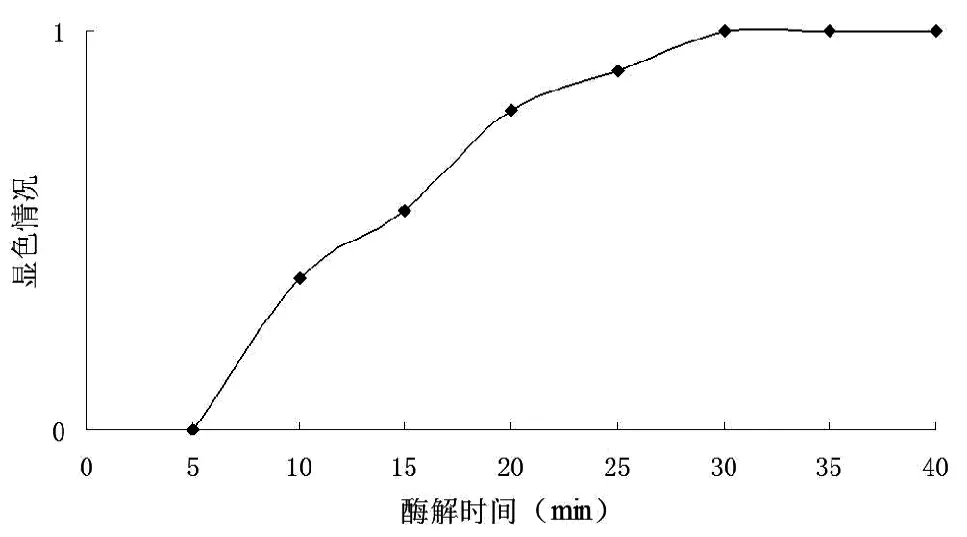
图1 不同液化时间对液化效果的影响
2.2 糖化工艺的研究
2.2.1 不同糖化酶添加量对糖化效果的影响
液化结束后,地瓜浆隔水冷却至58~60℃,分别采用糖化酶添加量为50、100、150、200、250、300u/g,在(59±1)℃,pH(4.25±0.25)的条件下糖化180min,加热灭酶后测定地瓜酶解液中还原糖含量,结果如图2、表2所示:
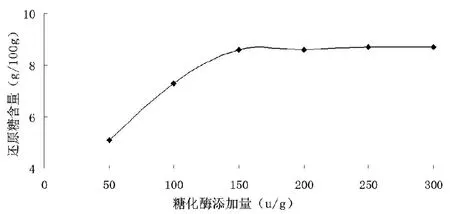
图2 不同糖化酶添加量对糖化效果的影响

表2 不同糖化酶添加量对糖化影响的差异显著性
由图2可知,随着糖化酶添加量的增加,还原糖含量增加,当糖化酶添加量超过150u/g时,还原糖含量增加不显著。在酶促反应中,当底物浓度为固定值时,随着酶添加量的增加,生成物越多;当底物全部被酶分解,酶用量继续增加,生成物几乎不再变化。且经LSD多重比较结果表明:150u/g添加量与100u/g有显著差异而与200u/g无显著差异。故确定最佳糖化酶添加量为150u/g。
2.2.2 不同糖化时间对糖化效果的影响
液化结束后,地瓜浆隔水冷却至58~60℃,在(59±1)℃,pH(4.25±0.25)的条件下添加糖化酶150u/g,分别糖化30、60、90、120、150、180min,加热灭酶后测定地瓜酶解液中还原糖含量,结果如图3、表3所示:

图3 不同糖化时间对糖化效果的影响

表3 不同糖化时间对糖化影响的差异显著性
由图3可知,随着糖化时间的增加,还原糖含量增加,当糖化时间超过90min时,还原糖含量增加不显著。在酶促反应中,当底物浓度为固定值时,随着糖化时间的增加,生成物越多;当底物全部被酶分解后,继续增加糖化时间,生成物几乎不再变化。且经LSD多重比较结果表明:90min与60min有显著差异而与120min无显著差异。故确定最佳糖化时间为90min。
2.2.3 二因素二次回归正交旋转组合优化糖化工艺
在上述单因素实验的基础上,选择糖化酶添加量和糖化时间作为考察因素,进行2因素2次回归正交旋转组合实验,测定地瓜酶解液中还原糖含量,结果见表4、表5、表6。

表4 试验因素水平编码表

表5 2次回归正交旋转组合设计方案
在α=0.10显著水平剔除不显著项后,简化后的回归方程为Y=10.75312X1+0.17065X2-0.52113X1^2最高值各因素组合为X1=0,X2=1.414,Ymax=11.0。故糖化酶添加量为0.75g,糖化时间为89min。即最佳的糖化工艺为:糖化酶添加量为150u/g,在(59±1)℃条件下糖化89min。

表6 糖化工艺方差分析表
2.3 发酵工艺条件的研究
2.3.1 不同料水比对发酵结果的影响

图4 不同料水比对发酵结果的影响

表7 不同料水比对感官评价影响的差异显著性
取糖化结束后冷却至28~30℃的地瓜酶解液加入6%红曲、0.06%干酵母,料水比(酶解液:水)分别采用1:0.5、1:1、1:1.5、1:2和1:2.5,搅匀后28℃发酵3d。测定蒸馏酒液酒精度数,计算出酒率并对其进行感官评价。结果如图4、表7所示:由图4可以看出:随着料水比的增加,出酒率和感官品质也呈上升趋势,但当料水比超过1:1.5时,出酒率和感官品质却呈下降趋势。系料水比小于1:1.5时底物浓度偏高发酵不完全导致发酵醪液中残糖含量高影响出酒率和产品口感;而料水比高于1:1.5时,产品酒精度呈下降趋势,酒体单薄。且经LSD多重比较结果表明:料水比1:1与1:0.5、1:1.5有显著差异,故确定最佳料水比为1:1.5。
2.3.2 不同酵母添加量对发酵结果的影响
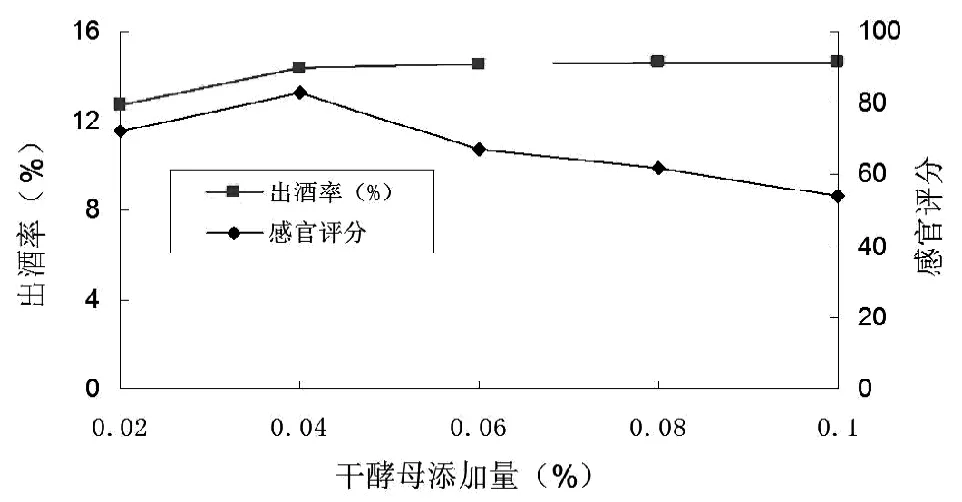
图5 不同干酵母添加量对发酵结果的影响

表8 不同酵母添加量对感官评价影响的差异显著性
取糖化结束后冷却至28~30℃的地瓜酶解液加入6%红曲,料水比为1:1.5,分别采用0.02%、0.04%、0.06%、0.08%和0.1%干酵母添加量,搅匀后28℃发酵3d。测定蒸馏酒液酒精度数,计算出酒率并对其进行感官评价。结果如图5、表8所示:
由图5可知:随着干酵母的增加,出酒率和感官品质也呈上升趋势,但当干酵母量超过0.04%时出酒率增加不显著,而感官品质却显著下降。在底物浓度一定的情况下,由于酵母添加量过大,前发酵速度过快使得发酵酒液口感较为粗糙、苦涩味偏重导致感官品质下降,且经LSD多重比较结果表明:0.04%添加量与0.02%、0.06%有显著差异。故确定最佳干酵母添加量为0.04%。
2.3.3 不同红曲添加量对发酵结果的影响
取糖化结束后冷却至28~30℃的地瓜酶解液加入0.04%干酵母,料水比为1:1.5,分别采用2%、4%、6%、8%和10%红曲添加量,搅匀后28℃发酵3d。测定蒸馏酒液酒精度数,计算出酒率并对其进行感官评价。结果如图6、表9所示:

图6 不同红曲添加量对发酵结果的影响

表9 不同红曲添加量对感官评价影响的差异显著性
由图6可知:随着红曲添加量的增加,出酒率和感官品质也呈上升趋势,但当加曲量超过6%时出酒率增加不显著,而感官品质却下降。随着红曲量的增加,受红曲中多菌种的协同作用,淀粉水解和发酵速度加快,酒度逐渐上升,当加曲量超过6%,对酒精发酵影响很小,出酒率几乎不发生变化,酸味偏重导致感官品质下降。且经LSD多重比较结果表明:6%添加量与4%、8%有显著差异,故确定最佳红曲添加量为6%。
2.3.4 不同发酵周期对发酵结果的影响
取糖化结束后冷却至28~30℃的地瓜酶解液加入0.04%干酵母、6%红曲,料水比为1:1.5,搅匀后28℃发酵2、3、4、5、6、7d。测定蒸馏酒液酒精度数,计算出酒率并对其进行感官评价。结果如图7、表10所示:

表10 不同发酵周期对感官评价影响的差异显著性
由图7可以看出,随着发酵周期的增加,出酒率和感官品质也呈上升趋势,但当发酵天数超过5d时出酒率和感官品质却下降。是由于酒精发酵的同时受产酸菌影响,酒精转化为有机酸,引起酸度增高,最终导致酒度下降,成品偏酸。因此, 从地瓜酒的感官品质和从缩短生产周期考虑,且经LSD多重比较结果表明:发酵3d与发酵2d有显著差异而与4~5d都无显著差异故确定最佳发酵周期为3~5d。
2.3.5 发酵工艺的优化
在上述单因素实验的基础上,选择料水比、酵母添加量、红曲添加量、发酵周期作为考察因素,以出酒率和感官评价作为考察指标,进行正交试验确定最佳发酵工艺条件选用L9(34)正交表进行实验分析,结果见表11、表12、表13、表14。
通过正交分析,由表12可看出:影响产品出酒率的各因素主次顺序为D>A>B>C,且较优方案为:A2B2C3D1。影响产品感官品质的各因素的主次顺序为D>A>B>C且较优方案为A2B2C3D1。且在置信度为95%条件下,4个因素对出酒率感观评价的影响均达到显著效果。综合以上分析,较佳工艺为A2B2C3D1,即将糖化结束后冷却至28~30℃的地瓜酶解液加入0.04%干酵母、8%红曲,料水比为1:1.5,搅匀后28℃发酵3d。

表11 正交试验因素水平表
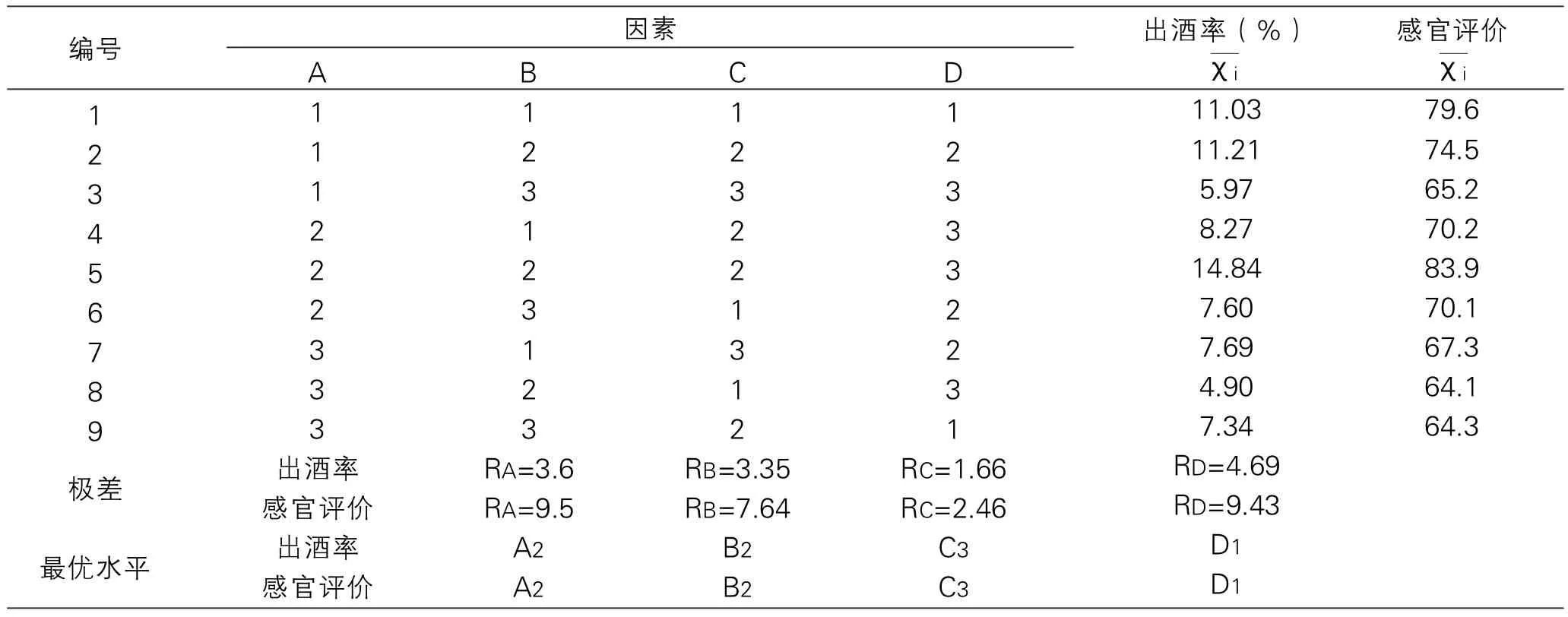
表12 正交试验结果分析表

表13 发酵工艺对出酒率影响的方差分析表

表14 发酵工艺对感官评价影响的方差分析表

表15 验证实验感官评定结果
3 验证实验
3.1 采用正交优化的发酵工艺,以500g投料量进行3批次验证实验,经蒸馏、勾兑、灌装、杀菌获得成品后对产品进行感官评价,测定pH值、总酸、总酯并与GB/T 20821-2007《液态法白酒》中相关指标进行对比,结果如表15和表16所示:

表16 验证实验结果测定
表15和表16产品质量结果表明:3批次的产品的感官及理化指标均符合产品标准要求。
4 结论
采用地瓜边角料和等外品开发低度鲜地瓜酒工艺合理可行,最佳工艺为:以地瓜边角料和等外品为主要原料,打浆加热后加入8u/g淀粉酶在(92±2)℃条件下液化30min,冷却后加入150u/g糖化酶在(59±1)℃条件下糖化89min,糖化结束后冷却至28~30℃,加入0.04%干酵母,8%红曲,料水比为1:1.5。于25~30℃下混合发酵72h。发酵结束后经蒸馏、勾兑、灌装、杀菌获得低度鲜地瓜酒。产品呈无色清亮透明,口感爽净,醇香浓郁、酒体协调,产品各项指标均符合GB/T 20821-2007标准要求。
[1]吴广辉,毕韬韬.红薯营养价值及综合开发利用研究过程[J].食品研究与开发,2015,36(20):189-190.
[2]施能浦.甘薯绿色栽培与地瓜干加工新技术[M].福州:福建科学技术出版社,2006.
[3]薛伟,丁燕.抗癌防病“薯”第一[J].上海蔬菜,2005(6):84.
[4]吕美.红曲固态发酵条件的优化及红曲地瓜酒发酵工艺的研究[D].沈阳:沈阳农业大学,2006.
[5]Ucfen·P.Recory of insoluble fiber fractions by filtration and centrifugation[J].Animal Feed Science and technology,2006(129):316.
[6]陈伟.国内外甘薯饮料的研究现状探析[J].辽宁经济职业技术学院学报,2011,(2):68-69.
[7]曹晓红.连城县地瓜干产业发展对策研究[D].福州:福建农林大学,2006.
[8]王金辉.连城紫色甘薯产业发展问题与对策研究[D].福州:福建农林大学,2015.
