PD-L1在人胶质瘤中的表达及其对肿瘤内浸润性T细胞凋亡的影响*
2018-01-26李巧转
李巧转,李 娴
(1.解放军第101医院病理科,江苏无锡 214044;2.重庆医科大学病理教研室 400016)
胶质瘤是十分常见的中枢神经系统肿瘤,恶性度高,患者生存率低。程序性死亡受体-1(programmed death-1,PD-1)是免疫球蛋白家族的一种膜蛋白,在继发感染中对免疫介导的组织损伤有重要的保护作用,它包含程序性死亡-配体1(PD-L1)和程序性死亡-配体2(PD-L2)两种抑制性配体。研究表明,PD-L1在非小细胞肺癌、卵巢癌、肾细胞癌等众多肿瘤高表达[1-3]。本实验采用免疫组织化学法观察PD-1/PD-L1在人胶质瘤组织中的表达,分析其与临床病理特征相关性。TUNEL法检测胶质瘤内浸润性淋巴细胞的凋亡,流式细胞术分析PD-L1促进胶质瘤患者外周血中活化T细胞的凋亡情况,为胶质瘤免疫治疗提供理论依据。
1 资料与方法
1.1一般资料 正常脑组织18例选自脑外伤脑出血患者,胶质瘤组织80例均取自解放军第101医院病理科2007-2011年的病理标本,术前未经化疗、放疗与激素治疗,病理诊断明确且有完整的临床病理资料,均取得知情同意。其中男45例,女35例,年龄6~75岁,平均(47.5±5.4)岁。根据WHO中枢神经系统肿瘤分型(2011年版)进行分级,Ⅰ级3例,Ⅱ级24例,Ⅲ级20例,Ⅳ级33例。病例资料的随访通过电话和户籍查访两种方法进行,随访时间大于或等于60个月,随访成功54例(67.5%)。胶质瘤患者外周血选取术后确诊在院的胶质瘤Ⅳ级患者(因Ⅳ级患者PD-L1的表达率高),均取得患者及家属同意。
1.2方法
1.2.1试剂 一抗PD-1(克隆号UMAB199),PD-L1(克隆号UMAB228),PD-L2(克隆号UMAB223),CD3(克隆号UMAB54)和二抗检测试剂PV8000均购自无锡傲锐东源生物科技有限公司。
1.2.2免疫组织化学方法 采用的10%中性甲醛固定石蜡包埋组织,4 μm脱蜡水化组织切片,热修复后磷酸缓冲盐溶液(PBS)洗涤,放置H2O2中孵育15 min,滴加一抗孵育过夜(4 ℃),二抗室温孵育30 min后经二氨基联苯胺(DAB)显色,苏木精复染。免疫组织化学结果判断:(1)首先用光学显微镜进行观察,PD-L1、PD-1主要定位于胶质瘤细胞质或细胞膜,阳性染色为细胞质出现黄色或者褐色颗粒,呈弥漫性分布;(2)在400倍视野下,避开出血和坏死区域,选取具有代表性的肿瘤区域,随机选择10个视野,计数500~1 000个细胞,计算每个病例的肿瘤细胞阳性率;(3)肿瘤细胞阳性率评分:<1%为0分;1%~<10%为1分;10%~<50%为2分;50%~<75%为3分;≥75%为4分;(4)同时根据染色强度进行记分:无染色0分;淡黄色1分,棕黄色2分,棕褐色3分;(5)最后根据肿瘤细胞阳性率和染色程度进行评分相加:0~3分为低表达,4~7分为高表达。
1.2.3TUNEL法检测淋巴细胞凋亡 切片脱蜡并经抗原修复及PBS洗涤后H2O2中孵育20 min,清洗后滴加50 μL末端脱氧核糖酸转移酶(TdT)反应液常温孵育1 h,洗涤后滴加辣根过氧化物酶标记的链霉亲和素(Streptavidin-HRP)遮光孵育25 min,DAB显色苏木素复染封片,阴性对照以PBS代替TdT。
1.2.4流式细胞术检测淋巴细胞凋亡 分别收集5例健康和胶质瘤Ⅳ级患者的抗凝新鲜外周血,梯度离心提取单个核细胞后经尼龙毛获得T淋巴细胞。经过聚羟基脂肪酸酯(PHA)活化的T细胞接种于24孔板,每孔500 μL×106个/mL,培养24 h后分为空白组(加入PBS)、拮抗组(抗PD-1+ PD-L1)和实验组(加PD-L1)共培养48 h,收集T细胞,经异硫氰酸荧光素标记的膜联蛋白V(Annexin V-FITC)避光孵育15 min,流式细胞仪检测细胞凋亡。

2 结 果
2.1免疫组织化学检测PD-L1在胶质瘤组织中蛋白表达 结果显示:PD-L1主要定位在肿瘤细胞的细胞质或细胞膜,呈棕黄色着色PD-L1在人正常胶质细胞不表达,在部分胶质瘤中阳性表达42.50%(34/80),见图1。
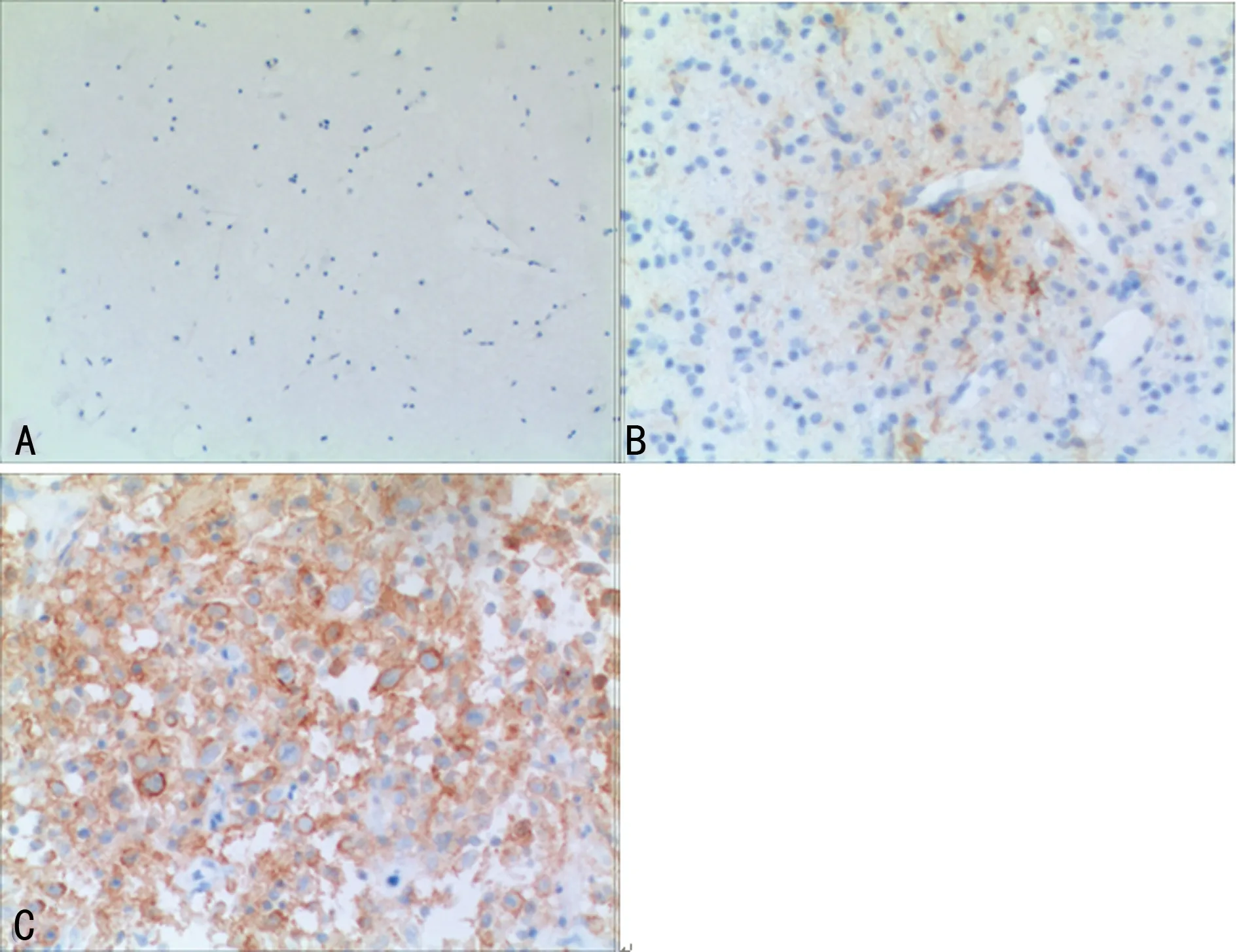
A:正常神经胶质细胞不表达PD-L1;B:胶质瘤低表达PD-L1;C:胶质瘤高表达PD-L1
图1免疫组织化学检测PD-L1在正常胶质细胞、胶质瘤组织的低表达及高表达(×200)
2.2PD-L1与胶质瘤临床病理因素之间的相关性分析 实验对胶质瘤PD-L1的表达与肿瘤位置、大小、有无坏死及临床病理分期及年龄等进行相关性分析,结果显示,病理分级越高,PD-L1的表达水平越高(P<0.01);PD-L1表达与和胶质瘤分级相关的坏死有关,而与患者的年龄、性别、肿瘤位置、大小无关,见表1、2。

表1 PD-L1在80例胶质瘤组织中的表达与临床病理特征(n)

表2 80例胶质瘤患者在不同影响因素下PD-L1表达可信区间分析
2.3PD-L1的表达与患者的预后关系 按照材料与方法中的分类说明,将PD-L1在胶质瘤中的表达分为低表达组(评分0~3分)和高表达组(评分4~7分)。进行Kaplan-Meier生存分析发现:PD-L1低表达组患者5年生存率明显高于PD-L1高表达组的患者(P<0.05),见表3、图2。
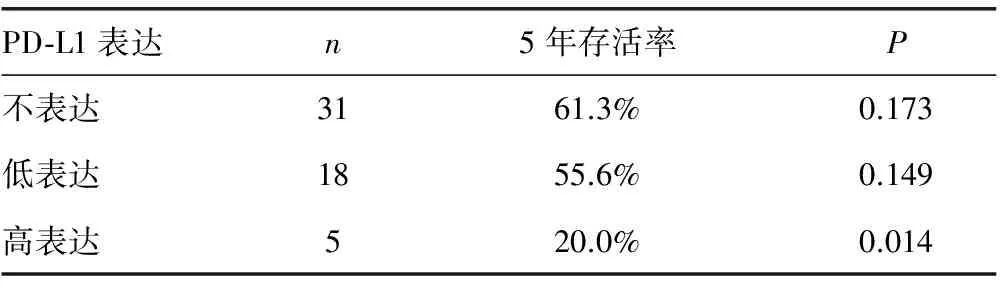
表3 54例胶质瘤随访成功患者PD-L1表达5年生存率
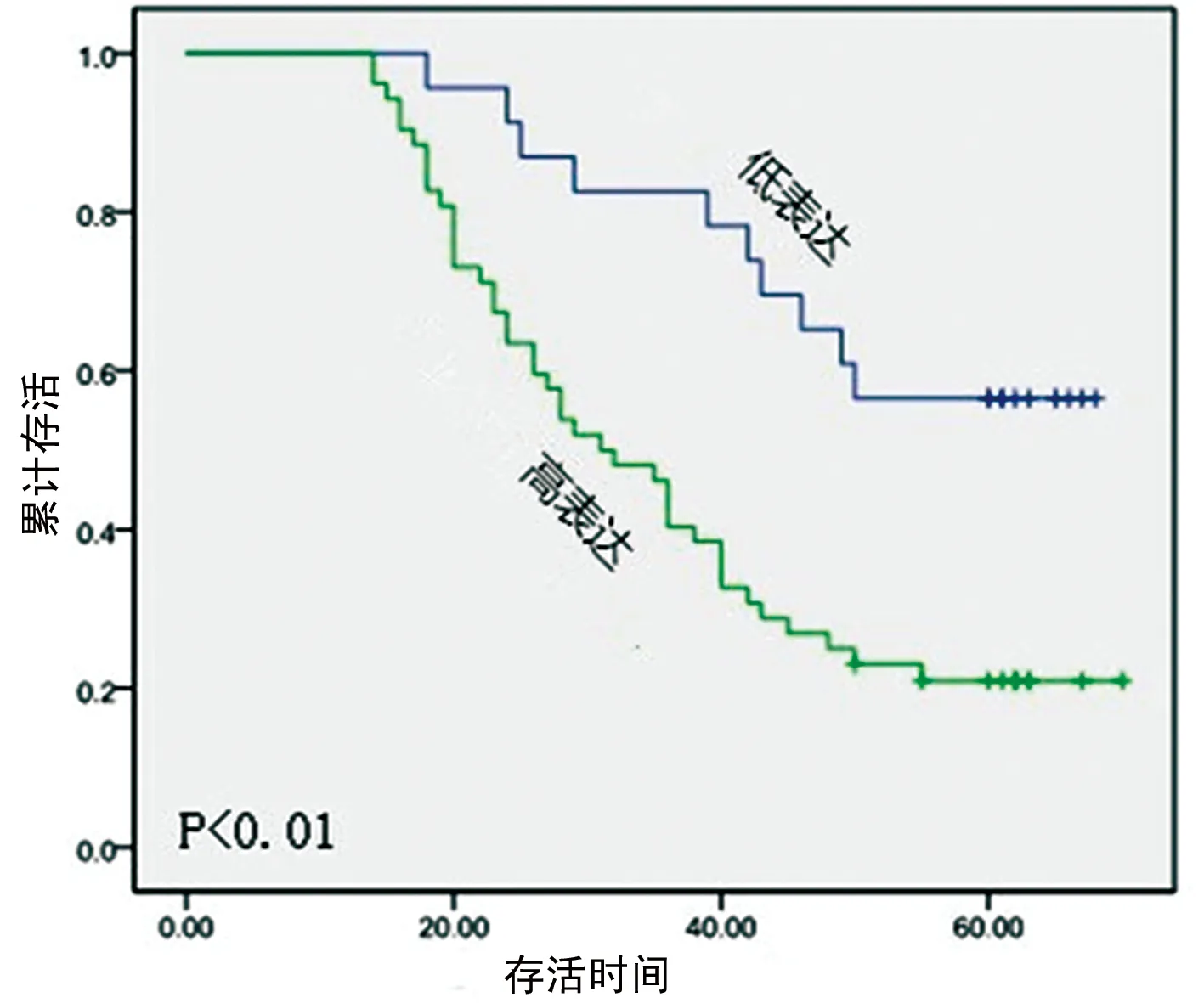
图2 PD-L1在胶质瘤组织中Kaplan-Meier生存曲线分析结果
2.4胶质瘤局部浸润的淋巴细胞表达PD-1并出现凋亡 免疫组织化学染色显示胶质瘤Ⅳ级瘤组织内浸润的部分淋巴细胞表达PD-1。TUNEL法检测结果显示PD-L1强阳性的病例中胶质瘤组织内浸润的淋巴细胞出现凋亡,然而PD-L1阴性的胶质瘤病例瘤组织内淋巴细胞凋亡数少,见图3。
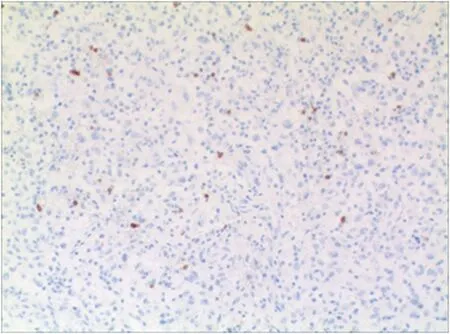
图3 免疫组织化学检测胶质瘤Ⅳ级局部浸润淋巴细胞出现凋亡(TUNEL×200)

图4 PD-L1对外周血活化T细胞凋亡的影响
2.5PD-L1对患者外周血活化T细胞凋亡的影响 流式细胞结果显示重组人PD-L1与健康或胶质瘤患者外周血活化的T细胞共培养后,重组人PD-L1组的凋亡率为42.55%,明显高于空白对照组,加入抗PD-1阻断PD-L1与T淋巴细胞结合后,PD-L1+抗PD-1组T淋巴细胞凋亡率下降至26.80%,见图4。
3 讨 论
恶性胶质瘤患者复发率高、预后较差,迄今为止,胶质瘤局部微环境调节其侵袭性、增殖、凋亡等生物学异常行为的具体分子机制仍不清楚[4]。因此,阐明恶性胶质瘤细胞凋亡发生的分子机制,对胶质瘤的治疗及其预后有着重要的意义。
研究发现PD-L1可以独立作为胰腺癌患者预后评价的指标;同时在胃癌患者,高表达PD-L1患者临床分期晚,病理分化差[5-6],PD-L1高表达病例其肿瘤扩散指数ki-67表达也上调,肿瘤细胞培养中运用阻断剂下调PD-L1后肿瘤细胞的转移与复发也程相对静止状态[7-8]。在非小细胞肺癌中,PD-L1在肿瘤细胞及肿瘤间质与淋巴细胞表达成正相关,也与临床分期及预后呈正相关[9]。这都提示阻断PD-L1可能是肿瘤免疫治疗的有效手段。本研究检测了80例胶质瘤石蜡切片中PD-L1的表达,结果发现胶质瘤各级别之间PD-L1的表达差异有统计学意义(P<0.05),PD-L1的表达随胶质瘤级别的增高而增高,进一步的随访显示胶质瘤高表达PD-L1的患者5年生存率较低[10-11]。
在机体的免疫应答过程中,T细胞是适应性免疫的生发中心。T细胞在静息状态下低表达PD-1,而T细胞的激活引起PD-1的表达上调。本研究表明胶质瘤中浸润性淋巴细胞部分表达PD-1,同时TNUEL实验结果显示高表达PD-L1组胶质瘤内浸润性淋巴细胞凋亡明显,流式细胞结果也显示PD-L1+抗PD-1组T细胞的凋亡率明显下降,PD-L1蛋白促进胶质瘤外周血活化T细胞的凋亡,这提示了胶质瘤高表达的PD-L1与淋巴细胞表达的PD-1结合促进淋巴细胞的凋亡,进而抑制抗肿瘤免疫功能。这可能与T细胞跨膜受体PD-1与配体PD-L1结合后,其碳端结构域磷酸化继而去磷酸化其下游因子磷脂酰3激酶和脾酪氨酸激酶,进而抑制T细胞活化,诱导T细胞凋亡[12-13]有关。
综上所述,人胶质瘤组织异常高表达PD-L1,且与病理分级和患者预后密切相关,PD-L1与PD-1结合促进肿瘤内浸润的T淋巴细胞的凋亡,因此PD-1/ PD-L1信号通路有望成为胶质瘤免疫治疗的靶点之一。
[1]PADDA S K,RIESS J W,SCHWARTZ E J,et al.Diffuse high intensity PD-L1 staining in thymic epithelial tumors[J].J Thorac Oncol,2015,10(3):500-508.
[2]KATSUYA Y,FUJITA Y,HORINOUCHI H,et al.Immunohistochemical status of PD-L1 in thymoma and thymic carcinoma[J].Lung Cancer,2015,88(2):154-159.
[3]SCHULTHEIS A M,SCHEEL A H,OZRETIC L,et al.PD-L1 expression in small cell neuroendocrine carcinomas[J].Eur J Cancer,2015,51(3):421-426.
[4] YIN B J,LI Z Y,YU S B,et al.The roles of mTNF-α and sTNF-α in endotoxin shock[J].Chin J Microbiol Immunol,2002.
[5]GADIOT J,HOOIJKAAS A I,KAISER A D,et al.Overall survival and PD-L1 expression in metastasized malignant melanoma[J].Cancer,2011,117(10):2192-2201.
[6]WANGLC,MAQY,CHENXL,etal.
Clinical significance of B7-H1 and B7-1 expressions in pancreatic carcinoma[J].World J Surg,2010,34(5):1059-1065.
[7]SENDUR M A,AKSOY S,DEMIRCI S,et al.Can targeted programmed death-1 antibody be a new treatment approach in breast cancer[J].J BUON,2014,19(2):584-590.
[8]GHEBEH H,TULBAH A,MOHAMMED S,et al.Expression of B7-H1 in breast cancer patients is strongly associated with high proliferative Ki-67-expressing tumor cells[J].Int J Cancer,2007,121(4):751-758.
[9]马薇,罗殿中,陈源,等.PDLI和PD-I在非小细胞肺癌中的表达及其临床意义[J].实用医学杂志,2011,27(9):1551-1554.
[10]KERR K M,TSAO M S,NICHOLSON A G,et al.Programmed Death-Ligand 1 Immunohistochemistry in Lung Cancer:In what state is this art?[J].J Thoracic Oncol,2015,10(7):985-989.
[11]CIMINO-MATHEWS A,THOMPSON E,TAUBE J M,et al.PD-L1(B7-H1) expression and the immune tumor microenvironment in primary and metastatic breast carcinomas[J].Hum Pathol,2016,47(1):52-63.
[12]SUN H Y,SUN C,XIAO W H.Expression regulation of co-inhibitory molecules on human natural killer cells in response to cytokine stimulations[J].Cytokine,2014,65(1):33-41.
[13]VASSILIKI A M,PRANAM C.Biochemical signaling of PD-1 on T cells and its functional implications[J].Cancer J,2004,34(2):167-175.
