树脂对楸灵素吸附与洗脱特性的影响
2018-01-26冯婷婷苗辰飞于湘莉苗志奇
冯婷婷, 苗辰飞, 于湘莉, 苗志奇
(上海交通大学 农业与生物学院, 上海 200240)
目前, 癌症已严重威胁人类的健康和社会发展[1-2], 因此寻求高效的抗癌药已引起人们广泛关注[3]. 但天然抗癌药均存在资源紧缺和价格高昂等问题, 如紫杉醇[4-6]、 长春新碱[7-8]和鬼臼毒素[9-10]等. 楸灵素为楸树的植物内生真菌FSN002培养时分泌的一种黄酮类物质, 分子量为498, 分子结构中有1个亲水端和1个疏水端, 是一种具有表面活性剂性质的物质, 其水溶性较好且呈弱酸性, 在中性或弱碱性条件下能保持稳定. 含楸灵素的发酵液对肝癌细胞具有较强的选择抑制效果[11], 且发酵液中楸灵素的浓度与抑制癌细胞的能力成正比, 说明楸灵素是发酵液中的主要抗癌物质[12]. 楸灵素的分离纯化可减少发酵液所含杂质引起的毒副作用, 但目前仅采用冷冻浓缩[13]及萃取反萃[14]法浓缩分离楸灵素, 收率与成本均较高, 且萃取及反萃所需有机溶剂用量较大, 具有一定毒性, 环保性差. 大孔树脂的物理、 化学性质稳定, 对酸碱不敏感, 选择性能好[15], 因此常用作植物内生真菌中有效成分的分离和富集, 且成效明显[16-17]. 目前尚未见大孔树脂应用于楸灵素分离纯化的研究报道. 本文研究大孔树脂对楸灵素吸附与洗脱特性以及吸附动力学过程, 为楸灵素在粗提取工艺中树脂的选取提供理论依据.
1 材料与方法
1.1 菌 株
楸树内生真菌FSN002由上海交通大学植物生物技术中心分离并保存[18].
1.2 楸灵素发酵液制备
采用马玲薯葡萄糖琼脂(PDA)液体培养基[18]. 取-80 ℃保存的真菌孢子, 以106个/L的接种量接种到含100 mL PDA培养基的锥形瓶中. 于25 ℃ 100 r/min恒温震荡培养7 d, 发酵液变为亮黄色, 过滤去除菌丝, 收集发酵液于4 ℃冰箱保存[13].
1.3 仪 器
主要实验仪器有: 微量移液器(德国Eppendorf公司); 电热恒温干燥箱(DHG-9240A型, 上海精宏实验设备有限公司); 恒温摇床(DHZ-DA型, 江苏太仓实验设备厂); 超纯水系统(上海和泰仪器有限公司); 台式高速离心机(5417R型, 德国Eppendorf公司); 高压蒸汽灭菌锅(SS-325型, 日本TOMY公司); 数显pH计(pHS-3TC型, 上海天达仪器有限公司); 高效液相色谱仪(2996型, 美国Waters公司).
1.4 大孔树脂静态吸附和洗脱实验
将反相树脂AB-8,NKA-2,NKA-9,HP-20,HPD-200L,HPD-300L,HPD-400,HPD-400A及离子型树脂D330,D318,D201,D311活化预处理后, 用去离子水洗净后备用. 将1 mL树脂置于50 mL三角锥形瓶中, 加入pH=7.0的含楸灵素发酵液10 mL, 恒温20 ℃, 摇床上100 r/min振荡1 h后, 将余液除去, 用去离子水洗净. 反相树脂采用10 mL纯甲醇洗脱10 min, 离子树脂采用体积分数为95%的甲醇饱和氯化钠溶液10 mL洗脱10 min, 并分别取样. 所有样品均采用高效液相色谱(HPLC)方法检测楸灵素的质量浓度(用C18反相色谱柱, 甲醇、 水作为流动相梯度洗脱, 于286 nm紫外检测进行定量分析)[18]. 每组进行3次重复实验. 质量浓度
ρt=(At/A标准品)×ρ标准品,
(1)
其中:ρt为某时刻样品的质量浓度(mg/mL);At为某时刻样品的峰面积;A标准品为标准品的峰面积;ρ标准品为标准品的质量浓度(mg/mL).
吸附量=(ρ0-ρt)×Va/V树脂,
(2)
其中:ρ0为发酵液样品的初始质量浓度(mg/mL);Va为发酵液样品的溶液体积(mL);V树脂为大孔树脂的体积(mL).
洗脱量=ρJ×Vb/V树脂, 洗脱收率=洗脱量/吸附量,
(3)
其中:ρJ为样品从树脂洗脱下楸灵素的质量浓度(mg/mL);Vb为洗脱液的体积(mL). 分离总收率为吸附收率和洗脱收率的乘积. 分离纯度为洗脱样品中楸灵素色谱峰面积占总面积的百分数.
2 结果与分析
2.1 大孔树脂静态吸附实验结果
选择性质不同的大孔树脂进行静态吸附实验, 不同大孔树脂的吸附曲线如图1所示. 由图1可见, 大孔树脂上的楸灵素静态吸附曲线呈典型饱和曲线特征: 在吸附初期, 随着吸附时间的延长, 吸附量迅速增长, 为线性吸附期; 在吸附后期, 楸灵素吸附量达到平衡, 吸附曲线进入平台期. 所有反相树脂达到平衡时的楸灵素吸附量均约为40 mg/mL(图1(A),(B),(C)), 吸附余液中楸灵素几乎完全消失, 离子型大孔树脂达到平衡时的楸灵素吸附量均约为28 mg/mL(图1(D)), 即12种大孔树脂均可有效吸附发酵液中的楸灵素. 其中HP-20具有最大的吸附速率, 仅需约20 min即可达到吸附平衡; NKA-9及D系列离子型树脂约需60 min达到楸灵素吸附平衡; 其他大孔反相树脂达到吸附平衡的时间均约为30 min.
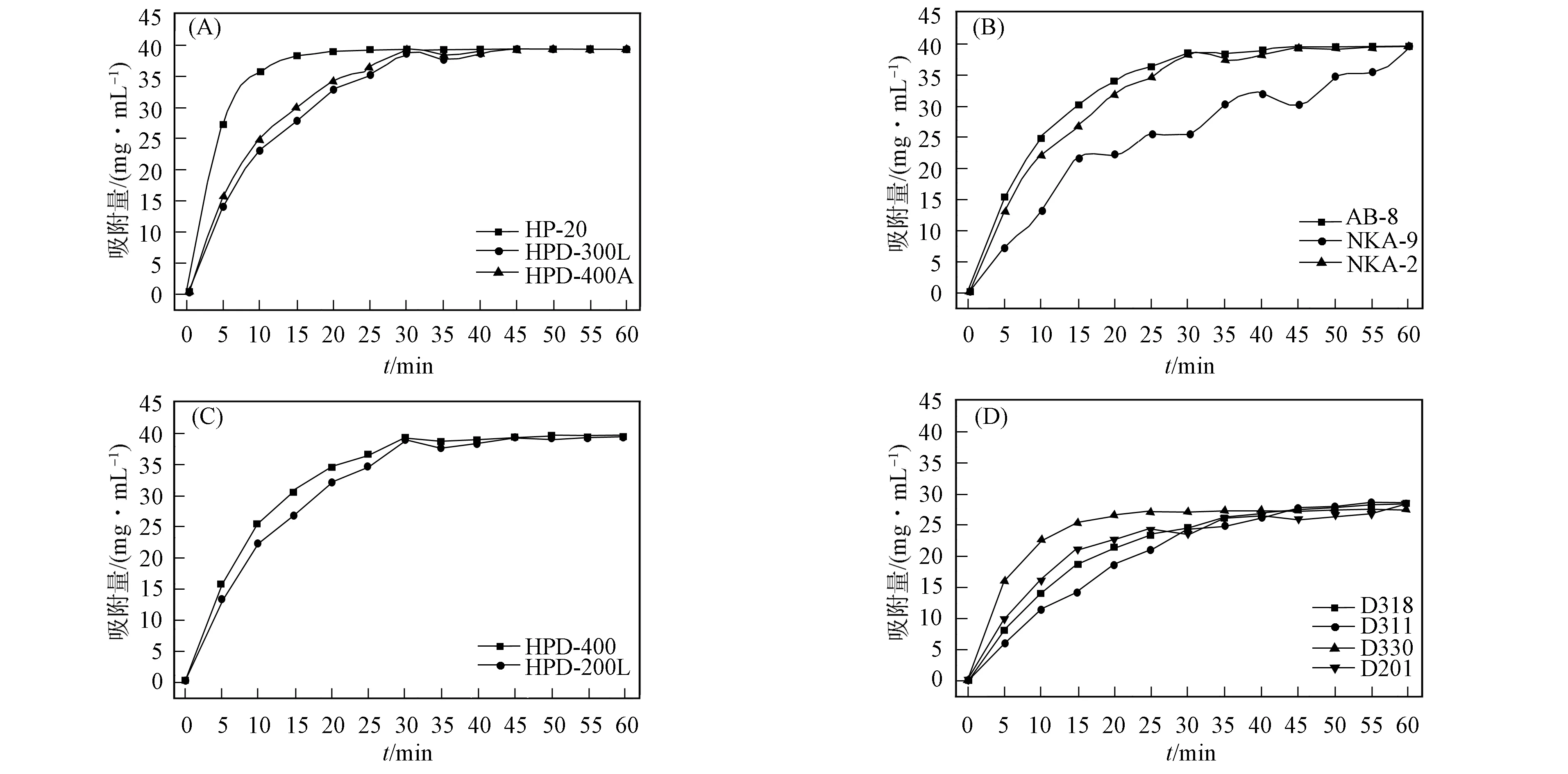
图1 不同大孔树脂的吸附曲线Fig.1 Adsorption curves of different macroporous resins
2.2 大孔树脂静态吸附模型
为消除实验误差的影响, 定量研究大孔树脂对楸灵素的静态吸附性能, 建立楸灵素静态吸附动力学模型. 一级Lagergren方程是进行固液体系模拟分析的常用模型[19], 假设楸灵素吸附过程符合该模型, 即
dQ/dt=k(Qe-Q),
(4)
其中:Q为t(min)时刻单位树脂吸附量(mg/mL);Qe为最大吸附能力, 即吸附达到平衡时单位树脂吸附量(mg/mL);k为吸附速率常数(min-1). 设边界条件:t=0,Q=0;t=∞,Q=Qe. 将吸附速率方程按边界条件积分, 可得:
lnQe-ln(Qe-Q)=kt,
(5)
1-Q/Qe=e-kt.
(6)
假设吸附过程楸灵素无损失, 则根据质量守恒定律可得:
QeVM+VLρe=VLρ0,
(7)
QVM+VLρ=VLρ0,
(8)
其中:ρ0为发酵液中楸灵素的初始质量浓度(mg/mL);ρe为吸附平衡后发酵液中楸灵素的质量浓度(mg/mL);ρ为吸附过程任意时刻发酵液中楸灵素的质量浓度(mg/mL);VL为发酵液的体积(mL);VM为湿树脂的体积(mL);k为吸附速率常数.
由式(6)~(8)可得
ρ/ρ0=ρe/ρ0+(1-ρe/ρ0)e-kt.
(9)
将1-ρe/ρ0用A=VMρe/(VLρ0)表示, 可得:
ρ=(1-A)+Ae-kt,
(10)
K=A/(1-A),
(11)
其中K为吸附平衡常数. 由式(9)可知, 在静态吸附过程中, 发酵液中楸灵素的相对质量浓度随吸附时间呈指数递减. 利用动态规划方法, 借助静态吸附实验中楸灵素相对质量浓度的动力学数据拟合模型参数, 获得各树脂的吸附速率常数及最大吸附量, 结果列于表1. 由表1可见: 楸灵素模拟动态吸附量与实测吸附量相符, 平均误差小于0.01, 表明该模型可准确描述树脂对楸灵素的吸附过程; 楸灵素的吸附符合一级动力学过程; 12种树脂的平均吸附速率常数为0.10 min-1; 实验所用反相树脂与离子交换树脂的平均吸附速率常数差别较小; NKA-9的吸附速率常数最低, HP-20的吸附速率常数最高; 所有反相类型树脂的最大吸附能力均大于39.39 mg/mL, 离子型树脂平均约为28.54 mg/mL, 即类型相同大孔树脂的最大吸附能力基本相同, 反相树脂的吸附能力更佳.

表1 大孔树脂对楸灵素吸附和洗脱特性的影响
2.3 大孔树脂静态洗脱实验结果
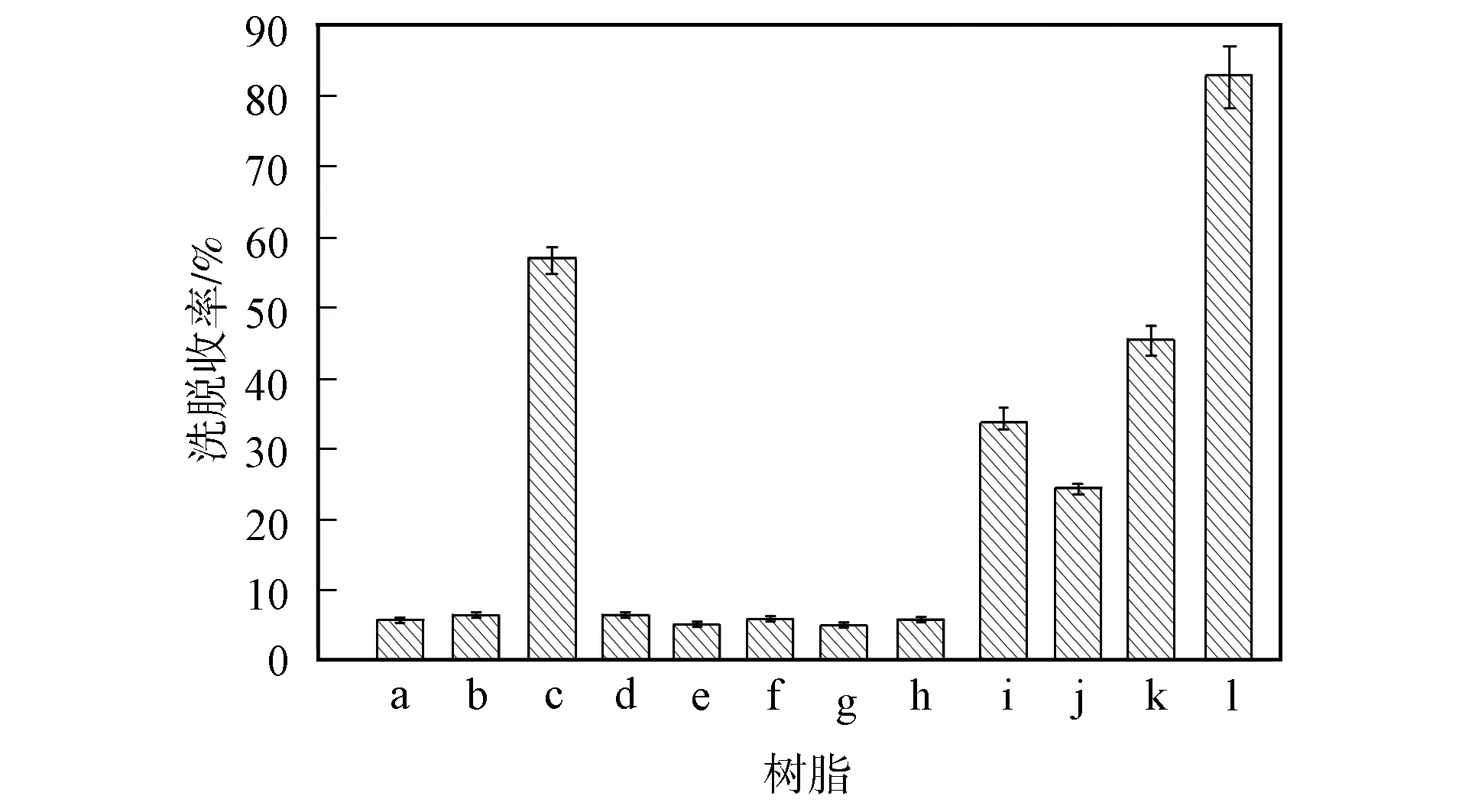
a. AB-8; b. NKA-9; c. NKA-2; d. HP-20;e. HPD-300L; f. HPD-200L; g. HPD-400;h. HPD-400A; i. D318; j. D311; k. D330; l. D201.图2 大孔树脂的洗脱收率Fig.2 Elution rates of macroporous resins
将吸附楸灵素达到平衡后的树脂进行洗脱, 分析洗脱液中楸灵素的质量浓度, 计算各树脂的洗脱收率, 结果如图2所示. 由图2可见, 洗脱收率中反相树脂仅NKA-2较高, 为57%, 其他反相树脂均约为5%~6.5%. 离子型大孔树脂的洗脱收率平均为46.6%, 即离子型树脂比反相树脂更易洗脱楸灵素, D201树脂的洗脱能力最强.
2.4 大孔树脂综合评定与分析
树脂性能的优劣主要取决于楸灵素从树脂上洗脱的收率和质量分数、 树脂的吸附快慢及吸附单位楸灵素所用树脂量. 由表1可见, 大孔反相树脂略优于离子树脂的吸附性能, 但楸灵素的收率较少, 除NKA-2外洗脱性能均较差. 离子型树脂的吸附速率常数较低, 但洗脱率较高, 楸灵素的收率高, 尤其是D201的收率最高, 且树脂的价格低, 因此D201是优选树脂.
在反相树脂中, HP-20,HPD-400,HPD-400A的吸附速率常数较高, 并可快速达到平衡, 主要是因为被分离物质及树脂的极性所致[20], 极性大小一般由分子中TAI基、 糖基等极性基团与烷基和苯环等非极性基团的数量及大小确定[21]. 楸灵素是一种极性较小, 且分子量小的化合物, 极性小的树脂如HP-20和HPD系列等均易与其形成牢固的氢键, 而极性大的树脂则不易形成氢键, 由于大孔树脂均具有良好的网状结构以及较大的比表面积, 因此通过物理吸附作用力可从发酵液中选择性吸附楸灵素, 一段时间后可将楸灵素完全吸附, 吸附率为100%. 在洗脱过程中, 除NKA-2外, 其他大孔反相树脂的洗脱收率均较低, 仅为6%. 由于极性较小的大孔树脂对楸灵素的其的吸附能力较强, 因此不易洗脱[22]. 大孔树脂NKA-2与NKA-9极性相似, 但NKA-2优于NKA-9的洗脱性能, 这是由于受树脂的孔径、 比表面积和孔容等空间结构的影响所致[23].
离子型大孔树脂的吸附速率常数中最大为D330, 其次为D201,D318,D311. 这主要由其活性功能基团决定; D330为环氧结构树脂, 功能基团多, 可吸附分子和离子形式; D201树脂含有叔胺基团, 主要与离子形式存在的楸灵素结合; D311及D318树脂呈弱碱性, 主要与分子形式的楸灵素结合. 4种树脂的吸附率较高, 但均为不完全吸附, 这是由于树脂上可能存在反相吸附位点而导致死吸附. 采用盐和甲醇配比溶液洗脱, 其中甲醇反相洗脱树脂核心, 盐洗脱离子. D201的洗脱收率最高, 其次为D330,D318,D311. 反相树脂高于离子树脂的吸附能力, 但其洗脱能力相对较差, 这是由于楸灵素具有表面活性所致, 其水溶性较好, 具有疏水性和亲水性, 水环境中楸灵素在强疏水性树脂表面形成单分子膜, 疏水头部通过疏水相互作用牢固吸附在强疏水树脂表面上, 亲水尾部排列在外形成亲水表面. 在实现强吸附的过程中, 楸灵素将树脂微环境从疏水性转变为亲水性, 不利于亲脂性溶剂的接近, 导致楸灵素不易洗脱. 中等极性的反相树脂不能形成完整的单分子膜, 最大吸附能力下降, 但洗脱变得相对容易. 离子交换树脂吸附包括离子交换吸附及树脂基质反相吸附, 通过离子交换吸附的楸灵素在饱和盐甲醇溶液中可实现完全洗脱, 因此洗脱收率较高.
综上, 本文可得如下结论: 1) 12种大孔树脂可有效吸附发酵液中的楸灵素, 静态吸附曲线呈典型饱和曲线特征, 其中反相树脂高于离子型树脂的吸附量及吸附速率; 2) 树脂吸附楸灵素的过程符合一级反应动力学模型, 拟合度较高; 3) 离子型树脂吸附的楸灵素易洗脱, 其中D201树脂的洗脱收率最高, 为83%; 4) 考虑12种树脂的吸附及洗脱性能, D201树脂的综合性能最好.
[1] 丁璐, 王亚东, 王贵齐, 等. 社区参与式研究在人群癌症筛查领域的应用 [J]. 中国全科医学, 2015, 18(10): 1225-1228. (DING Lu, WANG Yadong, WANG Guiqi, et al. Application of Community-Based Participation Research in Population-Based Cancer Screening [J]. Chinese General Practice, 2015, 18(10): 1225-1228.)
[2] 金飞燕. 抗肿瘤药物市场浅析 [J]. 中国医药工业杂志, 2005, 36(6): 23-30. (JIN Feiyan. Market Analysis on Antitumor Drugs [J]. Chinese Journal of Pharmaceuticals, 2005, 36(6): 23-30.)
[3] 曾松容, 王海坤, 徐成东, 等. 抗癌药用植物内生真菌的潜在应用价值 [J]. 韶关学院学报, 2001, 22(9): 123-126. (ZENG Songrong, WANG Haikun, XU Chengdong, et al. Discussion on the Endophytic Fungi of Anti-cancer Medicinal Plants and Their Potential Applications [J]. Journal of Shaoguan University, 2001, 22(9): 123-126.)
[4] Stierle A, Strobel G A, Stierle D. Taxol and Taxane Production by Taxomyces and Reanae, an Endophytic Fungus of Pacific Yew [J]. Science, 1993, 260: 214-216.
[5] 史清文. 天然药物化学史话: 紫杉醇 [J]. 中草药, 2011, 42(10): 1878-1884. (SHI Qingwen. Historical Story on Natural Medicinal Chemistry of Taxol [J]. Chinese Traditional and Herbal Drugs, 2011, 42(10): 1878-1884.)
[6] 李力更, 吴明, 史清文. 天然抗癌药物紫杉醇的全合成 [J]. 天然产物研究与开发, 2008, 20(6): 1104-1109. (LI Ligeng, WU Ming, SHI Qingwen. Total Synthesis of Taxol [J]. Natural Product Research and Development, 2008, 20(6): 1104-1109.)
[7] 杨显志, 张玲琪, 郭波, 等. 一株产长春新碱内生真菌的初步研究 [J]. 中草药, 2004, 35(1): 79-81. (YANG Xianzhi, ZHANG Lingqi, GUO Bo, et al. Preliminary Study of a Vincristine-Producing Endophytic Fungus Isolated from Leaves ofCatharanthusroseus[J]. Chinese Traditional and Herbal Drugs, 2004, 35(1): 79-81.)
[8] 卢懿, 侯世祥, 陈彤. 长春花抗癌成分长春新碱研究的进展 [J]. 中国中药杂志, 2003, 28(11): 1006-1009. (LU Yi, HOU Shixiang, CHEN Tong. Advances in the Study of Vincristine an Anticancer Ingredient fromGatharanthusroseus[J]. China Journal of Chinese Materia Medica, 2003, 28(11): 1006-1009.)
[9] 马辰, 罗淑荣. 鬼臼类植物中木脂素类化合物的研究进展 [J]. 中草药, 1992, 23(5): 271-275. (MA Chen, LUO Shurong. Research Progress of Lignans in Podophyllin Plants [J]. Chinese Traditional and Herbal Drugs, 1992, 23(5): 271-275.)
[10] 李海燕, 王志军, 张玲琪, 等. 一种桃儿七内生真菌的分离初报 [J]. 云南大学学报(自然科学版), 1999, 21(3): 243. (LI Haiyan, WANG Zhijun, ZHANG Lingqi, et al. Isolation of an Endophytic Fungus Associated withSinopodophyllumemodi[J]. Journal of Yunnan University (Natural Sciences Edition), 1999, 21(3): 243.)
[11] 吴运帷, 李美芽, 张田, 等. 一株楸树内生真菌的鉴定及其发酵产物的抗肿瘤特性研究 [J]. 东北农业大学学报, 2010, 41(6): 90-93. (WU Yunwei, LI Meiya, ZHANG Tian, et al. Study on the Identification of One Endophytic Fungus Isolated fromCatalpabungeiand the Anti-cancer Activity of Metabolites Produced by the Fungus [J]. Journal of Northeast Agricultural University, 2010, 41(6): 90-93.)
[12] 于湘莉, 赵雅静, 张利达, 等. 楸树内生真菌抗癌性能研究 [J]. 上海医药, 2012, 33(13): 49-52. (YU Xiangli, ZHAO Yajing, ZHANG Lida, et al. Study on the Anti-cancer Activity of Endophytic Fungi Isolated fromJuglansmandshuricaMaxim [J]. Shanghai Medical & Pharmaceutical Journal, 2012, 33(13): 49-52.)
[13] 胡郁楠, 于湘莉, 唐克轩, 等. 楸灵素在水环境下的热稳定性及热降解动力学 [J]. 化工学报, 2016, 67(4): 1448-1452. (HU Yunan, YU Xiangli, TANG Kexuan, et al. Stability and Dynamic Degradation Model of Catalitaxol in Water [J]. Journal of Chemical Industry and Engineering, 2016, 67(4): 1448-1452.)
[14] MIAO Zhiqi, FENG Tingting, HU Yunan, et al. Separation Method of Purification the Fermentation Liquor Which Isolated from Juglansmandshurica Maxin by Extraction: China, CO7G99/00, 201510031256 [P]. 2015-05-13.
[15] 米靖宇, 宋纯清. 大孔吸附树脂在中草药研究中的应用进展 [J]. 中成药, 2001, 23(12): 914-917. (MI Jingyu, SONG Chunqing. Advances of Application of Macroporous Resin in Study of Traditional Chinese Herbs [J]. Chinese Traditional Patent Medicine, 2001, 23(12): 914-917.)
[16] 张琳, 杨磊, 牛卉颖, 等. 大孔树脂吸附分离长春花中的文多灵、 长春质碱和长春碱 [J]. 化工学报, 2008, 59(3): 607-614. (ZHANG Lin, YANG Lei, NIU Huiying, et al. Separation of Vindoline, Catharanthine and Vinblastine fromCatharanthusroseus(L.) G. Don with Macroporous Absorption Resin [J]. Journal of Chemical Industry and Engineering, 2008, 59(3): 607-614.)
[17] 张琳, 牛卉颖, 杨磊, 等. 离子交换树脂对长春花中的文多灵、 长春质碱和长春碱的富集研究 [J]. 离子交换与吸附, 2008, 24(3): 223-231. (ZHANG Lin, NIU Huiying, YANG Lei, et al. The Study on Preconcentration of Vindoline, Catharanthine and Vinblastine by Ion Exchange Resin [J]. Ion Exchange and Adsorption, 2008, 24(3): 223-231.)
[18] MIAO Zhiqi, Li M Y, TANG Kexuan. Preparation of the Fermentation Liquor Which Inhibit the Liver Cancer Cells’ Growth: China, C12P1/02, ZL2008100412148 [P]. 2010-09-29.
[19] Metwally E. Kinetics Studies for Sorption of Some Metal Ions from Aqueous Acid Solutions onto TDA Impregnated Resin [J]. Journal of Radioanalytical and Nuclear Chemistry, 2006, 270(3): 559-566.
[20] 潘见, 陈强, 谢慧明, 等. 大孔树脂对葛根黄酮的吸附分离特性研究 [J]. 农业工程学报, 1999, 15(1): 236-240. (PAN Jian, CHEN Qiang, XIE Huiming, et al. Performance of Absorption and Separation of Macroreticular Resin for Pueraria Isoflavones [J]. Transactions of the Chinese Society of Agricultural Engineering, 1999, 15(1):236-240.)
[21] Payne G F, Ninomiya Y. Selective Adsorption of Solutes Based on Hydrogen Bonding [J]. Separation Science & Technology, 1990, 25(11/12): 1117-1129.
[22] 屠鹏飞, 贾存勤, 张洪全. 大孔吸附树脂在中药新药研究和生产中的应用 [J]. 世界科学技术----中医药现代化, 2004, 6(3): 22-28. (TU Pengfei, JIA Cunqin, ZHANG Hongquan. A Study on Pharmacokinetics of Slow Releasing Drugs of Traditional Chinese Medicine [J]. World Science and Technology: Modernization of Traditional Chinese Medicine and Materia Medica, 2004, 6(3): 22-28.)
[23] 秦俊哲, 程伟, 杜军国. 大孔树脂对桑黄多糖提取液中色素的吸附与解吸特性研究 [J]. 陕西科技大学学报, 2013, 31(1): 73-77. (QIN Junzhe, CHENG Wei, DU Junguo. Adsorption and Desorption Characteristics of Macroporous Resins to Pigments ofPhellinuslinteusPolysaccharide Extraction [J]. Journal of Shaanxi University of Science & Technology, 2013, 31(1): 73-77.)
