液相色谱-三重四极杆质谱同时测定食品接触材料中双酚A、双酚F与双酚S的迁移量
2018-01-25梁锡镇隋海霞钟怀宁
梁锡镇,隋海霞,李 丹,钟怀宁
(1.广东出入境检验检疫局检验检疫技术中心,广东 广州 510623;2.国家食品安全风险评估中心,北京 100022)
双酚A(BPA)是聚碳酸酯塑料和环氧涂层的原材料,在食品接触材料中被广泛应用[1]。研究表明双酚A具有一定的内分泌干扰作用,对婴幼儿影响尤其明显[2],因此欧盟、日本、中国、美国对双酚A在食品接触材料中的使用进行了严格限制[3]。目前,人们常用结构和性能与双酚A较为类似的双酚F(BPF)或双酚S(BPS)代替双酚A。但有研究表明,双酚F和双酚S也同样具有一定程度的人体健康危害性[4-6]。国家标准GB 9685-2016对双酚S在涂层中的使用进行了限制,要求其特定迁移量不得超过0.05 mg/kg[7],欧盟的相关标准中也要求其在塑料中的特定迁移量不得超过0.05 mg/kg[8]。
目前,国内外关于双酚A的检测方法主要有电化学分析法[9-10]、高效液相色谱法[11-13]、分光光度法[14]、气相色谱-质谱法[15-16]和液相色谱串联质谱法[17-18]等。但同时测定食品接触材料中双酚A、双酚F和双酚S特定迁移量的方法尚未见报道。由于双酚类物质在食品接触材料中的广泛使用,亟需建立一种灵敏度高、基质干扰小的多组分分析方法。本研究采用液相色谱-三重四极杆质谱法对食品接触材料中的双酚类化合物BPA、BPF和BPS进行研究,建立的方法快速灵敏、选择性好,且无需样品衍生化处理,有较好的实用性。
1 实验部分
1.1 仪器与试剂
Agilent 1200-6460液相色谱-三重四极杆质谱仪(美国安捷伦公司),带Chemstation和MassHunter软件数据处理系统;ZORBAX Eclipse XDB-C18液相色谱柱(柱长150 mm,内径4.6 mm,粒度3.5 μm);100、1 000 μL可调移液器,购自Sartorius公司;10 μL微量注射器;0.22 μm滤膜(尼龙66)购自津腾公司。
标准物质:双酚A(BPA,98.5%)、双酚F(BPF,99.9%)均购自Dr.E公司;双酚S(BPS,99.9%)购自CMW公司;双酚A同位素内标(BPA-3,3’,5,5’-d4,99.6%)购自C/D/N ISOTOPES公司;双酚F同位素内标(BPF-d10,98.0%)购自Toronto Research Chemocals公司;双酚S同位素内标(BPS-13C12,98.0%)购自CIL公司。乙酸、乙醇、异辛烷、甲醇、氨水均为HPLC级,购自Fisher公司。
1.2 标准溶液的配制
1.2.1标准储备溶液与标准中间溶液分别量取BPA、BPF和BPS及其同位素内标标准物质,用甲醇配制成6种质量浓度为1 000 mg/L的单标储备溶液。再用甲醇稀释成质量浓度为10 mg/L的BPA、BPF和BPS混合标准中间溶液以及质量浓度为10 mg/L的BPA、BPF和BPS同位素内标混合标准中间溶液。
1.2.2水基、酸性食品、酒精类食品模拟物标准工作溶液准确吸取50 μL BPA、BPF和BPS同位素内标混合标准中间溶液于7个50 mL容量瓶中,分别加入0、5、10、25、50、100、250 μL BPA、BPF和BPS混合标准中间溶液,用水定容,得到BPA、BPF和BPS质量浓度均为0、1、2、5、10、20、50 μg/L的标准工作溶液,BPA、BPF和BPS同位素内标浓度为10 μg/L。采用同样方式,分别用对应水基、酸性食品、酒精类食品模拟物配制相同质量浓度系列的BPA、BPF和BPS标准工作溶液。
1.2.3油基食品模拟物标准工作溶液分别称取50 g(精确至0.01 g)油基食品模拟物至7个具塞试管中,准确吸取50 μL BPA、BPF和BPS同位素内标混合标准中间溶液于7个50 mL容量瓶中,再分别移取0、5、10、25、50、100、250 μL BPA、BPF和BPS混合标准中间溶液于试管中,得到BPA、BPF和BPS质量浓度均为0、1、2、5、10、20、50 μg/L的标准工作溶液,BPA、BPF和BPS同位素内标质量浓度为10 μg/L。称量2 g各浓度标准工作溶液于试管中,分别在每个试管中再加入3 mL正己烷,混匀,加入2 mL甲醇-水混合液(体积比1∶1),涡旋振荡2 min,静置分层。用玻璃注射器吸取下层水溶液,过0.22 μm滤膜后供测定用。
1.3 迁移试验
在国标的相关标准中,指出了食品接触材料及制品迁移试验的基本规则,包括测试方法、试验对象、试验条件、模拟液等。其中,水溶液食品采用蒸馏水,酸性食品采用乙酸水溶液,乙醇类食品采用乙醇水溶液,而对油性食品各标准规定的食品模拟液有所不同,如异辛烷、橄榄油等[13]。本实验根据样品实际接触食品类型选用以下食品模拟液:4%(体积分数,下同)乙酸、10%乙醇、20%乙醇、95%乙醇和油基食品模拟物异辛烷。
1.4 浸泡液的处理
1.4.1水基、酸性食品、酒精类食品模拟物准确量取迁移试验中得到的水基、酸性食品、酒精类食品模拟物约1 mL,过0.2 μm滤膜后供测定用,平行制样2份。
1.4.2油基食品模拟物准确称取迁移试验中得到的油基食品模拟物(2±0.01) g于试管中,加入3 mL正己烷,混匀,加入2 mL甲醇-水(体积比1∶1),涡旋振荡2 min,静置分层。用注射器吸取下层水溶液,过0.22 μm滤膜后待测。平行制样2份。
1.5 液相色谱-三重四极杆质谱条件
1.5.1液相色谱条件ZORBAX Eclipse XDB-C18色谱柱(柱长150 mm,内径4.6 mm,粒度3.5 μm);柱温:35 ℃;流速:0.6 mL/min;进样量:10 μL,流动相:甲醇-0.1%氨水(75∶25)。
1.5.2质谱条件电喷雾离子源(ESI),负离子模式(-),多反应监测(MRM)。雾化气压力:40 psi,喷雾电压:500 V,毛细管电压:4 000 V,气流速度:10 L/min,气流温度:350 ℃,鞘气(N2)流速:11 L/min,鞘温度:300 ℃。
2 结果与讨论
2.1 流动相的选择
实验考察了甲醇-水和乙腈-水流动相体系对BPA、BPF和BPS离子化程度的影响。结果表明,甲醇-水的仪器响应值高于乙腈-水。进一步比较了在甲醇-水中分别加入0.1%氨水、5 mmol/L甲酸铵、5 mmol/L乙酸铵等挥发性添加剂的影响。结果表明,以甲醇-0.1%氨水溶液作为流动相可获得最优的色谱分离效果和质谱信号响应。由于BPA、BPF和BPS带有羟基,在负离子电离模式下溶液中能够电离出1个H+。当流动相中加入适量碱性物质(如氨水)时,将促进目标化合物的电离,从而提高其离子化效率。考察了氨水添加量(0.05%~0.5%)的影响,发现氨水最佳添加量为0.1%。最终选择甲醇-0.1%氨水溶液(75∶25)等度洗脱,BPA、BPF和BPS可在5 min内分析完毕。
2.2 质谱条件的优化
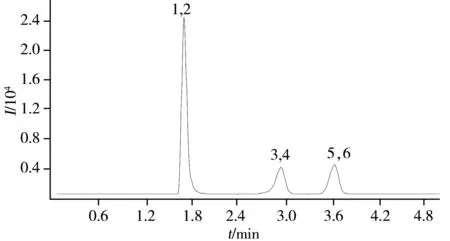
图1 BPA、BPF、BPS及其同位素内标的多反应监测色谱图Fig.1 MRM chromatogram of BPA,BPF,BPS and their isotope internal standards1:BPS,2:the isotope internal standard of BPS,3:BPF,4:the isotope internal standard of BPF,5:BPA,6:the isotope internal standard of BPA
根据酚类环境雌激素具有酚羟基的化学电离性质,选用ESI-作为离子化模式,采用流动注射泵连续进样方式进行质谱条件的优化,实验结果表明,BPA、BPF和BPS在离子源ESI-电离方式下,可获得较高丰度的[M-H]-母离子。采用子离子扫描方式进行二级质谱分析,对子离子进行了优化选择,确定定量离子和辅助定性离子,通过优化毛细管电压、碎裂电压、碰撞池加速电压、碰撞能量、质谱分辨率等质谱参数,使BPA、BPF和BPS的准分子离子与特征碎片离子产生的离子对强度达到最大,将高效液相色谱和三重四极杆质谱仪联用,对气流温度、鞘气温度及流量、锥孔气流量进行优化,使样液中待测物质的离子化效率达到最佳。
应用液相色谱-串联质谱具有灵敏度高、选择性好和抗干扰等特点的选择离子方式进行测定。实验首先通过全扫描方式(SCAN)作出总离子流图(TIC),然后根据其质谱图中的碎片离子选择丰度相对较高、分子质量较大的碎片离子针对测试样品进行产物离子扫描,最后选择质谱多反应监测(MRM)对BPA、BPF和BPS进行准确分析。最终确定BPA、BPF和BPS质谱参数见表1,BPA、BPF、BPS及其同位素内标的总离子流色谱图见图1。

表1 BPA、BPF、BPS及其同位素内标优化后的保留时间、定量、定性离子对及碰撞能量Table 1 Optimized parameters of retention times, quantitative ions,qualitative ions and collision energies for BPA,BPF,BPS and their isotope internal standards
2.3 线性范围与定量下限
对BPA、BPF和BPS的混合工作溶液进行测试,以各物质的质量浓度(X,μg/L)为横坐标,对应峰面积(Y)为纵坐标绘制标准曲线,BPA、BPF和BPS在1~100 μg/L质量浓度范围内线性良好,相关系数为0.996~0.999。以3倍信噪比(S/N=3)作为检出限(LOD),以10倍信噪比(S/N=10)作为定量下限(LOQ),得BPA、BPF和BPS在不同食品模拟物的方法LOD和LOQ,结果见表2~4。 BPA、BPF和BPS的色谱分离效果良好,BPA和BPF在1~50 μg/L质量浓度范围内与峰面积均呈线性关系,BPS在0.1~50 μg/L质量浓度范围内与峰面积呈线性关系。BPA和BPF的最低检出限为0.3 μg/L,BPS的最低检出限为0.05 μg/L。

表2 BPA、BPF和BPS在4%乙酸食品模拟物中的线性回归方程、相关系数、检出限和定量下限Table 2 Regression equations,correlation coefficients(r),limits of detection(LOD)and limits of quantitation(LOQ)of BPA,BPF and BPS in 4%acetic acid food simulant

表3 BPA、BPF和BPS在10%乙醇食品模拟物中的线性回归方程、相关系数、检出限和定量下限Table 3 Regression equations,correlation coefficients(r),limits of detection(LOD)and limits of quantitation(LOQ)of BPA,BPF and BPS in 10%ethanol food simulant

表4 BPA、BPF和BPS在异辛烷食品模拟物中的线性回归方程、相关系数、检出限和定量下限Table 4 Regression equations,correlation coefficients(r),limits of detection(LOD)and limits of quantitation(LOQ)of BPA,BPF and BPS in isooctane food simulant
2.4 回收率与精密度
在样品的迁移试验中,分别添加3种不同的食品模拟液(4%乙酸、10%的乙醇和异辛烷),再加入一定量的BPA、BPF和BPS混合标准溶液和BPA、BPF和BPS同位素内标混合标准溶液,使得BPA、BPF和BPS在溶液中的加标质量浓度分别为2、10 μg/L,BPA、BPF和BPS同位素内标溶液中的质量浓度为10 μg/L,待样品前处理完成后,每个添加水平平行测试6次。结果表明,BPA、BPF和BPS的回收率为83.6%~102.6%,相对标准偏差(RSD)为3.5%~8.9%。方法的精密度和准确度能够满足定量分析要求。

图2 某矿泉水桶样品的色谱图Fig.2 Chromatogram of a mineral water bucket sample1.the isotope internal standard of BPS,2.the isotope internal standard of BPF, 3.the isotope internal standard of BPA, 4.a mineral water bucket sample(1.BPS同位素内标,2.BPF同位素内标,3.BPA同位素内标,4.某矿泉水桶样品)
2.5 实际样品的测试
对10款市售聚碳酸酯水杯、矿泉水桶等样品和10款环氧涂层样品进行了测试。结果表明,BPA的迁移量在0.4~34.2 μg/kg之间,BPF的迁移量在0.4~3.2 μg/kg之间,BPS的迁移量在0.08~4.3 μg/kg之间。
此外,针对4%乙酸、10%乙醇、20%乙醇、50%乙醇、异辛烷的食品模拟物分别进行迁移试验,结果表明,BPA、BPF和BPS在乙醇溶液类食品模拟物中迁移量较高,且乙醇浓度越高迁移量越大,在异辛烷中的迁移量较低。这可能是因为带羟基的BPA、BPF和BPS分子更易溶于乙醇溶液中,但不易溶于异辛烷。
3 结 论
本文采用液相色谱-三重四极杆质谱建立了食品接触材料中双酚类化合物BPA、BPF和BPS的分析方法。3种化合物在1~50 μg/L浓度范围内线性关系良好,BPA和BPF的最低检出限为0.3 μg/L,BPS的最低检出限为0.05 μg/L。添加水平为2 μg/L和10 μg/L时,3种化合物的回收率为83.6%~102.6%,RSD为3.5%~8.9%。该方法具有操作简便、灵敏度和准确度高、抗干扰能力强的特点,能够满足食品接触材料中BPA、BPF和BPS的检测需求。
[1] Hu X W,Zhang W D,Liu Y Q.FoodSci.(胡向蔚,张文德,刘炎桥.食品科学),2006,(4):264-266.
[2] Guo Y M.PlasticsAdditives(郭永梅.塑料助剂),2012,(3):1-3.
[3] Guo L M.PlasticsAdditives(郭丽敏.塑料助剂),2011,(2):7-9.
[4] Ví Lchez J L,Zafra A,González-Casado A,Hontoria E,Olmo M E.Anal.Chim.Acta,2001,431(1):31-40.
[5] Ji K,Hong S,Kho Y,Choi K.Environ.Sci.Technol.,2013,47(15):8793.
[6] René V,Watson C S.Environ.HealthPerspect.,2013,121(3):352-358.
[7] GB 9685-2016.Standard for the Use of Additives for Food Contact Materials and Articles.National Standards of the People′s Republic of China(食品接触材料及制品用添加剂使用标准.中华人民共和国国家标准).
[8] Commission Regulation(EU)No10/2011 of 14 January 2011 on Plastic Materials and Articles Intended to Come into Contact with Food.
[9] Wang Y C,Liu Z R,Gong Q J.FoodSci.(王玉春,刘赵荣,弓巧娟.食品科学),2010,31(20):303-306.
[10] Zhang W D,Ma Z D,Guo Z.Chin.J.Anal.Chem.(张文德,马志东,郭忠.分析化学),2003,31(2):249.
[11] Zhang W W,He M Y,Chen Q.ChemicalEngineer(张文雯,何明阳,陈群.化学工程师),2005,19(12):27-28.
[12] Wu Z Y,Luo S P,Zhu Y,Liu H J,Wang X.Textile.Dye.Finish.J.(吴泽颖,罗世鹏,朱烨,柳海军,王昕.染整技术),2015,(3):48-50.
[13] Miao J Z,Xue M,Zhang H.Chin.J.Anal.Chem.(缪佳铮,薛鸣,张虹.分析化学),2009,37(6):911-914.
[14] Shi M,Chen C Y,Ma M H.Chin.J.Spectrosc.Lab.(施梅,陈昌云,马美华.光谱实验室),2009,26(6):1672-1675.
[15] Perrin F X,Nguyen T M H,Tran T M L,Vernet J L.Polym.Test.,2006,25(7):912-922.
[16] Wei B W,Miao J W,Yu W J.Chin.J.Anal.Lab.(卫碧文,缪俊文,于文佳.分析试验室),2009,28(1):107-109.
[17] Ma Q,Bai H,Wang C,Zhang Q,Zhou X,Dong H,Wang B L.Chin.J.Anal.Chem.(马强,白桦,王超,张庆,周新,董辉,王宝麟.分析化学),2010,38(2):197-201.
[18] Jiang H,Shang G Q,Zhao M,Chen M,Wang W Y.FoodRes.Dev.(姜欢,商贵芹,赵敏,陈明,王文烨.食品研究与开发),2014,(21):86-88.
