慢病毒介导稳定高表达Cx32的Huh7细胞系建立及其对细胞增殖的影响
2018-01-24纪玉婷郑荣生张吴琼
纪玉婷,杨 燕,郑荣生,张吴琼,刘 静
(蚌埠医学院第一附属医院肿瘤内科,安徽 蚌埠 233004)
消化道肿瘤是人类面临的重大难题,原发性肝癌是消化系统肿瘤的重要构成,其中约90%为肝细胞癌(hepatocellular carcinoma,HCC)。HCC全球发病率及死亡率均居于前列,起病隐匿,初期症状不典型,一经发现多进展为中晚期,且增殖旺盛、侵袭迁移能力强,治疗手段有限,这些导致其预后极差,治疗现状不容乐观。因此,寻找HCC治疗的新靶点具有重要的临床价值及科学意义[1]。研究发现,HCC的发生发展和缝隙连接蛋白(connexin,Cx)功能异常有关[2]。Cx作为缝隙连接(gap junction,GJ)的结构蛋白,可以通过GJ依赖性和非GJ依赖性方式,对细胞的新陈代谢、内环境稳定、增殖和分化等生理过程起重要的调控作用[3]。Cx32 是人类肝脏中主要表达的Cx亚型蛋白,也是肝细胞GJ的主要组分[2]。一般认为Cx32为肿瘤抑制基因[4],肝细胞的癌变过程伴随有Cx32的减少或缺失[5];而向HCC细胞过表达Cx32,肿瘤细胞生长、增殖和转移能力呈负性调控[6]。但研究同时发现,Cx32在细胞质的异位蓄积也会促进HCC的进展[7]。此外,近年来也有资料显示,Cx在某些情况下可能有利于肿瘤的进展[3]。可见Cx32与HCC生物学行为之间的关系及分子机制尚需进一步阐明。本研究通过构建LV5-hCx32慢病毒载体,并将其导入人肝癌Huh7细胞系,建立稳定过表达Cx32的Huh7细胞株,不仅为进一步研究Cx32及其组成的GJ在HCC中的生物学功能提供有力的工具,也将为基于Cx的靶点药物研究奠定实验基础。
1 材料与方法
1.1材料大肠杆菌TOP10、人胚肾293T细胞及人肝癌细胞Huh7由本实验室保存;LV5-GFP及包装质粒(pGag /Pol、pRev、pVSV-G)购自苏州吉玛基因股份有限公司;NotⅠ、Bam HⅠ、T4 DNA连接酶及DNA marker购于Fermentas公司;DNA凝胶回收试剂盒、质粒提取试剂盒、普通DNA产物回收试剂盒均购自天根生化科技有限公司;TRIzol、Lipofectamine 2000、Opti-MEM、DAPI及钙黄绿素(calcein-AM)购于Invitrogen公司;Cx32、GAPDH引物由苏州吉玛基因股份有限公司合成;逆转录试剂盒及PCR所用酶、buffer、dNTP等均购于Promega公司;DMEM干粉、胎牛血清及胰蛋白酶购自Gibco公司;无水乙醇、异丙醇、溴化乙锭、Polybrene、嘌呤霉素、MTT、结晶紫及鼠抗人Cx32抗体购于Sigma公司;鼠抗人β-actin单克隆抗体、HRP及FITC标记的二抗购自Amersham公司;BSA蛋白定量试剂盒及丙烯酰胺/甲叉双丙烯酰胺均为Bio-Rad公司产品;ECL-plus化学发光试剂盒购自Millipore公司。
1.2方法
1.2.1目的基因片段的获取和扩增 参照GenBank中人Cx32 mRNA的CDS全长序列(NM_001097642.2),利用全基因合成方法获得基因片段,由苏州吉玛基因股份有限公司合成,并在目的基因上、下游引物分别加上NotⅠ和Bam HⅠ及保护碱基,以此为模板进行PCR扩增。反应条件为:95℃ 预变性3 min,94℃ 变性30 s,55℃退火30 s,72℃延伸30 s,30 个循环;最后72℃延伸5 min,扩增片段经琼脂糖凝胶电泳并切胶回收。
1.2.2LV5-GFP-hCx32重组质粒构建扩增和鉴定 使用NotⅠ和Bam HⅠ分别双酶切目的基因hCx32及LV5空载体,DNA连接酶在连接缓冲液中22℃连接2 h。连接后的重组质粒转化大肠杆菌感受态细胞TOP10,收集转化后的菌液,涂布在含50 mg·L-1氨苄青霉素的LB培养皿上,37℃倒置培养12~16 h,挑取阳性菌落,扩增进行质粒酶切鉴定,小量抽提质粒,送苏州吉码基因股份有限公司测序鉴定,获取重组质粒LV5-hCx32。
1.2.3重组慢病毒及阴性对照慢病毒的包装和浓缩 转染前24 h,将生长状态良好的293T细胞胰酶消化,重悬接种于15 cm培养皿中,待细胞密度达到50%时,将重组慢病毒质粒LV5-hCx32和包装质粒经Lipofectamine 2000共转染至293T细胞中,用无血清DMEM培养基培养6 h后,换成含10% FBS的DMEM培养基培养。72 h后收集病毒上清液,4℃、4 000 r·min-1离心4 min;低速离心后,用0.45 μm过滤器过滤,滤液经4℃、20 000 r·min-1超速离心2 h,收集浓缩液-80℃保存。重组慢病毒颗粒命名为LV5-GFP-hCx32,用上述相同方法获得阴性对照LV5-NC慢病毒颗粒。
1.2.4病毒滴度测定 293T细胞培养至80%~90%融合,胰酶消化重悬细胞,按每孔0.5×105~1×105的密度接种至96孔板,每孔体积100 μL,培养24 h。取慢病毒原液10~20 μL,用10% FBS的DMEM 培养液10倍稀释3~5个梯度,吸去96孔板中的培养液,每孔加入500 μL稀释的病毒液,同时设立空白对照组,于37℃、5% CO2培养24 h;吸弃96 孔板中的稀释病毒液,每孔加入 1 mL 10% FBS的DMEM培养液,37℃、5% CO2继续培养 24 h。通过荧光显微镜计数荧光细胞,结合稀释倍数计算病毒滴度。
1.2.5重组慢病毒及阴性对照慢病毒转染目的细胞Huh7 将对数生长期的Huh7细胞,以2.5×105/孔密度接种于24孔板,每孔0.5 mL,培养24 h后,细胞融合率达40%~60%,吸去细胞上清,加入培养基360 μL、40 μL不同梯度的病毒液(慢病毒原液达1011TU·L-1)及5 mg·L-1的Polybrene,每组3个复孔,以Lipofectamine 2000将质粒感染Huh7细胞,8~12 h后观察细胞状态,待细胞状态与未感染组无明显差异时,24 h后更换为新鲜培养基培养,72 h 后荧光显微镜下观察荧光表达情况,确认目的细胞的感染方法和感染参数。
1.2.6嘌呤霉素筛选浓度的确定 取对数生长期的Huh7细胞,胰酶消化,计数板计数,以1.5×105/孔密度接种于24孔板,培养24 h,梯度加入嘌呤霉素,其浓度分别为0.25、0.5、0.75、1 mg·L-1,同时设置Blank孔,37℃、5% CO2培养箱培养,筛选7 d 后,观察每孔细胞死亡情况,将杀死全部细胞的最小浓度确定为稳定转染细胞株的筛选浓度。
1.2.7稳定转染细胞株Huh7的筛选及建立 Huh7细胞经脂质体瞬时转染24 h后消化传代,以10个/cm2接种至10 cm培养皿,继续培养24 h 后,更换为含上述确定的筛选浓度的嘌呤霉素培养液进行筛选。10~20 d后,LV5-hCx32质粒组和LV5-NC阴性对照质粒组均可见抗性克隆形成,未转染组细胞全部死亡。以无菌克隆环挑取单细胞阳性克隆,消化传代并扩大培养,2~3周后可获得目标细胞系。
1.2.8qRT-PCR检测Cx32 mRNA表达 按照操作说明,使用TRIzol提取细胞总RNA并测定RNA浓度。以1 μg RNA为模板,按照RT-PCR逆转录试剂盒操作说明合成cDNA,以2 μL cDNA为模板,进行PCR反应。反应条件:95℃ 3 min预变性, 95℃ 30 s变性, 62℃ 40 s退火,72℃ 30 s延伸,40个循环;最后72℃延伸5 min。引物序列Cx32-F:5′-GCGTGAACCGGCATTCTA-3′,Cx32-R:5′-CCCTCAAGCCGTAGCATTT-3′ (产物大小295 bp);GAPDH-F:5′-CATGAGAAGTATGACAACAGCCT-3′,GAPDH-R:5′-AGTCCTTCCACGATACCAAAGT-3′(产物大小113 bp)。
1.2.9Western blot 检测Cx32蛋白表达 实验操作参照既往文献[8]进行。每孔上样蛋白量50 μg,Cx32一抗(1 ∶500),置摇床4℃过夜;洗膜后加入HRP标记的羊抗小鼠二抗(1 ∶1 000),室温振摇2 h;洗膜后,用化学发光检测试剂盒(ECL)化学发光自显影,Quantity One 软件分析,以β-actin为内参照,蛋白表达强度以Cx32蛋白表达灰度值与β-actin灰度值的比值计算。
1.2.10免疫荧光法检测Cx32蛋白定位 实验步骤参照本实验室既往研究[8]。其中Cx32一抗工作浓度1 ∶200(以2% BSA稀释),FITC标记的二抗工作浓度1 ∶200(以2% BSA稀释)。DAPI染核5 min,95%甘油封片剂封闭,倒置荧光显微镜下观察拍照。
1.2.11细胞接种荧光示踪法测定Huh7细胞间GJ功能 使用本领域之前报道的方法测定GJ功能[8-9]。具体原理包括“供体细胞”和“受体细胞”,其中“供体细胞”经过荧光指示剂calcein-AM预处理30 min,该荧光染料能被胞内脂酶水解而形成发绿色荧光的calcein,calcein分子质量足够小,能经GJ传递至邻近细胞。以1 ∶200的比例将“供体细胞”接种到已生长融合的Huh7“受体细胞”上。培养4 h,待“供体细胞”与“受体细胞”间形成稳定的GJ后,在倒置荧光显微镜下,计数一个“供体细胞”周围含有绿色荧光的“受体细胞”的数目,作为GJ功能指标。
1.2.12MTT法检测细胞增殖能力 将经过不同处理的Huh7细胞接种于96 孔板中,培养相应时间,每孔加入MTT(5 g·L-1)20 μL,避光温育4 h。终止培养,弃上清,每孔加150 μL DMSO,振荡10 min,使结晶物充分溶解,用酶标仪在490 nm 波长处测定OD值。
1.2.13克隆形成实验 取对数生长期的各组细胞,用胰蛋白酶消化后,制备成单细胞悬液,计数,以500个/孔的密度接种于6孔板,置37℃、5% CO2及饱和湿度环境下培养10~14 d。多聚甲醛固定细胞,结晶紫染色10 min,清洗干燥后计数克隆,并进行拍照。实验设置3 孔并重复3 次。

2 结果
2.1LV5-GFP-hCx32慢病毒载体的鉴定质粒酶切鉴定结果显示,扩增出大小为852 bp 的Cx32 基因片段,和大小为9 337 bp 的LV5基因片段(Fig 1A)。测序结果证实,所获得的表达质粒目的片段与预期完全相符(Fig 1B)。表明LV5-hCx32慢病毒表达载体构建成功。
2.2慢病毒的包装和滴度测定将慢病毒包装三质粒系统的DNA转染293T细胞,培养72 h后,倒置显微镜下观察,可见GFP绿色荧光,表明慢病毒包装成功。根据病毒滴度计算公式,计算出浓缩后LV5-hCx32及LV5-NC慢病毒滴度约为3×1011TU·L-1,能够满足实验对病毒液滴度的要求。
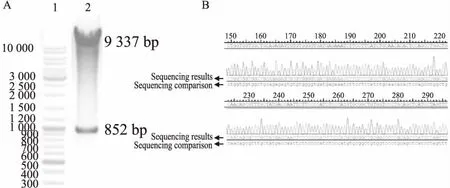
Fig 1 Identification of recombinant lentiviral plasmid
A: The result of enzyme digestion. 1: Marker; 2: Enzyme-digested product of the recombinant plasmid LV5-hCx32 (NotⅠ/ Bam HⅠ); B: Partial sequence diagram of LV5-GFP-hCx32 and the NCBI database matching results.
2.3LV5-GFP-hCx32载体及对照载体感染Huh7细胞的效率将成功包装的重组慢病毒载体(LV5-GFP-hCx32)和阴性对照载体(LV5-GFP-NC)感染Huh7细胞,72 h通过荧光显微镜观察细胞感染效率。预实验结果表明,当慢病毒的滴度达到3×1011TU·L-1,按1 ∶10稀释感染,细胞感染效率达到80%左右(Fig 2),因此,选择将病毒液以MOI 20感染靶细胞。
2.4LV5-GFP-hCx32载体及对照载体瞬时感染Huh7细胞后Cx32的表达qRT-PCR结果显示,与未转染组相比, LV5-NC瞬时感染组Cx32 mRNA表达无明显变化,但LV5-hCx32瞬时感染组Cx32 mRNA表达是其214.4 倍(Fig 3A)。同时,Western blot检测结果也显示,LV5-NC空质粒和LV5-hCx32质粒瞬时转染组的细胞内均有Cx32 蛋白表达,但LV5-hCx32质粒转染组Cx32蛋白表达明显高于空质粒转染组,约为空质粒组的13.3倍(Fig 3B)。
2.5显微镜下观察确定嘌呤霉素筛选药物浓度经不同浓度嘌呤霉素筛选7 d 后,在显微镜下观察细胞的死亡情况,发现0.75 mg·L-1以及更高浓度的嘌呤霉素可将细胞全部杀死,最终确定嘌呤霉素筛选浓度为0.75 mg·L-1(Fig 4)。
2.6稳定过表达hCx32的Huh7细胞系的建立向感染LV5-NC和LV5-hCx32慢病毒的Huh7细胞中加入0.75 mg·L-1的嘌呤霉素进行不断筛选,阳性细胞克隆在20余次传代后全部稳定存活,GFP表达情况如Fig 5所示。
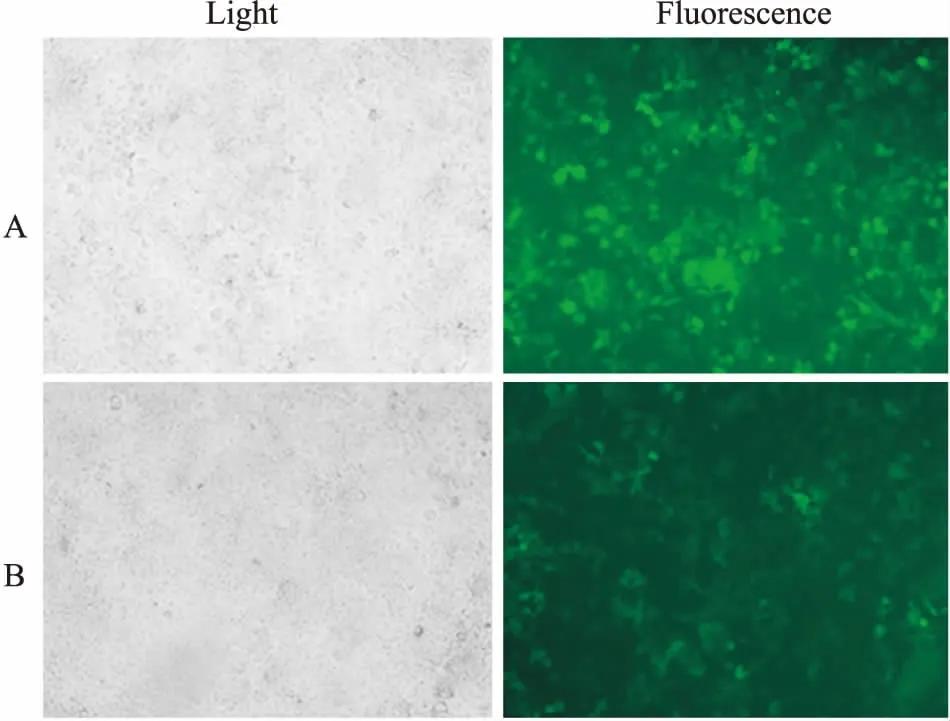
Fig 2 Transient transfection of Huh7 cells with LV5-GFP-hCx32recombinant lentiviral plasmid (×100)
A: Transfection of 3×1011TU·L-1lentivirus diluted at 1 ∶10 with 72 h; B: Transfection of 3×1011TU·L-1lentivirus diluted at 1 ∶50 with 72 h.
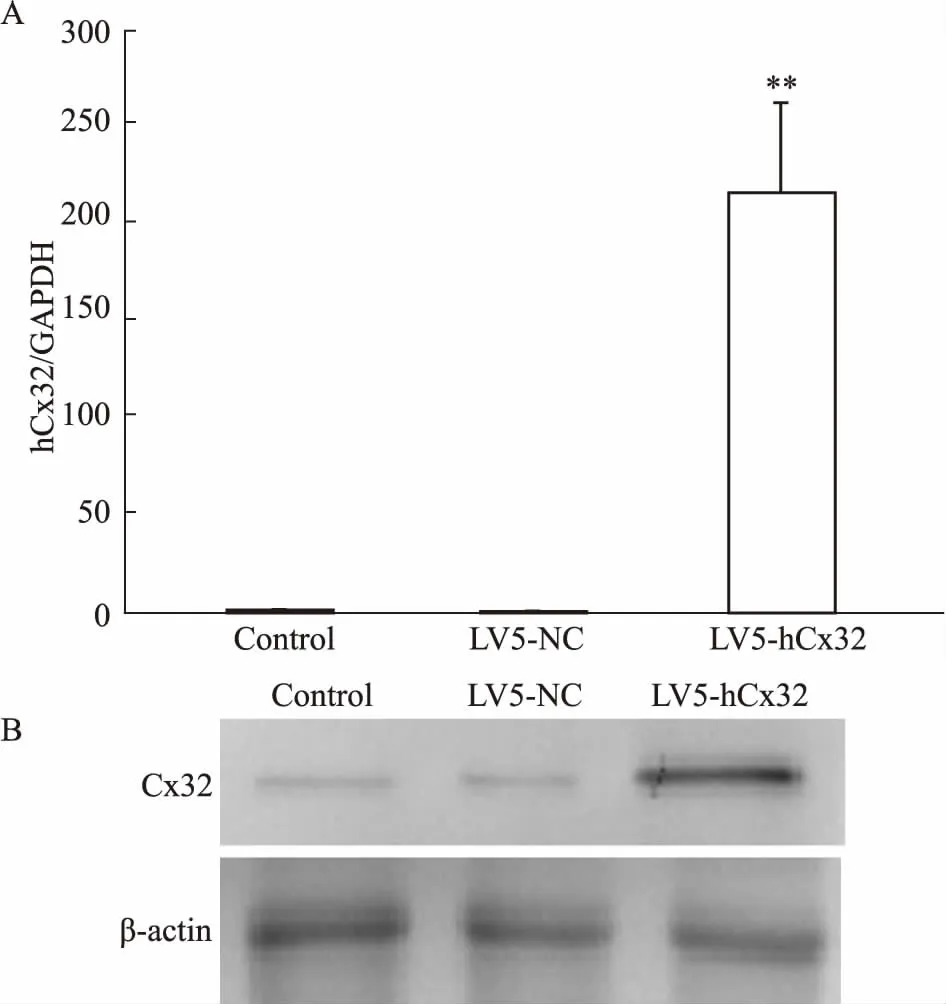
Fig 3 Expression of Cx32 in Huh7 cells after transienttransfection with LV5-hCx32 and LV5-NC plasmid (n=3)
A: qRT-PCR was used to detect the mRNA level of Cx32; B: Western blot was used to measure the protein expression of Cx32.**P<0.01vscontrol or LV5-NC.
2.7稳定细胞株中Cx32的表达、定位及GJ形成qRT-PCR和Western blot检测结果显示,与LV5-NC稳定转染Huh7对照细胞相比,LV5-hCx32稳定转染细胞Cx32 mRNA和蛋白表达水平均明显增加,分别是对照组的72.5倍和9.3倍(Fig 6A、6B)。免疫荧光实验进一步表明,该细胞内Cx32弥散分布于细胞质中,仅有少量呈细颗粒状定位于细胞膜上;LV5-hCx32组细胞Cx32荧光量明显增强,且增加的Cx32有定位于细胞膜上的潜力(Fig 6C),形成GJ的能力增强(Fig 6D),表明稳定高表达hCx32的Huh7细胞模型构建成功。
Fig 4 The Huh7 cells after selection with differentconcentrations of puromycin for 7 days (×100)
A: Puromycin 0.25 mg·L-1; B: Puromycin 0.5 mg·L-1; C: Puromycin 0.75 mg·L-1; D: Puromycin 1.0 mg·L-1
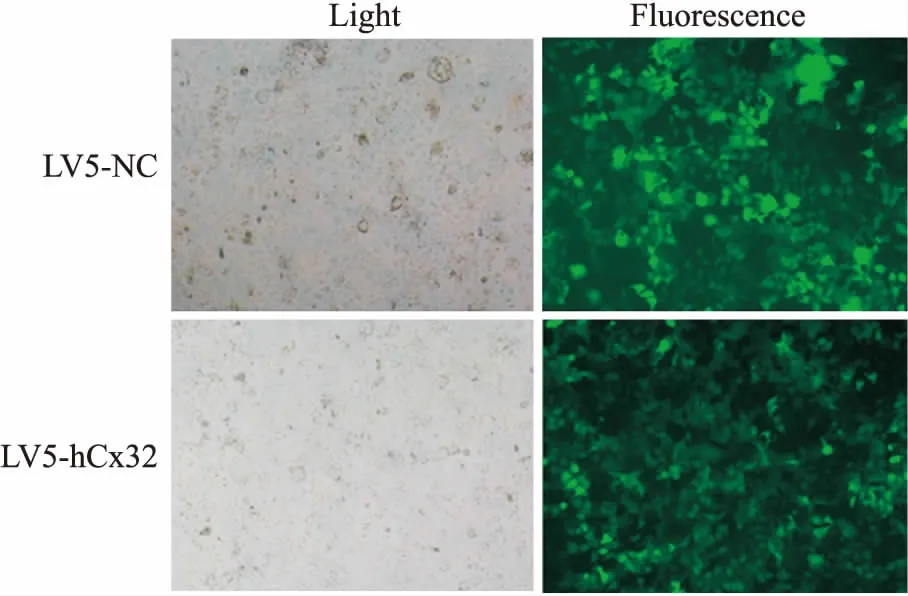
Fig 5 Stable transfection of Huh7 cells with LV5-GFP-hCx32and LV5-GFP-NC recombinant lentiviral plasmids (×100)
2.8稳定高表达Cx32对Huh7细胞增殖的影响MTT结果表明,LV5-NC对照组与空白组细胞的增殖能力在各时间段均无明显差异,而LV5-hCx32组细胞的增殖能力明显减弱(Fig 7A)。同样的结果在克隆形成实验中也得到证实(Fig 7B)。表明稳定高表达Cx32对肝癌Huh7细胞的增殖能力有抑制作用。
3 讨论
恶性肿瘤是威胁人类健康的头号杀手,随着肿瘤研究的不断深入,人们开始从分子生物学角度去审视其发生机制。基因的突变、组织细胞的逆分化、免疫监视的缺失等导致细胞出现失控性、异质性增长,进而引发一系列恶果。靶向治疗则是在细胞分子水平,针对已经明确的致癌位点,设计的识别和攻击肿瘤细胞的新兴治疗手段,其高效、特异、低毒等特点彻底颠覆了传统的治疗模式,开启了肿瘤治疗的新篇章。HCC是一种具有高侵袭转移能力的恶性肿瘤,其发病率在全球范围内呈逐年上升趋势。索拉非尼作为晚期HCC的一线治疗方案并没有取得令人满意的疗效[10],而其他靶向药物在临床试验阶段均遭遇失败[11]。因此,探索HCC发生发展机制,寻找HCC治疗的新靶点迫在眉睫。
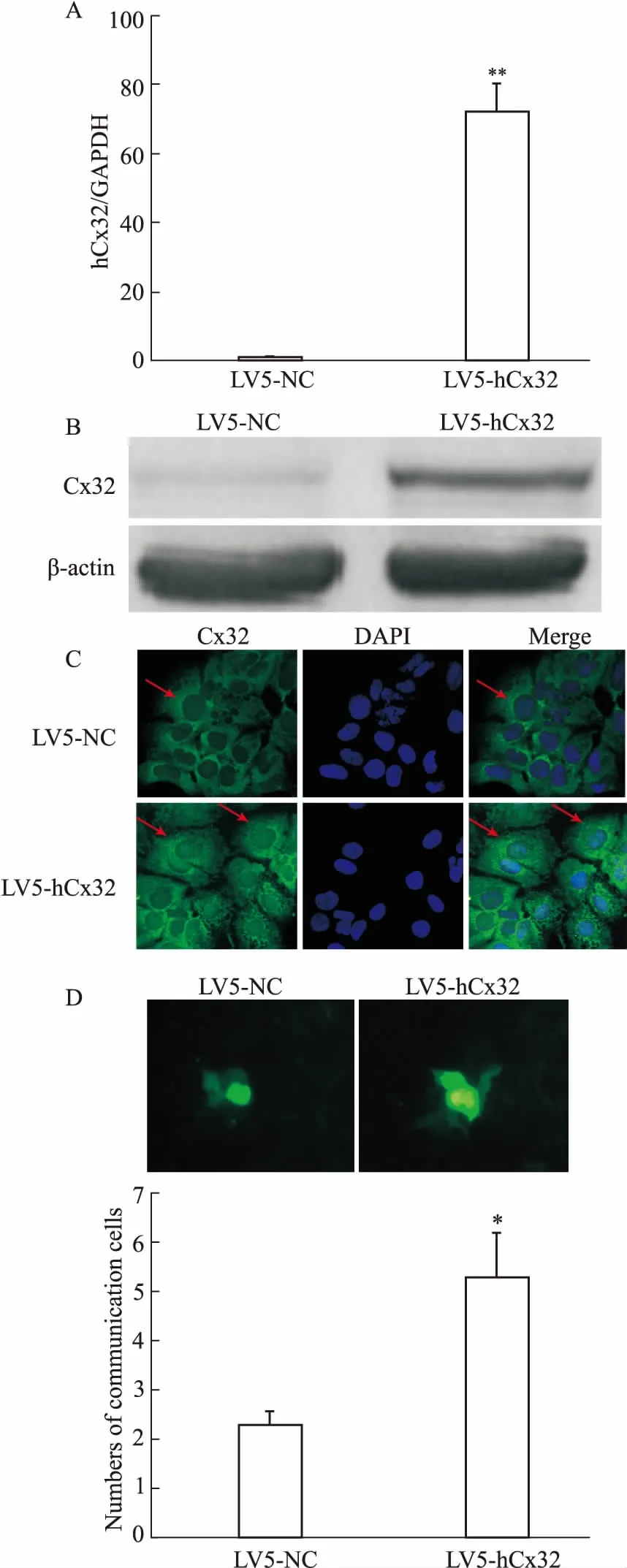
Fig 6 Cx32 expression, localization and GJ statusin Huh7 cells after stable transfection withLV5-hCx32 and LV5-NC plasmid (n=3)
A: qRT-PCR was used to detect the mRNA level of Cx32; B: Western blot was used to measure the protein expression of Cx32; C: Immunofluorescent staining showed diffuse cytoplasmic but only a partial membranous Cx32 expression (marked by red arrow) in Huh7 cells, and more membranous localization of Cx32 was observed by Cx32 transfection (marked by red arrow) (×400); D: Fluorescence images showed an enhanced dye coupling (GJ activity) between adjacent Huh7 cells (×200).*P<0.05,**P<0.01vsLV5-NC.
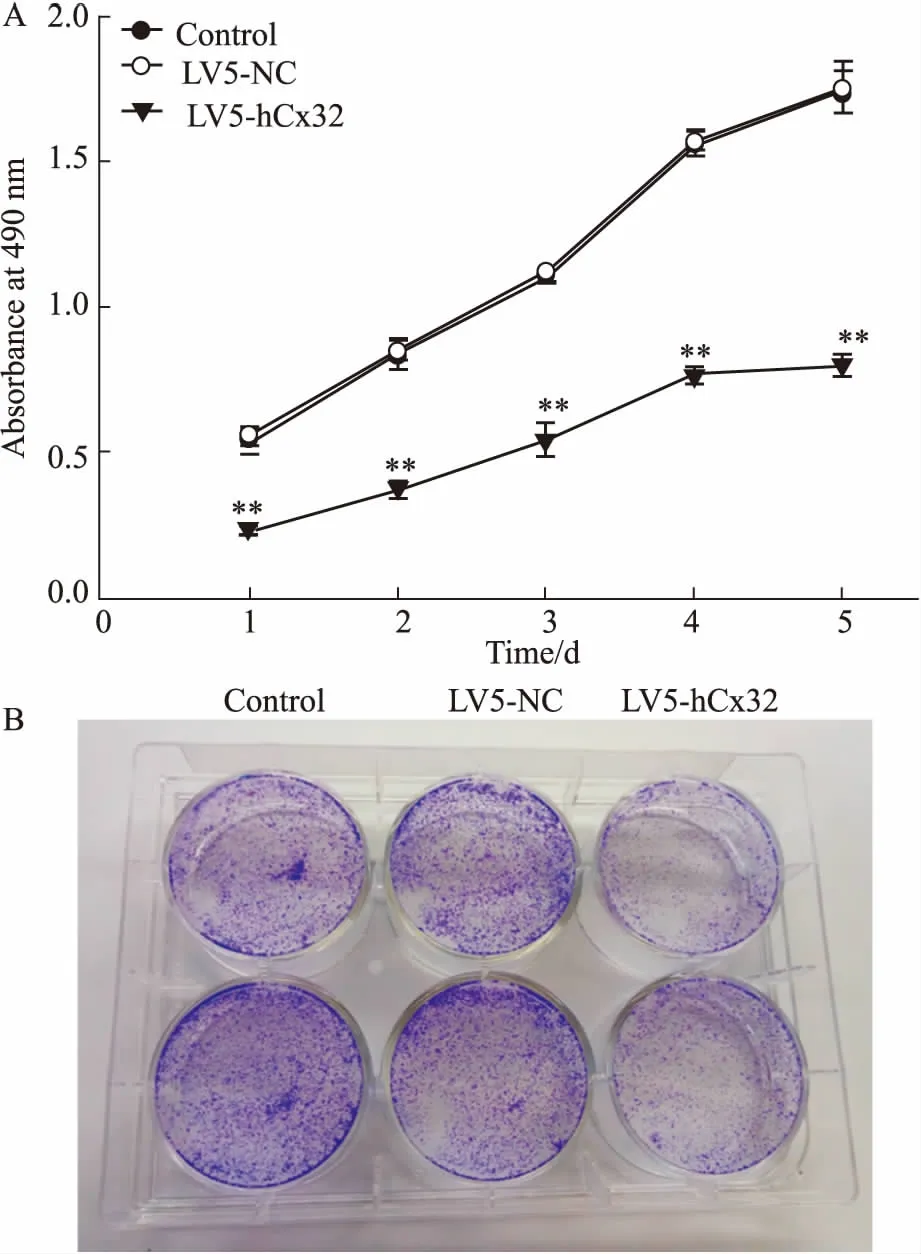
Fig 7 Effect of overexpressed Cx32 oncell proliferation in Huh7 cells (n=3)
A: MTT assay was used to detect the absorbance at 490 nm; B: Colony formation assay was used to determine the cellular proliferation capacity.**P<0.01vscontrol or LV5-NC.
GJ是位于两个相邻细胞之间的一种蛋白质连接通道,通过直接介导细胞之间的物质转运及信号转导,参与调节细胞的生长、分化及凋亡。Cx32是肝脏GJ的主要组成蛋白[2],与其他Cx(如Cx26、Cx43等)协同完成肝细胞间一系列生理过程。肝脏中Cx结构功能的变化,可能会导致GJ通道通透性和对通透物质选择性的改变,进而影响细胞间的物质交换和信号传递,最终导致细胞功能异常。如Cx32基因缺陷小鼠易受到物理辐射及化学毒物损伤,引发肝脏恶性肿瘤的发生[12];正常肝细胞向HCC的演变过程中伴随Cx32表达量的下调及GJ功能的失调[5];而体外向HCC细胞转染Cx32上调GJ则能抑制癌细胞增殖和克隆形成[6]。Cx32参与调控HCC机制可能为有功能的Cx32表达数量减少,不能形成有效的GJ通道,导致恶性启动细胞失去周围正常细胞对其的调控,细胞失控性增长,引发肿瘤并不断进展。然而,Cx及其构成的GJ作为肿瘤抑制基因的传统理念受到了挑战[3]。有研究发现,Cx通过增加血管侵袭力,促进乳腺癌及恶性黑色素瘤脑转移的发生[13];其在肿瘤患者淋巴结转移灶中高表达,并与不良预后有关[14-15]。研究还显示,Cx32在HCC细胞质中的异位蓄积能够加强肿瘤细胞自我更新,从而加剧其恶性生物学行为[7]。由此可见,在Cx32与HCC纷杂的关系网络中,二者之间的联系以及关联机制尚需进一步研究。
GJ特异性工具药物的缺乏,是阻碍当前GJ研究及其与HCC治疗相关性认识的主要障碍。因此,建立一种可特异性调控Cx32及其组成GJ的HCC细胞模型,对于阐明Cx32在HCC发生发展中的作用及机制尤为必要。慢病毒以其高效地转染各个分裂时相细胞、特异地调控目的基因表达水平等特点,被广泛应用于基因功能鉴定及分子生物学研究领域,并在脑、肺、肝及造血干细胞等疾病的潜在靶点研究中扮演重要的角色,已成为人类基因治疗的有效工具。本研究将PCR扩增所得Cx32基因片段重组至LV5-GFP载体,经过酶切、连接及测序验证,转染293T细胞进行病毒包装,成功获得病毒滴度为3×1011TU·L-1的重组慢病毒LV5-GFP-hCx32,感染Huh7细胞,并经嘌呤霉素筛选出细胞阳性克隆,分子生物学方法证实该细胞亚系Cx32稳定高表达,高表达的Cx32大部分分布于细胞质,小部分定位于细胞膜,这些定位于细胞膜的Cx32蛋白有形成GJ的能力。Cx32特异性过表达对Huh7细胞生长及增殖能力有明显的抑制作用,与既往的报道结果较为一致[6],其机制不排除GJ依赖性和非GJ依赖性的综合作用。研究结果综合表明稳定过表达Cx32的人肝癌Huh7细胞系被成功构建。
综上所述,充分理解Cx32及其组成GJ参与HCC的分子机制是未来HCC靶向药物研发的新视角,建立稳定调控Cx32的细胞模型是研究最为理想的手段之一。本研究通过LV5慢病毒表达载体,成功构建了稳定过表达Cx32的Huh7细胞模型,且过表达的Cx32蛋白可以明显抑制Huh7细胞的增殖能力。该工具细胞将为后续揭示Cx32在HCC中的生物学效应提供有力的实验手段,也为发展以GJ为靶点的新型药物提供线索和依据。
[1] 夏丽洁, 张富春. 肝癌治疗新靶点GPC3研究进展[J]. 中国药理学通报, 2016,32(11): 1486-9.
[1] Xia L J, Zhang F C. Research progress of a new therapeutic target in hepatocellular carcinoma glypican-3[J].ChinPharmacolBull, 2016,32(11): 1486-9.
[2] Vinken M, De Kock J, Oliveira A G, et al. Modifications in connexin expression in liver development and cancer[J].CellCommunAdhes, 2012,19(3-4): 55-62.
[3] Naus C C, Laird D W. Implications and challenges of connexin connections to cancer[J].NatRevCancer, 2010,10(6): 435-41.
[4] Fujimoto E, Sato H, Shirai S, et al. Connexin32 as a tumor suppressor gene in a metastatic renal cell carcinoma cell line[J].Oncogene, 2005,24(22): 3684-90.
[5] Nakashima Y, Ono T, Yamanoi A, et al. Expression of gap junction protein connexin32 in chronic hepatitis, liver cirrhosis, and hepatocellular carcinoma[J].JGastroenterol, 2004,39(8): 763-8.
[6] Zhao B, Zhao W, Wang Y, et al. Connexin32 regulates hepatoma cell metastasis and proliferation via the p53 and Akt pathways[J].Oncotarget, 2015,6(12): 10116-33.
[7] Kawasaki Y, Omori Y, Li Q, et al. Cytoplasmic accumulation of connexin32 expands cancer stem cell population in human HuH7 hepatoma cells by enhancing its self-renewal[J].IntJCancer, 2011,128(1): 51-62.
[8] 杨 燕, 李玉梅, 张 娜, 等. 缝隙连接蛋白26在肝细胞癌组织的表达及意义[J]. 浙江大学学报, 2015,44(5): 517-24.
[8] Yang Y, Li Y M, Zhang N, et al. Expression of gap junction protein connexin26 in human hepatocellular carcinoma and its significance[J].JZhejiangUniv(MedSci), 2015,44(5): 517-24.
[9] 阳 洁, 覃贵慧, 陈军泽. 慢病毒靶向干扰Cx26抑制人高转移性肝癌HCCLM3细胞增殖及迁移[J]. 中国药理学通报, 2014,30(7): 937-41.
[9] Yang J, Qin G H, Chen J Z. Inhibitory effect of lentivirus targeting interference Cx26 on proliferation and migration of human highly metastatic hepatocellular carcinoma HCCLM3 cells[J].ChinPharmacolBull, 2014,30(7): 937-41.
[10] Llovet J M, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma[J].NEnglJMed, 2008,359(4): 378-90.
[11] Llovet J M, Hernandez-Gea V. Hepatocellular carcinoma: reasons for phase III failure and novel perspectives on trial design[J].ClinCancerRes, 2014,20(8): 2072-9.
[12] Igarashi I, Makino T, Suzuki Y, et al. Background lesions during a 24-month observation period in connexin 32-deficient mice[J].JVetMedSci, 2013,75(2): 207-10.
[13] Stoletov K, Strnadel J, Zardouzian E, et al. Role of connexins in metastatic breast cancer and melanoma brain colonization[J].JCellSci, 2013,126(Pt 4): 904-13.
[14] Ito A, Koma Y, Uchino K, et al. Increased expression of connexin 26 in the invasive component of lung squamous cell carcinoma: significant correlation with poor prognosis[J].CancerLett, 2006,234(2): 239-48.
[15] Kanczuga-Koda L, Sulkowska M, Koda M, et al. Increased expression of gap junction protein-connexin 32 in lymph node metastases of human ductal breast cancer[J].FoliaHistochemCytobiol, 2007,45(Suppl 1): S175-80.