Calpain抑制剂ALLN对H2 O2 诱导的661W细胞损害的影响
2018-01-24方丽君林颖彬黄天文
方丽君,林颖彬,黄 恩,黄天文,4
(1. 福建医科大学附属协和医院眼科,福建 福州 350001;2. 福建省老年医学研究所,福建 福州 350001;3. 加拿大渥太华大学医学院细胞分子医学系,渥太华 K1H 8M5;4. 福建医科大学附属协和医院神经内科,福建 福州 350001)
视网膜色素变性(retinitis pigmentosa, RP)是最常见的严重威胁视功能的疾病之一,以视网膜视杆细胞死亡/凋亡引起的夜盲和视野缩窄、最终累及视锥细胞而发生中心视力严重受损为特征。然而,视锥细胞继发损伤的病理机制仍然不是很清楚。丢失大量视杆细胞后,组织内氧水平的大大增高对视锥细胞产生氧化应激损伤,这一学说为大部分学者所接受[1]。因此,运用过氧化氢(H2O2)来干预视锥细胞系661W细胞可以模拟RP的病理生理改变,这为RP的研究提供了可靠的细胞模型。
大量研究发现,通过抗氧化治疗可保护神经元,但是其中机制并未完全阐明。N-乙酰基半胱氨酸(N-acetyl-L-cysteine, NAC) 是一种常见的抗氧化剂,具有神经保护功效[2-3]。我们前期研究发现,NAC可减轻神经元内细胞周期素依赖蛋白激酶5(cyclin-dependent kinase 5,CDK5)毒性作用,减轻神经元内Tau蛋白的过度磷酸化[3]。钙蛋白酶Calpain是CDK5 的上游调节蛋白,其异常激活是导致细胞损害的重要因素之一[4-5]。那么,在RP中,氧化应激损伤的视锥细胞中是否也可能存在Calpain的变化。661W光感细胞是一种可靠的体外研究视锥细胞的替代物,本实验以Calpain为研究对象,探讨H2O2对661W光感受器细胞活性的影响,然后检测661W光感受器细胞内Calpain 1和Calpain 2蛋白水平的变化,最后以Calpain抑制剂ALLN(N-acetyl-leu-leu-norleucinal)来干预,探讨ALLN对661W细胞活性的影响,以期为RP的治疗提供新思路。
1 材料
1.1细胞661W光感受器细胞购自上海奥陆生物有限公司 (细胞来源于美国俄克拉何马州大学)。
1.2试剂DMEM培养基、胎牛血清、青霉素G(0.1 IU·L-1)、链霉素(0.1 IU·L-1)、胰蛋白酶均购自Gibco公司;ALLN购自Calbiochem-Behring公司;Cell Proliferation Kit I (MTT)试剂盒购自Roche公司;Calpain 1(N-19)抗体和Calpain 2(N-19)抗体,购自Santa Cruz公司;β-actin鼠单克隆抗体购自NeoMarkers公司。
1.3仪器二氧化碳细胞培养箱(美国FormaScientific公司);CK40型倒置显微镜(日本Olympus公司);多功能酶标仪(美国Bio-Tek公司);电泳仪(美国Bio-Rad公司)。
2 方法
2.1661W细胞培养[6]661W细胞在含有10%胎牛血清、青霉素G(0.1 IU·L-1)和链霉素(0.1 IU·L-1)的高糖DMEM培养基中培养,置于37 ℃、含有95%空气和5% CO2的培养箱中,每3~4 d用胰蛋白酶消化传代1次。当细胞长到70%~80%,进行各种干预处理。
2.2实验分组①空白对照组:未给予干预处理。②H2O2处理组:仅给予不同浓度的H2O2处理,浓度为0、1、5、10、50、100、500、1 000 μmol·L-1,给予特定时间的H2O2孵育。③Calpain抑制剂ALLN组:先加入ALLN(25、50、100、200 μmol·L-1),再与H2O2共同孵育不同时间。④单纯的ALLN组:ALLN(25、50、100、200 μmol·L-1)孵育组。
2.3MTT检测661W细胞活性参考试剂盒说明书,d 1在96孔板中接种661W细胞,每孔2×103个,然后置于37 ℃、5%二氧化碳培养箱中;d 2加入不同浓度的ALLN和(或)H2O2,作用不同时间。经过不同处理后,加入MTT试剂(终浓度为0.5 g·L-1),在37 ℃、5%二氧化碳培养箱中避光孵育4 h;然后每孔加入试剂盒中的溶解液100 μL,在培养箱孵育过夜;最后在甲臜结晶完全溶解后,用酶标仪在570 nm波长处测定其光吸收值,同时设置空白对照组。
2.4Westernblot检测[7]接种在6孔板的661W细胞经过不同处理后,吸弃培养液,用冷的PBS清洗,加入细胞裂解液,冰上裂解20 min,4℃、14 000×g离心10 min,获取上清液,进行蛋白定量。SDS聚丙烯酰胺凝胶电泳进行分离,转膜,封闭液在室温下封闭,一抗4℃孵育过夜,抗兔或鼠IgG二抗(1 ∶1 000稀释)作用2 h,化学发光法显色,曝光。实验重复3次。

3 结果
3.1H2O2对661W光感受器细胞活性的影响分别用空白对照组(0 μmol·L-1)、H2O2(1、5、10、50、100、500、1 000 μmol·L-1)孵育661W细胞24 h,MTT试剂盒检测细胞活性。如Fig 1所示,661W细胞活性随着H2O2浓度的增加而呈下降趋势。0~10 μmol·L-1的H2O2孵育661W细胞24 h,细胞的活性无变化(P>0.05),当H2O2浓度升高至50 μmol·L-1,细胞的活性开始下降(P<0.01);当H2O2浓度升高至500 μmol·L-1,661W细胞基本死亡。其中,当H2O2浓度为100 μmol·L-1,细胞的活性降至50%左右(P<0.01)。
3.2H2O2对661W细胞中Calpain蛋白表达的影响根据H2O2对661W细胞活性的研究结果,我们选择100 μmol·L-1的H2O2作用于661W细胞,观察Calpain 1和Calpain 2蛋白在不同时间的表达变化。如Fig 2所示,Calpain 1和Calpain 2蛋白水平在12 h时,均有不同程度的增加,但是差异没有显著性(P>0.05);随着时间延长到18 h,Calpain 1和Calpain 2的蛋白水平继续升高,其中Calpain 2蛋白水平与空白对照组比较,差异有显著性(P<0.05);随着时间进一步推移到24 h,Calpain 1和Calpain 2的蛋白均升高到对照组的2~3倍,差别均具有统计学意义(P<0.05)。
3.3Calpain抑制剂ALLN对H2O2诱导的661W细胞活性损害的影响ALLN是Calpain的抑制剂,我们分别用0、25、50、100、200 μmol·L-1的ALLN作用于661W细胞,然后加入100 μmol·L-1的H2O2共同孵育24 h,MTT法检测661W细胞的活性。如Fig 3所示,与空白对照组相比,100 μmol·L-1的H2O2组中细胞活性明显下降(P<0.01),与Fig 1结果一致;与H2O2处理组比较,不同浓度的ALLN与H2O2共同孵育组中661W细胞的活性明显升高,且该升高趋势呈现ALLN剂量相关性。

Fig 1 H2O2 decreased survival rate of 661W cells(±s,n=6)
661W cells were treated for 24 h with different concentrations of H2O2. Then cell viability was detected by MTT assay. It dose-dependently decreased the viability of 661W cells.**P<0.01vscontrol group (0 μmol·L-1group).

Fig 2 H2O2 increased protein levels of Calpain 1 andCalpain 2 in 661W cells(±s,n=3)
Upon H2O2, 661W cells showed a time-dependent increase in the proteins of Calpain 1 and Calpain 2 as compared to cells treated without H2O2.*P<0.05vscontrol group without H2O2treatment.

Fig 3 ALLN attenuated damage induced by
The cells were treated with H2O2alone, or ALLN (25, 50, 100, 200 μmol·L-1) and H2O2(100 μmol·L-1). After 24 h of incubation, the viability of 661W cells was measured. Under the effect of ALLN, there was a dose-dependent increase in cell viability.**P<0.01vsgroup with H2O2treatment alone.
3.4ALLN对661W细胞活性的影响用不同浓度(0、25、50、100、200 μmol·L-1)的ALLN作用于661W细胞24 h,MTT法检测细胞活性。如Fig 4所示,与空白对照组相比,不同浓度的ALLN处理组中,细胞的活性并未发生改变(P>0.05)。提示ALLN在25~200 μmol·L-1浓度范围内对661W细胞没有毒性。
4 讨论
众所周知,视信息在视网膜内形成视觉神经冲动,由3个神经元传递,即光感受器细胞-双极细胞-神经节细胞。光感受器细胞是视网膜的第一级神经元,分为视杆细胞和视锥细胞。在RP中,光感受器细胞受到损害。尽管RP病人丧失了大部分视杆细胞,只要视锥细胞不损伤,RP病人在明亮的环境下,仍然可以维持相对正常的生活。因而,对继发的视锥细胞的损伤研究成为RP研究的热点和重点。目前普遍认为,视锥细胞氧化应激损伤参与了RP的病理生理改变[8]。所以本研究选用H2O2作为致损害的因素。另外,因为661W细胞是从SV40 T-抗原转基因鼠视网膜上分离得到的,既能在体外增殖,又能表达感光细胞特异性蛋白,是一种可靠的体外研究视锥细胞的替代物。所以,我们以H2O2作用于视锥系661W光感受器细胞制备视锥细胞氧化损伤细胞模型[9-10],然后探讨RP可能的病理生理改变。
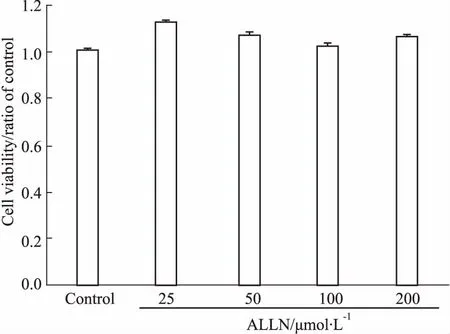
Fig 4 ALLN at concentration of 0~200 μmol·L-1 for24 h was safe for 661W cells(±s ,n=6)
661W cells were treated with ALLN at the concentrations from 0 to 200 μmol·L-1for 24 h. Then the cell viability was detected with MTT method. No significant change was shown between any groups.
本研究发现,在661W细胞中加入不同浓度的H2O2孵育24 h,细胞的活性随着H2O2浓度(尤其在10~500 μmol·L-1)的升高而明显下降。提示H2O2对661W细胞具有毒性损害作用,也说明成功制备了氧化损伤病理改变的细胞模型。根据661W细胞活性的变化,我们选择细胞活性降至50%左右时的H2O2浓度做为进一步研究的药物浓度。在本研究中,100 μmol·L-1H2O2作用于661W细胞24 h后,细胞存活率降至50%左右。因此,我们选择100 μmol·L-1H2O2作为后续研究的浓度。
另外,我们的前期研究发现,钙依赖的蛋白酶Calpain参与氧化损伤的病理过程。在细胞氧化损伤过程中,细胞的线粒体功能受到损害,导致ATP产生减少、细胞内钙超负荷等病理改变,最终导致Calpain活性的增加[2]。氧化应激也可能通过其他途径来提高Calpain活性,我们也正在进行有关的探索性研究。Calpain是细胞质中主要的钙依赖的蛋白水解酶,参与多种病理生理过程。根据Calpain活化需要钙浓度不同,把Calpain分为μ-Calpain(微摩尔级)和m-Calpain(毫摩尔级),μ-Calpain也称为Calpain 1,m-Calpain又称为Calpain 2。为了进一步研究Calpain是否参与H2O2对661W细胞毒性损害的作用,我们检测了Calpain 1和Calpain 2的蛋白水平。研究发现,在100 μmol·L-1H2O2作用12、18、24 h,Calpain 1和Calpain 2表达呈时间依赖性增高,尤其在24 h时,与空白对照组比较,Calpain 1和Calpain 2水平皆明显升高。说明Calpain参与661W细胞的氧化损伤过程。因此,如能抑制Calpain的活性,就可以保护661W细胞,所以我们选择Calpain的抑制剂ALLN来验证我们的假说。
结合相关文献,我们选择25~200 μmol·L-1的ALLN作用661W细胞,同时加入100 μmol·L-1的H2O2共同作用24 h。结果显示,ALLN具有不同程度的保护作用,并且保护作用随着ALLN浓度的增加有增强的趋势。另外,通过检测ALLN对661W细胞的影响,未发现ALLN有降低细胞活性的毒性作用。这些结果提示,在661W细胞的氧化损伤中,Calpain参与其中的损害过程,Calpain的抑制剂ALLN对损害具有保护作用。虽然这些研究是在661W细胞系中进行,但这为我们进一步在体内研究RP等视网膜疾病的动物模型奠定了必要的基础。
综上所述,H2O2可升高661W细胞的Calpain蛋白水平,对661W细胞具有毒性损害作用;而抑制Calpain的ALLN可以降低H2O2对661W细胞的毒性损害。提示Calpain蛋白参与H2O2对661W光感受器细胞的毒性损害,ALLN对氧化损伤的光感受器细胞具有保护作用,为研究RP等与光感受器细胞氧化损伤相关的视网膜疾病的发病机制及药物调控提供了实验依据。
(致谢:本实验在福建医科大学附属协和医院福建省老年医学研究所完成,感谢陈晓春教授对本课题的指导和支持!)
[1] Hartong D T, Berson E L, Dryja T P. Retinitis pigmentosa[J].Lancet, 2006,368(9549):1795-809.
[2] 黄天文, 林智颖, 陈晓春. N-乙酰基半胱氨酸对Aβ25-35活化calpain活性的影响及可能机制[J].中国药理学通报, 2015,31(11) :1505-9.
[2] Huang T W, Lin Z Y, Chen X C. Possible effect of N-acetyl-L-cysteine on Aβ25-35-induced increase of calpain activity[J].ChinPharmacolBull, 2015,31(11): 1505-9.
[3] 黄天文, 何饶丽, 周 梦,等. N-乙酰半胱氨酸对Aβ25-35诱导tau蛋白过度磷酸化的影响[J]. 中华医学杂志, 2015,95(33) :2701-4.
[3] Huang T W, He R L, Zhou M, et al. Possible effect of N-acetyl-L-cysteine on Aβ25-35-induced tau hyperphosphorylation[J].NatlMedJChina, 2015,95(33):2701-4.
[4] Chen X C, Huang T W, Zhang J, et al. Involvement of calpain and p25 of CDK5 pathway in ginsenoside Rb1’s attenuation of beta-amyloid peptide 25-35-induced tau hyperphosphorylation in cortical neurons[J].BrainRes, 2008,1200: 99-106.
[5] Zhou M, Huang T W, Collins N, et al. APOE4 induces site-specific tau phosphorylation through calpain-CDK5 signaling pathway in EFAD-Tg mice[J].CurrAlzheimerRes, 2016,13(9):1048-55.
[6] Shelby S J, Angadi P S, Zheng Q D, et al. Hypoxia inducible factor 1α contributes to regulation of autophagy in retinal detachment[J].ExpEyeRes, 2015,137:84-93.
[7] Huang T W, Fang L J, Lin Z Y, et al. Increase of p25 associated with cortical neuronal death induced by hypoxia[J].BiochemBiophysResCommun, 2016,477(4):932-6.
[8] Tanito M, Kwon Y W, Kondo N, et al. Cytoprotective effects of geranylgeranylacetone against retinal photooxidative damage[J].JNeurosci, 2005,25(9):2396-404.
[9] Mackey A M, Sanvicens N, Groeger G, et al. Redox survival signalling in retina-derived 661W cells[J].CellDeathDiffer, 2008,15(8):1291-303.
[10] Chen H, Tran J T, Anderson R E, et al. Caffeic acid phenethyl ester protects 661W cells from H2O2-mediated cell death and enhances electroretinography response in dim-reared albino rats[J].MolVis, 2012,18:1325-38.