灯盏花乙素对J774A.1巨噬细胞中ATP诱导的炎症小体活化和细胞焦亡的影响
2018-01-24景艳芸李陈广徐丽慧白文静欧阳东云何贤辉
景艳芸,李陈广,颜 亮,徐丽慧,白文静,欧阳东云,何贤辉
(暨南大学生命科学技术学院 1. 免疫生物学系、2. 细胞生物学系,广东 广州 510632)
炎症小体是存在于免疫细胞中的多亚基蛋白质复合体,可以感应入侵的病原体或损伤组织释放的危险信号,在协助机体抵御病原体感染和组织损伤中发挥重要作用[1-2]。NLRP3(NOD-like receptor family,pyrin domain-containing 3)炎症小体是目前研究最广泛的炎症小体之一,其活化一般需要两个信号,第一信号是病原体相关分子模式(pathogen-associated molecular pattern,PAMP),如脂多糖(lipopolysaccharide, LPS)被细胞膜模式识别受体(pattern recognition receptor,PRR)识别并结合,激活NF-κB信号通路,诱导NLRP3、白细胞介素-1β前体(pro-interleukin-1β,pro-IL-1β)等炎症性相关蛋白的表达;第二信号是损伤相关分子模式 (danger-associated molecular pattern,DAMP)如三磷酸腺苷(ATP)等激活NLRP3,通过接头蛋白ASC(apoptosis-associated speck-like protein containing a CARD),募集半胱天冬氨酸蛋白酶-1前体(pro-cysteinyl aspartate specific protease-1,pro-caspase-1),进而自我催化加工形成活化的caspase-1;活化的caspase-1切割pro-IL-1β形成成熟的IL-1β并分泌至细胞外,引起炎症反应[1, 3]。炎症小体活化会诱导细胞发生炎症性死亡——细胞焦亡(pyroptosis)。细胞焦亡是近年来新发现的一种不同于细胞凋亡与细胞坏死的新型细胞死亡方式,它依赖于caspase-1活化,并通过切割gasdermin D (GSDMD)产生其N端产物(GSDMD-NT),在细胞膜上成孔,使炎症因子如成熟IL-1β、高速泳动族框蛋白1(high-mobility group box 1,HMGB1)等分泌至胞外,导致炎症反应[4]。因此,正常的NLRP3炎症小体的活化是机体固有免疫防线的重要组成部分,而NLRP3炎症小体的异常活化则与多种炎症性疾病的发生密切相关,是治疗相关疾病的重要药物靶标[5-6]。
灯盏花乙素(scutellarin)又名野黄芩苷,是从灯盏花等中草药中分离提取的一种黄酮类物质,具有多种药理学作用,如抗炎、抗凋亡、抗肿瘤等[7]。在临床上用于缺血和缺氧性心脑血管疾病的治疗以及脑血管病后瘫痪的治疗[8]。研究显示,灯盏花乙素可以通过抑制钙离子调节的钙调磷酸酶和钙蛋白激酶的信号通路,改善心脑血管疾病[9]。灯盏花乙素也具有明显的抗炎作用,能抑制炎症相关信号通路和炎症性细胞因子的表达,从而减轻炎症相关疾病的症状[10]。缺血性心脑血管疾病涉及组织损伤及损伤相关炎症反应,可能原因之一是损伤引起的内源性危险信号(如ATP等)释放到细胞外,激活固有免疫细胞中NLRP3活化和IL-1β等炎症性细胞因子的分泌[11]。但目前灯盏花乙素对NLRP3炎症小体活化的影响尚未见报道。在本研究中,我们以LPS致敏的小鼠巨噬细胞 J774A.1作为炎症细胞模型,探讨灯盏花乙素对NLRP3炎症小体活化和细胞焦亡的影响,为进一步了解其药理学机制提供实验依据。
1 材料
1.1细胞与试剂小鼠巨噬细胞系J774A.1细胞购自中国科学院昆明动物研究所细胞库。灯盏花乙素购于广东省药品检验所;ATP、碘化丙锭(propidium iodide,PI)、Hoechst 33342、LPS、MDL12330A,购于Sigma-Aldrich公司;DMEM、Opti-MEM、胎牛血清(fetal bovine serum,FBS)、青霉素、链霉素为Thermo Fisher公司产品;抗caspase-1抗体购自Santa Cruz Biotechnology公司;抗NLRP3抗体购于Adipogen AG公司;抗IL-1β、HMGB1、ASC、β-tubulin、phospho-(Ser/Thr) PKA substrate、辣根过氧化物酶标记二抗等抗体以及Protein G agarose beads购于Cell Signaling Technology公司;H89、PMSF购自碧云天公司;Cytometric Bead Array (CBA) Mouse IL-1β Flex Set试剂盒为BD公司的产品。
1.2仪器Labofuge 400R低温高速离心机(美国Thermo Scientifc公司);FACSCalibur流式细胞仪(美国BD公司);Axio Observer D1倒置荧光显微镜(德国Zeiss公司);MINI Protean 2电泳系统(美国 Bio-Rad公司);FluorChem 8000凝胶图像成像仪(美国AlphaInnotech公司)。
2 方法
2.1细胞培养小鼠J774A.1细胞为贴壁型细胞,培养于完全培养基(含10% FBS、100 kU·L-1青霉素、100 mg·L-1链霉素的DMEM)中,置37℃、5% CO2培养箱中培养,取对数生长期细胞进行实验。
2.2细胞焦亡的检测参考相关文献[12],J774A.1细胞接种于24孔板,培养过夜后,用0.5 mg·L-1LPS刺激4 h,加入灯盏花乙素(0.1、0.2、0.4 mmol·L-1)作用1 h,补加4 mmol·L-1的ATP反应1 h,最后加入PI(2 mg·L-1)和Hoechst 33342(5 mg·L-1)室温下孵育染色10 min,倒置荧光显微镜观察并拍照,统计PI阳性细胞占总细胞(即Hoechst阳性)的百分比。
2.3免疫印迹分析将J774A.1细胞接种于6孔板,培养过夜后,用0.5 mg·L-1LPS刺激4 h,加入灯盏花乙素(0.1、0.2、0.4 mmol·L-1)作用1 h,补加4 mmol·L-1的ATP反应1 h。分别提取细胞和上清中(样品的体积相同)的蛋白,进行SDS-PAGE电泳,电泳结束后,将分离的蛋白质转至PVDF膜上。取出PVDF膜,加入适量的封闭液(含3% FBS和0.1% 吐温20的PBST),常温下封闭1 h,然后加入相应比例的一抗,4℃摇床孵育过夜。加入辣根过氧化物酶标记的二抗,室温摇床孵育1 h。加入ECL化学发光液显色,成像仪拍照记录结果,最后用Alpha EaseFC 4.0软件(Alpha Innotech)分析条带的灰度值。
2.4可溶性细胞因子IL-1β的检测小鼠J774A.1细胞接种于24孔板,培养过夜后,用0.5 mg·L-1LPS刺激4 h,加入灯盏花乙素(0.1、0.2、0.4 mmol·L-1)作用1 h,补加4 mmol·L-1的ATP反应1 h。最后收集细胞培养上清液,按照试剂盒说明书定量检测上清中IL-1β含量。用流式细胞仪检测,通过CellQuest软件(BD公司)进行数据获取与分析。
2.5cAMP-PKA信号通路的抑制小鼠J774A.1细胞接种于24孔板,培养过夜后,用0.5 mg·L-1LPS刺激4 h,加入灯盏花乙素(0.1、0.2、0.4 mmol·L-1)作用30 min后,补加腺苷酸环化酶特异性抑制剂MDL12330A 10 μmol·L-1作用30 min,或者加入PKA的选择性抑制剂H89 20 μmol·L-1作用30 min后,加灯盏花乙素(0.1、0.2、0.4 mmol·L-1)作用1 h,最后加入4 mmol·L-1的ATP反应1 h。

3 结果
3.1灯盏花乙素抑制ATP诱导的NLRP3炎症小体活化ATP是NLRP3炎症小体的常用活化剂,而活化的caspase-1(10 ku)与成熟IL-1β(17 ku)是NLRP3炎症小体活化的两个重要标志。免疫印迹检测显示,单独LPS处理能够促进pro-IL-1β(31 ku)与NLRP3的表达,而对组成型表达的pro-caspase-1(45 ku)与ASC无影响(Fig 1A);单独LPS处理的巨噬细胞的培养上清液中未检测到活化的caspase-1p10与成熟的IL-1β(17 ku)的释放。经第二信号ATP刺激后,细胞培养液上清中能够明显检测到活化的caspase-1p10以及成熟IL-1β(17 ku)(Fig 1A-1C)。而灯盏花乙素预处理能够剂量依赖性地抑制ATP诱导的caspase-1活化以及IL-1β的成熟与分泌(Fig 1A-1C);同时,LPS+灯盏花乙素处理并不会促进caspase-1活化以及IL-1β的成熟与分泌(Fig 1A-1C)。另外,用 CBA检测细胞培养液上清中IL-1β的分泌水平,显示灯盏花乙素能够剂量依赖性地抑制ATP诱导的IL-1β的释放(Fig 1D),这与免疫印迹法的检测结果相一致。这些结果表明,灯盏花乙素能够抑制ATP诱导的小鼠巨噬细胞中NLRP3炎症小体的活化。
3.2灯盏花乙素抑制巨噬细胞中ATP诱导的细胞焦亡NLRP3炎症小体活化会导致细胞焦亡的发生。而细胞焦亡可以通过PI染色法以及标志性蛋白HMGB1的释放进行分析。如Fig 2所示,当加入第二信号ATP后,细胞明显变圆肿胀,甚至破裂成细胞碎片,从而使PI染料穿过胞膜进入细胞核内,发出红色荧光,表明ATP诱导LPS致敏的巨噬细胞发生了焦亡,其焦亡率约为45%(Fig 2A、2B)。而灯盏花乙素预处理能够明显抑制ATP诱导的细胞焦亡(Fig 2A、2B);单独LPS或LPS+灯盏花乙素联合作用并不会诱导细胞焦亡的发生。免疫印迹法分析显示,灯盏花乙素能够剂量依赖性地抑制ATP诱导的巨噬细胞中HMGB1分泌至细胞培养上清中;然而在无ATP刺激时,单独LPS或LPS+灯盏花乙素并不会导致HMGB1的释放(Fig 2C、2D)。上述结果表明,在J774A.1细胞中,灯盏花乙素能够抑制ATP诱导的细胞焦亡的发生。
3.3灯盏花乙素抑制巨噬细胞发生细胞焦亡依赖于cAMP-PKA信号研究表明,灯盏花乙素可以上调细胞内cAMP的水平[13],而cAMP能够激活下游的PKA,活化的PKA可以负调控NLRP3炎症小体的活化[14]。因此,我们首先选用了腺苷酸环化酶特异性抑制剂MDL12330A抑制胞内cAMP水平,以探讨灯盏花乙素对细胞焦亡的影响。经MDL12330A处理后,不仅能够促进ATP诱导的细胞焦亡,还能逆转灯盏花乙素对巨噬细胞中ATP诱导的细胞焦亡的抑制作用(Fig 3A、3B)。以上结果提示,灯盏花乙素抑制巨噬细胞发生细胞焦亡与cAMP水平密切相关。
进一步利用PKA的选择性抑制剂H89抑制PKA活性,通过PI染色法对细胞焦亡进行检测分析。结果显示,灯盏花乙素预处理剂量依赖性地抑制J774A.1巨噬细胞中ATP诱导的细胞焦亡,而H89处理不仅能够促进ATP诱导的细胞焦亡,还能逆转灯盏花乙素对ATP诱导的细胞焦亡抑制作用(Fig 4A、4B)。上述结果提示,灯盏花乙素对NLRP3炎症小体活化与细胞焦亡的抑制作用依赖于PKA信号。
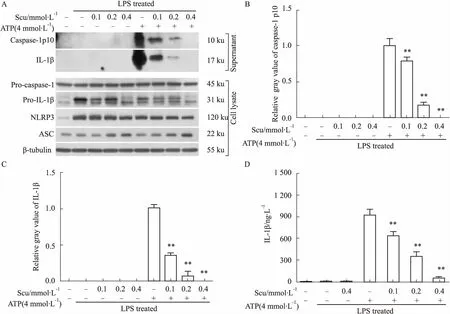
Fig 1 Scutellarin inhibited ATP-induced activation of NLRP3 inflammasomes (±s, n=3)
A: Western blot analyses of the levels of indicated proteins in cell lysates and culture supernatants, respectively. β-tubulin was used as a loading control for cell lysates; B, C: Histograms showing the relative intensity of caspase-1p10 or IL-1β of Western blot. The intensity of caspase-1p10 or IL-1β bands in ATP group was set to 1.0; D: Cytometric bead array (CBA) assay for IL-1β levels in the culture supernatants.**P<0.01vsATP group. Scu: Scutellarin.
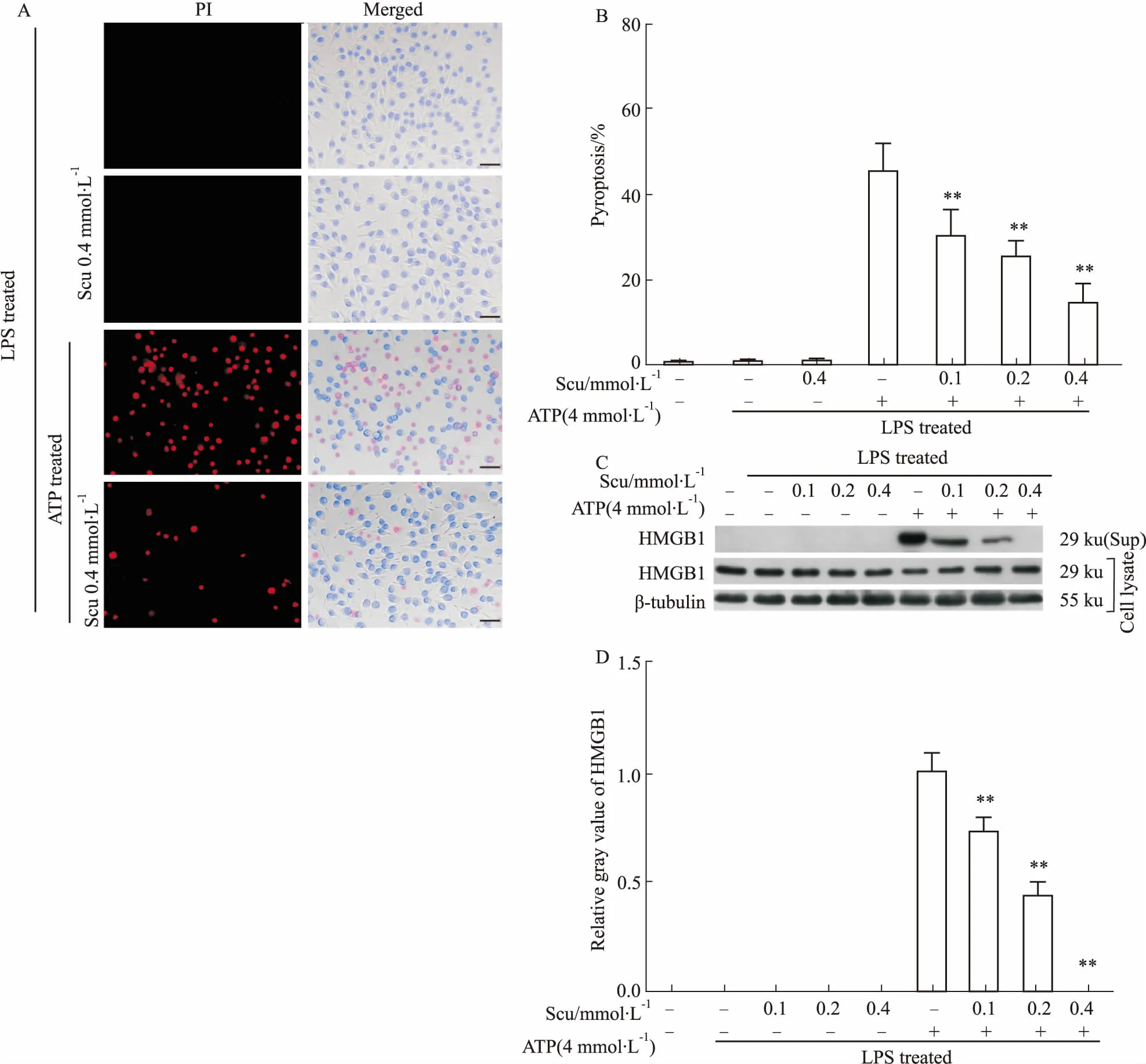
Fig2ScutellarininhibitedATP-inducedpyroptosisinJ774A.1macrophages
4 讨论
NLRP3是固有免疫系统识别病原体的一类重要感受器,识别进入机体内的PAMP或DAMP,从而引起强烈的炎症反应。细菌感染时,不仅细菌本身能释放ATP,也能诱导单核/巨噬细胞释放ATP,从而激活NLRP3炎症小体,而引起急性期强烈炎症反应,并诱发固有免疫细胞(包括巨噬细胞)的焦亡;同样,器官受到损伤时也能导致细胞内DAMP(如ATP等)释放到胞外,进而激活NLRP3炎症小体和细胞焦亡,进一步加强损伤相关的炎症反应。神经性疾病的发生和发展也与NLRP3有关,如多发性硬化症、阿尔茨海默病、帕金森病等[6]。此外,NLRP3的功能失调与多种代谢疾病和免疫紊乱(如2型糖尿病、动脉粥样硬化、痛风等)密切相关[6]。因此,抑制NLRP3炎症小体的活化与细胞焦亡的发生,将有利于缓解上述NLRP3异常活化相关炎症性疾病的症状[1]。本研究发现,在小鼠巨噬细胞J774A.1中,灯盏花乙素处理可以抑制ATP诱导的NLRP3炎症小体的活化与细胞焦亡,从而抑制caspase-1的活化以及成熟IL-1β和HMGB1等炎症因子的释放,提示灯盏花乙素可作为一种治疗NLRP3炎症小体异常活化相关的炎症性疾病的潜在药物。
由于NLRP3的活化能够诱发强烈的炎症反应,因而受到多种调控分子或信号通路的调控。最近的研究发现,cAMP-PKA信号对NLRP3炎症小体的活化也具有重要的调控作用。如胆汁酸通过其细胞膜受体TGR5提高胞内cAMP水平,从而激活PKA,活化的PKA诱导NLRP3的Ser 291(小鼠)发生磷酸化,进而抑制NLRP3活化[14];又如,前列腺素E2通过其受体EP4激活cAMP-PKA通路,促使NLRP3的Ser 295(人类)发生磷酸化,负调控NLRP3炎症小体活化[15]。考虑到以往研究显示灯盏花乙素可以上调cAMP的水平[13],在本研究中我们初步探讨了cAMP-PKA信号在灯盏花乙素抑制NLRP3炎症小体活化与细胞焦亡过程中的作用,发现腺苷酸环化酶抑制剂MDL12330A和PKA抑制剂H89都能完全逆转灯盏花乙素对ATP诱导的细胞焦亡的抑制作用,提示灯盏花乙素可能通过调节PKA的活性而抑制ATP诱导的NLRP3炎症小体活化与细胞焦亡。
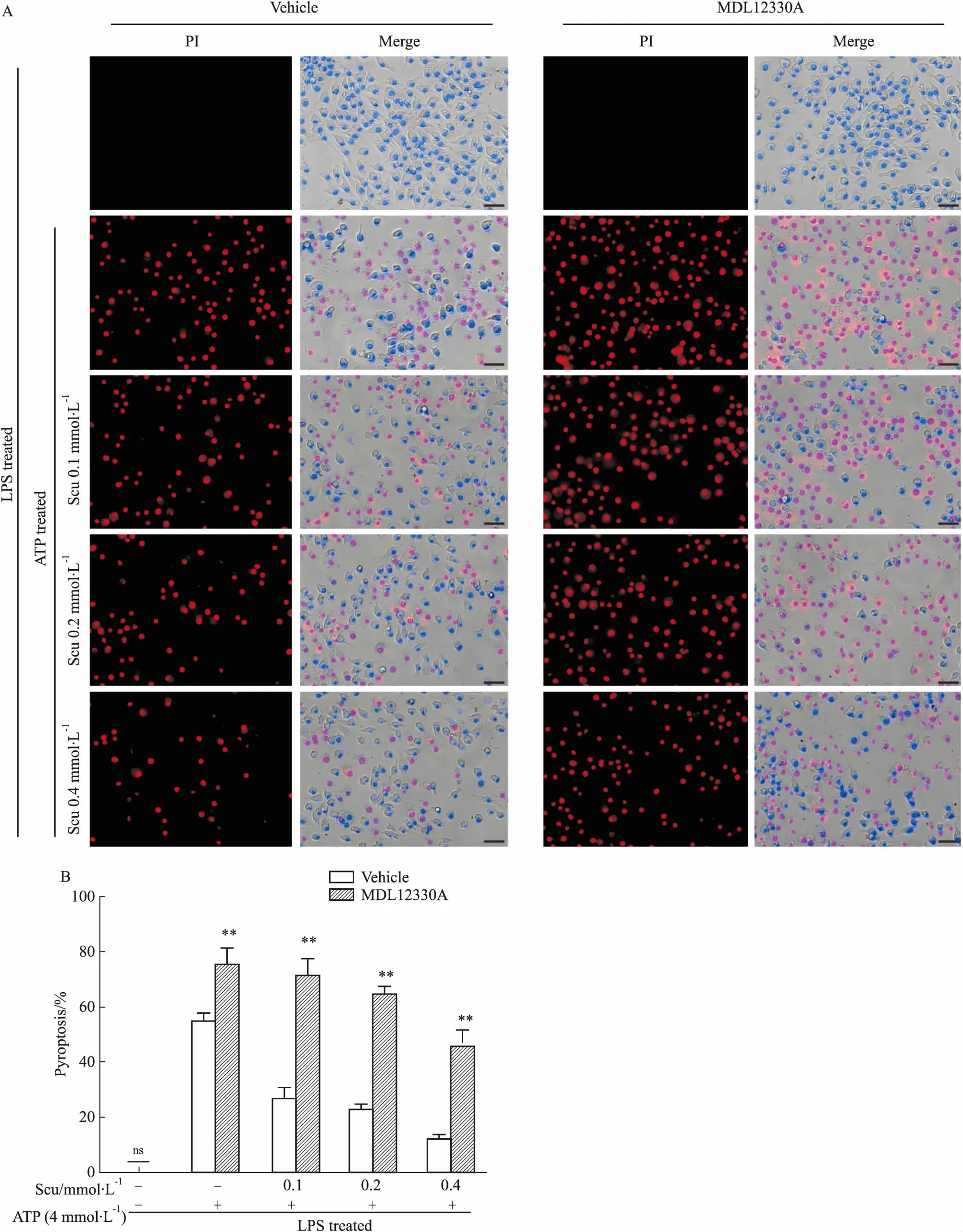
A: Cell death in J774A.1 cells was measured by staining with PI (red, staining dead cells) and Hoechst 33342 (blue, staining all cells). Scale bar=50 μm; B: PI-positive cells in five randomly chosen fields containing ~100 cells in each were quantified.**P<0.01vsvehicle; ns: not significant.
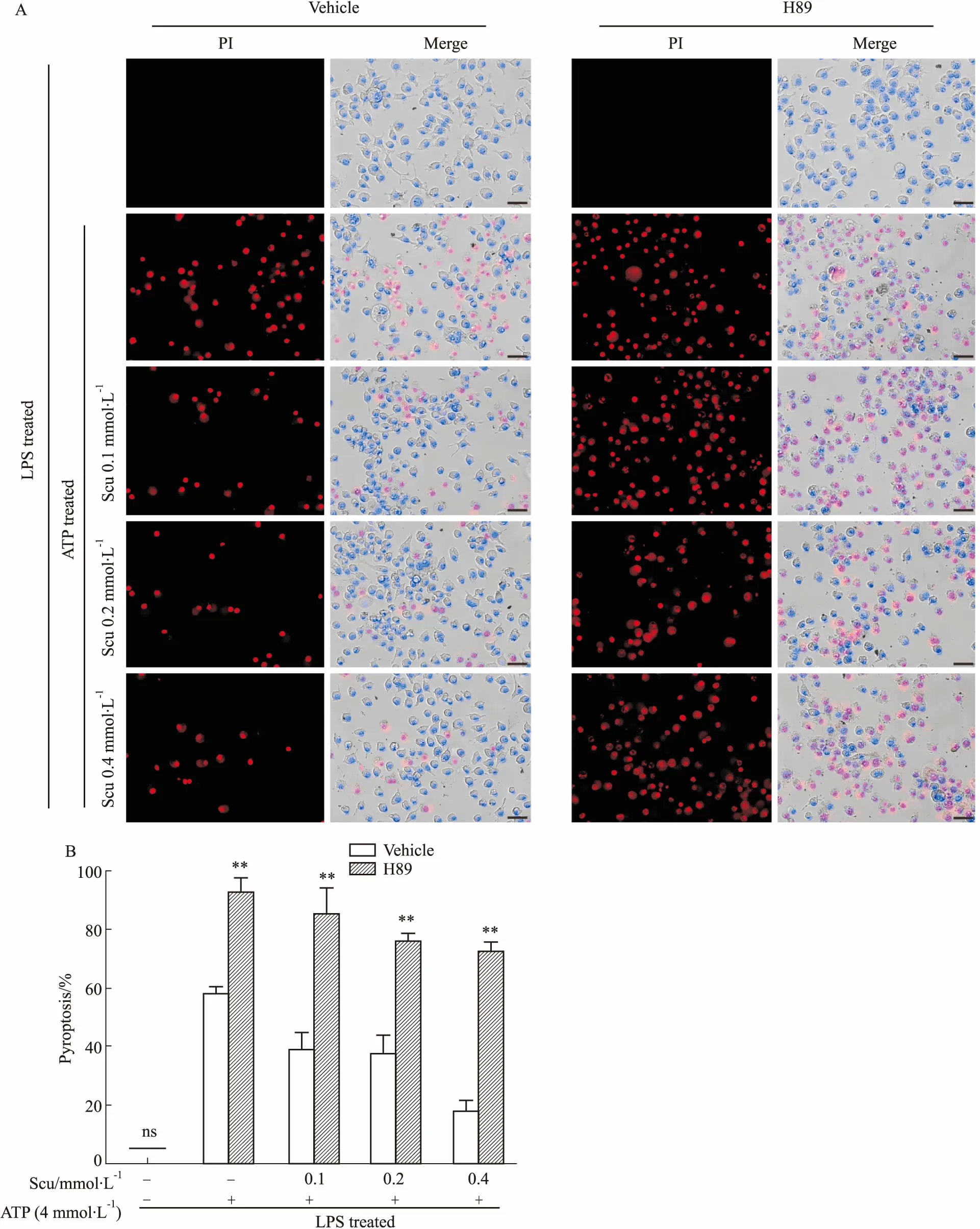
Fig4ScutellarininhibitedATP-inducedpyroptosisviaregulatingPKAsignaling
A: Cell death in J774A.1 cells was assayed by PI (red) and Hoechst 33342 (blue). Scale bars=50 μm; B: PI-positive cells in five randomly chosen fields containing ~100 cells in each were quantified.**P<0.01vsvehicle; ns: not significant.
总之,本研究发现,灯盏花乙素可以明显抑制小鼠巨噬细胞J774A.1中ATP诱导的NLRP3炎症小体的活化与细胞焦亡,这种抑制作用可能由cAMP/PKA信号通路所介导。虽然灯盏花乙素抑制NLRP3活化的具体机制还需要进一步研究阐明,本研究结果显示灯盏花乙素可能用于预防和治疗NLRP3异常活化或功能失调所引起的炎症性疾病;同时,这也为灯盏花乙素作为抗炎药物发挥作用提供了新的实验证据。
[1] Lamkanfi M, Dixit V M. Mechanisms and functions of inflammasomes[J].Cell, 2014,157(5): 1013-22.
[2] Wegiel B, Larsen R, Gallo D, et al. Macrophages sense and kill bacteria through carbon monoxide-dependent inflammasome activation[J].JClinInvest, 2014,124(11): 4926-40.
[3] 王 伟, 戴 敏, 徐忠东. 丹皮酚对脂多糖/三磷酸腺苷诱导的小胶质细胞NLRP3炎症小体激活的影响[J]. 中国药理学通报, 2014,30(5): 652-6.
[3] Wang W, Dai M, Xu Z D. Effects of paeonal on lipopolysaccharide/ adenosine 5′-triphosphate induced NLRP3 inflammasome activation in primary rat microglia[J].ChinPharmacolBull, 2014,30(5): 652-6.
[4] Labbe K, Saleh M. Cell death in the host response to infection[J].CellDeathDiffer, 2008,15(9): 1339-49.
[5] Strowig T, Henao-Mejia J, Elinav E, et al. Inflammasomes in health and disease[J].Nature, 2012,481(7381): 278-86.
[6] Guo H, Callaway J B, Ting J P. Inflammasomes: mechanism of action, role in disease, and therapeutics[J].NatMed, 2015,21(7): 677-87.
[7] Li H, Huang D, Gao Z, et al. Scutellarin inhibits cell migration by regulating production of αvβ6 integrin and E-cadherin in human tongue cancer cells[J].OncolRep, 2010,24(5): 1153-60.
[8] Xing J F, You H S, Dong Y L, et al. Metabolic and pharmacokinetic studies of scutellarin in rat plasma, urine, and feces[J].ActaPharmacolSin, 2011,32(5): 655-63.
[9] 石美娜, 杨为民, 刘 璇. 灯盏花乙素药理作用研究进展[J]. 昆明医科大学学报, 2013,34(9): 151-4.
[9] Shi M N, Yang W M, Liu X. Research progress of scutellarin pharmacological study[J].JKunmingMedUniv, 2013,34(9): 151-4.
[10] Niu C, Sheng Y, Yang R, et al. Scutellarin protects against the liver injury induced by diosbulbin B in mice and its mechanism[J].JEthnopharmacol, 2015,164(3): 301-8.
[11] Ito M, Shichita T, Okada M, et al. Bruton’s tyrosine kinase is essential for NLRP3 inflammasome activation and contributes to ischaemic brain injury[J].NatCommun, 2015,6(6):7360.
[12] 魏红霞, 李陈广, 梁译丹, 等. 二甲双胍增强LPS激活的腹腔巨噬细胞在ATP刺激下的炎症小体活化[J]. 中国药理学通报, 2017,33(4):474-9.
[12] Wei H X, Li C G, Liang Y D, et al. Metformin enhances ATP-stimulated inflammasome activation in LPS-primed peritoneal macrophages[J].ChinPharmacolBull, 2017,33(4): 474-9.
[13] Tian X, Chang L, Ma G, et al. Delineation of platelet activation pathway of scutellarein revealed its intracellular target as protein kinase C[J].BiolPharmBull, 2016,39(2): 181-91.
[14] Guo C, Xie S, Chi Z, et al. Bile acids control inflammation and metabolic disorder through inhibition of NLRP3 inflammasome[J].Immunity, 2016,45(4): 802-16.
[15] Mortimer L, Moreau F, MacDonald J A, et al. NLRP3 inflammasome inhibition is disrupted in a group of auto-inflammatory disease CAPS mutations[J].NatImmunol, 2016,17(10): 1176-86.