膜蒸馏生物反应器处理模拟废水膜污染过程解析
2018-01-23王银宝李剑锋程芳琴
王银宝,任 静,李剑锋,韩 坭,程芳琴
(山西大学低附加值煤基资源高值利用协同创新中心,资源与环境工程研究所,山西太原 030006)
随着我国水资源供求矛盾的加剧和水环境保护 要求的日趋严格,污水回用的重要性日益凸显,开发处理效果更好、运行成本更低、操作更简单的污水回用技术成为新的发展趋势。膜蒸馏生物反应器(membrane distillation bioreactor,MDBR)是一种可以实现污水处理并回用的新型膜生物反应器。它是由澳大利亚科学家Anthony G.Fane等在2008年提出,基于膜蒸馏的原理采用疏水性微孔膜进行泥水分离,膜蒸馏生物反应器中的传质驱动力是膜两侧的温度差。在存在温度差的条件下,只要疏水性膜不被润湿,水蒸气就会通过膜而被冷凝成蒸馏水,除了水蒸气(或挥发性气体)以外其他组分都会残留在反应器内[1]。该工艺占地面积小,处理工艺简单,剩余污泥量少;采用膜蒸馏一步法代替深度处理的繁琐工艺,可以很好地利用工厂的余热,减少设备的运行费用,为企业提供显著经济效益。此外活性污泥和有机污染物的截留增加了污泥的停留时间,有利于有机物降解[2]。MDBR可以在去除有机污染物的同时获得高纯水,因此被认为是一种很有潜力的污水处理及再生技术[3]。然而膜生物污染问题已成为制约膜蒸馏生物反应器技术广泛应用的重要因素,Phattaranawik等[4]在采用 MDBR处理人工模拟废水时发现膜通量随时间递减,最终衰减可以达到50%以上。Khaing等[5]采用MDBR处理炼油废水时,发现膜生物污染层中含有CaCO3晶体,推测钙离子可能在膜生物污染中起到了重要作用。国内外专家主要从反应器的运行条件、废水的性质等对膜污染进行研究,对膜表面污染物的具体组成成分探究较少,因此探索膜表面污染物的成分对减轻膜污染有着重要意义。
本研究通过膜蒸馏生物反应器对模拟废水的试验研究,考察了膜蒸馏生物反应器的膜污染问题,对膜表面污染物的组成和结构特点进行了分析,并探究了活性污泥的性质与膜污染之间的关系,为膜污染控制策略的提出奠定了基础。
1 材料及方法
1.1 试验装置及运行方式
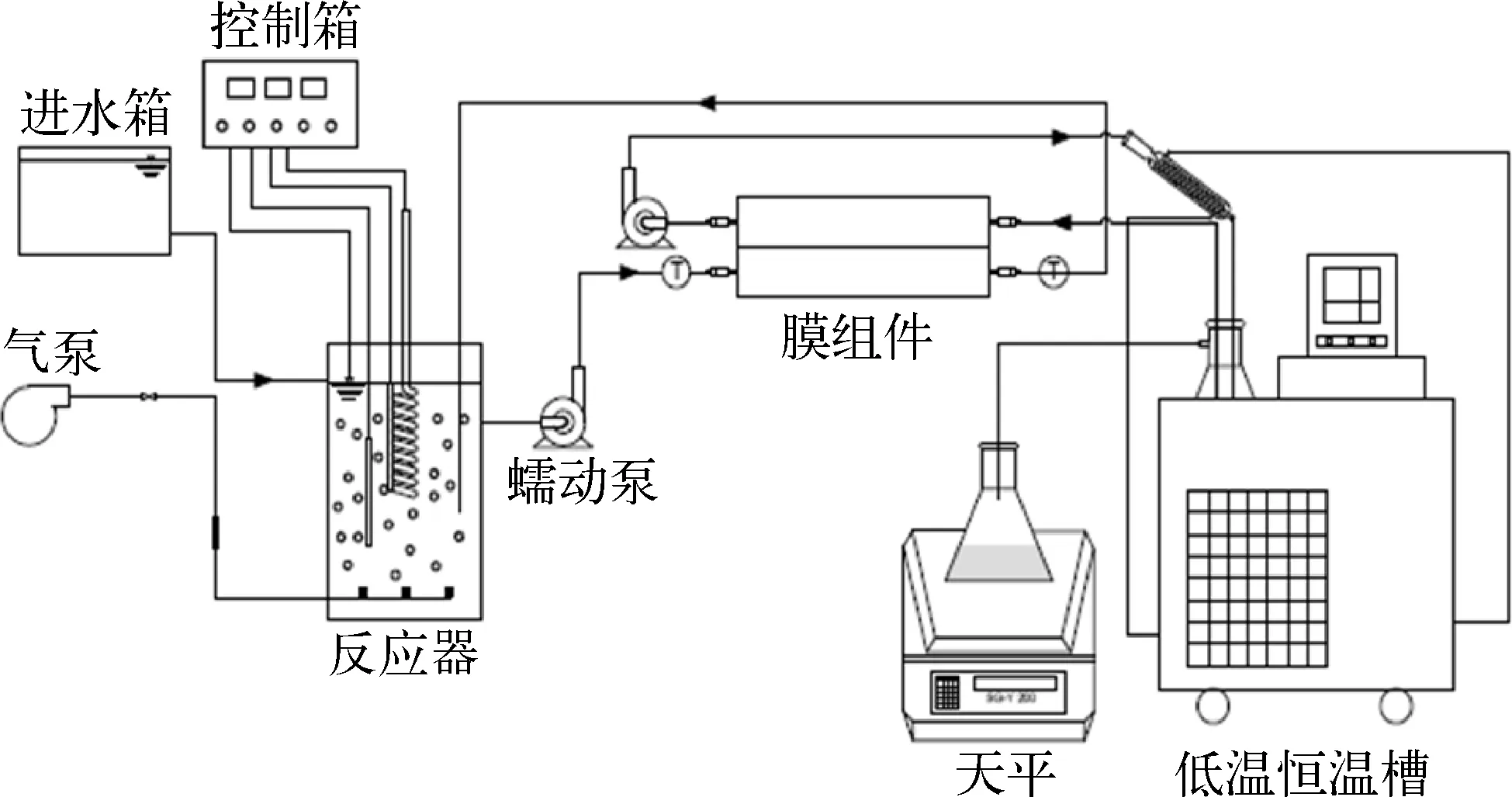
图1 膜蒸馏生物反应器试验装置Fig.1 Experimental Equipment of Membrane Distillation Bioreactor
如图1所示,试验装置由进水系统、出水系统、曝气系统、加热系统、冷却系统、生物反应器系统和膜蒸馏系统七部分组成。其中生物反应器系统由有机玻璃制成,有效容积为2.3 L。本试验所用膜为日本住友电气工业公司生产的疏水性平板膜,该膜由聚四氟乙烯(PTFE)活性层和聚丙烯(PP)支撑层组成,其中膜的孔径为0.22 μm,膜组件由实验室自己设计加工,材质为聚丙烯,有效膜面积为27 cm2,温度、进水量、曝气、加热时间都由控制箱来控制。水力停留时间(HRT)和污泥停留时间(SRT)分别为3 d 和 10 d,曝气量控制在 0.4 L /min。
膜蒸馏生物反应器在运行20 d以后,拆卸膜组件进行膜清洗,首先用清水冲洗,然后用柠檬酸和次氯酸钠清洗,清洗以后膜通量可以恢复至80%~90%,可以重复使用4~5次。
1.2 试验水质及接种污泥
MDBR处理废水采用人工配水,水质指标如表1所示,进水电导率为 2 000±50 μS/cm,CODCr为1 000±35 mg/L,C ∶N ∶P =100 ∶5 ∶1,同时还加入了一些维持微生物生长所需的微量元素,系统接种的污泥取自某污水处理厂的好氧池。
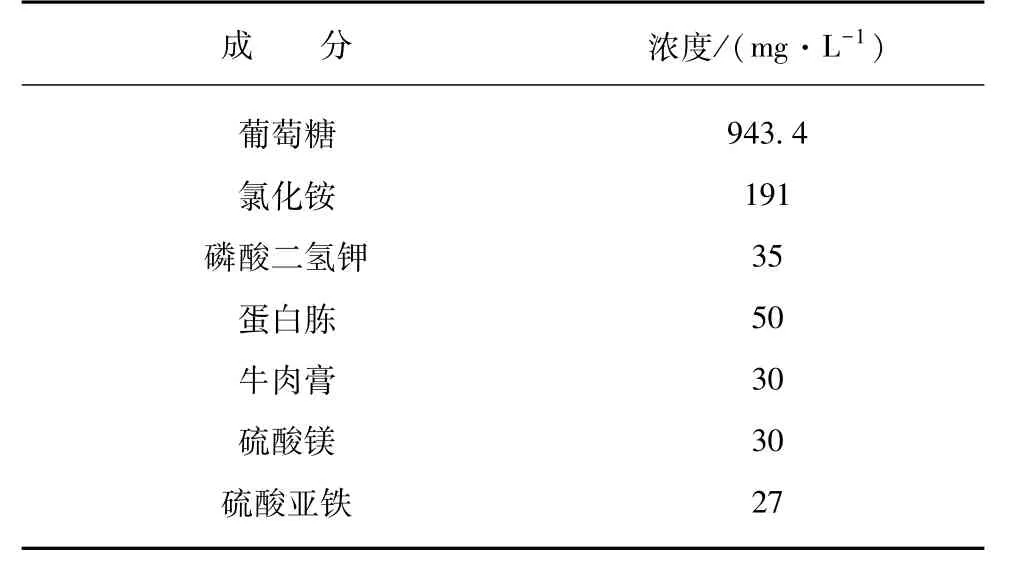
表1 人工配水组成成分Tab.1 Composition of the Synthetic Wastewater
1.3 试验指标及分析方法
(2)胞外聚合物采用甲醛-氢氧化钠法提取[7]:首先从反应器中取10 mL的泥水混合物放入离心管中,在室温下以10 000 r/min的转速离心10 min,倒掉上清液,加蒸馏水至原体积,然后加入 12 μL(37%)的甲醛溶液,在4℃的冰箱中放置1 h,再加入1 mol/L的 NaOH 溶液0.8 mL,置于4℃的冰箱中4 h,最后再把样品以10 000 r/min的转速离心20 min,用0.22 μm的醋酸纤维膜过滤得到上清液,取上清液测定蛋白质和多聚糖的含量。
(3)活性污泥上清液的提取:取一定量泥水混合物放入离心管中,在室温下以10 000 r/min的转速离心10 min,再用0.45 μm的醋酸纤维膜过滤得到上清液,用来测定蛋白质和多聚糖的含量。
(4)蛋白质的含量采用 Lowry法测定[8],多聚糖的含量采用苯酚-硫酸法测定[9]。
(5)在膜蒸馏生物反应器中,总阻力Rt[(Pa·m2·h)/L]主要包括膜阻力Rm、料液浓度差引起的浓差极化阻力Rp、料液温度差引起的温差极化阻力RT和膜污染引起的污染层Rf,阻力模型如式(1)~式(3)[10-11]。
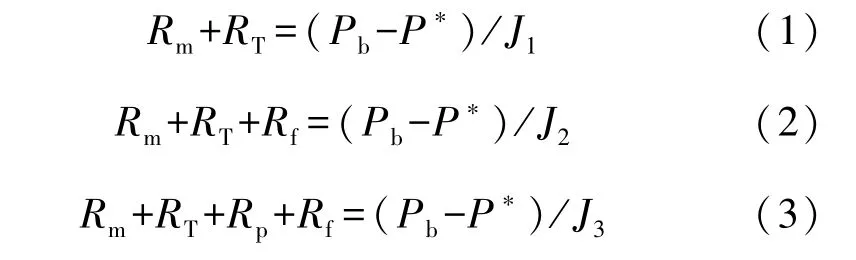
其中,Pb—膜组件热侧水的饱和蒸汽压,Pa;
P*—膜组件冷侧水的饱和蒸汽压,Pa;
J1—新膜纯水通量,L /(m2·h);
J2—运行后纯水通量,L /(m2·h);
J3—运行时的料液通量,L /(m2·h)。
膜组件中膜两侧的饱和蒸气压差约为3 kPa,膜通量可通过天平称量的产水量计算得到。通过式(1)~式(3)可计算出各部分阻力的大小和所占比例。
(6)三维荧光光谱分析(3D-EEM)[12-13]:采用荧光光谱仪(美国Agilent Cary Eclipse)对胞外聚合物、溶解性微生物代谢产物和污染物进行分析,光源为氙灯,光电倍增管电压设为600 mV,激发光Ex和发射光Em的狭缝宽度均设置为5 nm,激发光的扫描范围设置为200~450 nm,步长为10 nm,扫描间隔为 5 nm,发射光的扫描范围设置为 250~550 nm,步长为1 nm,扫描间隔为5 nm。扫描速度设置为 600 nm/min,测试前水样用 0.45 μm 的滤膜过滤并把pH值调节至10左右。用硫酸奎宁作为标准物来校准荧光强度(QSE),定义1 QSE是将0.01 mg/L 的奎宁溶解在 1 mol/L 的硫酸中,在激发波长为350 nm、发射波长为450 nm时测得的荧光强度。
2 结果与讨论
2.1 膜通量与污染层阻力的变化
在反应器连续运行20 d期间,膜热侧温度为50±3℃,冷侧温度为33±2℃。MDBR出水CODCr保持在 10±3 mg/L保持在 1±0.5 mg/L,电导率保持在15 μs/cm以下,COD和的去除率分别达到了98%和95%以上,说明MDBR对废水中的污染物能保持较好的去除效果。图2显示了膜通量随时间的变化情况及反应器运行前后膜表面污染层的变化,如图所示膜通量随着时间的延长而不断降低,运行1~3 d膜通量下降的趋势最为明显,下降了40%左右。随后膜通量下降趋势减缓,12 d以后膜通量下降了大约80%左右,之后膜通量基本不再变化,说明膜表面已经形成相对稳定的污染层。推测可能由于膜的截留及吸附作用引起大量污染物积累,它们为微生物了提供丰富的营养物质,使得微生物不断在膜上富集,造成膜污染不断加重。
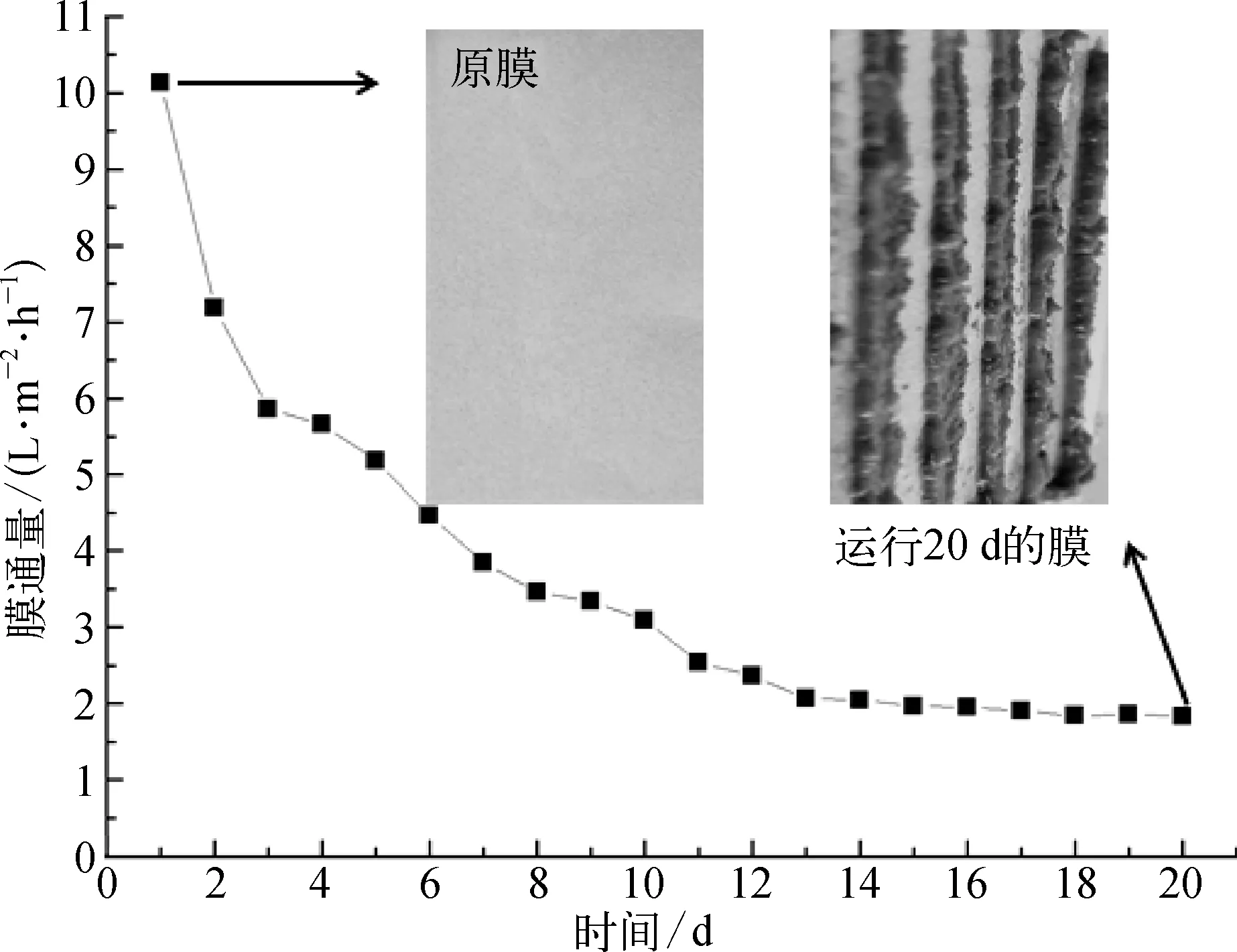
图2 膜通量随时间的变化曲线和膜污染前后对比图Fig.2 Changing Curve of Membrane Flux Varying with Time and Photos before and after Membrane Fouling
表2列出了膜蒸馏生物反应器在运行过程中的阻力变化。膜组件冷热两侧的温差始终保持一致,故运行过程中温差极化阻力不变,因此将温差极化引起的阻力归结到膜的固有阻力中。前3 d污染层阻力与浓差极化阻力变化极大,污染层阻力增大了9倍,浓差极化阻力增大了3倍;相比3 d,运行8 d时污染层阻力增大了2倍左右,浓差极化阻力增大至1.2倍;12 d开始污染层阻力与浓差极化阻力变化趋势均开始减缓。在反应器运行结束时污染层阻力占总阻力的80%,明显可以看出污染层阻力的变化趋势与膜通量的变化趋势相符,说明膜表面污染层的形成是膜阻力增大并导致膜通量下降的主要原因。
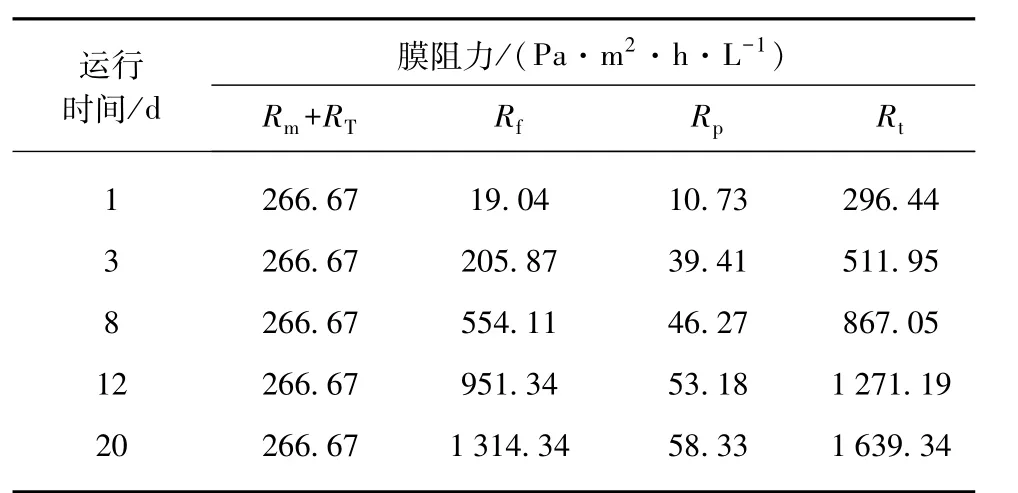
表2 膜蒸馏生物反应器运行过程中的阻力分析Tab.2 Analysis of Resistances in Membrane Distillation Bioreactor Process
2.2 膜污染层的结构和成分分析
为了进一步研究膜表面污染层的形成原因,采用扫描电子显微镜和X射线能量色散谱(SEMEDS)的方法对膜表面结构和成分进行分析。图3(a)和图3(b)分别为原膜的电镜图和元素组成图,由图可知,原膜只有C、O和F三种元素。图3(c)是反应器运行20 d后的膜污染图,可以看出膜污染比较严重,污染物已经完全覆盖了膜的表面。图3(d)为污染物的元素构成,可以看出污染物主要由C、O和N组成,还有少量的Ca、Mg、P和S元素,通过对比图3(b)和图3(d)可知污染层主要由有机物构成,同时存在少量的无机盐离子。
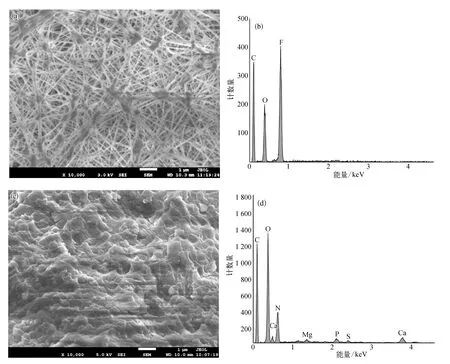
图3 反应器运行前后的SEM-EDS图 (a)原膜;(b)原膜 EDS;(c)膜表面污染物;(d)污染物 EDSFig.3 SEM-EDS Images before and after Reactor Operation (a)Pristine Membrane;(b)EDS of Pristine Membrane;(c)Pollutants on Membrane Surface;(d)Pollutant EDS
对膜表面的污染层进行傅氏转换红外线光谱(FTIR)分析,结果如图4所示,发现膜上的污染物在3 290~3 450 cm-1处有明显的特征峰,这个特征峰可以归结于-OH的伸缩振动;在2 920 cm-1处存在一个吸收峰,该峰是由于C—H键的伸缩振动引起的[14]。在 1 645 cm-1和 1 540 cm-1处存在两个峰,这两个峰归结于蛋白质的二级结构,分别是酰胺I带和 II带;在 1 375 cm-1和 1 200 cm-1处的峰是由酰胺 III带引起的[15]。1 080 cm-1处存在一个明显的特征吸收峰,这个特征峰归结于多糖或类多糖物质[16]。615 cm-1处的特征峰归结于腐植酸衍变的芳香族化合物[17]。以上结果表明膜上的污染物主要包括蛋白质、多糖类物质和一些腐植酸衍变的芳香族化合物。

图4 膜表面污染物的FTIR图Fig.4 FTIR Spectra of the Pollutants on Membrane Surface
2.3 活性污泥性质与膜污染之间的关系
为了进一步分析活性污泥的性质与膜污染之间的关系,我们对活性污泥胞外聚合物、活性污泥上清液以及膜表面污染物中的多糖和蛋白质的含量进行了测定。由图5可知,多糖和蛋白质在活性污泥和膜表面中的含量不同,其中活性污泥胞外聚合物中的蛋白质为 35.0± 3.5 mg/g VSS,多糖为 40.2±3.8 mg/g VSS,蛋白质浓度比多糖稍低。但是活性污泥上清液中蛋白质的含量明显升高,达到110.0±5.5 mg/g VSS,多 糖变 化 不 明 显,仅 有 45.8 ±4.5 mg/g VSS。膜污染层中蛋白质的含量高达330.8±10.2 mg/g VSS,是活性污泥上清液的 3 倍,活性污泥胞外聚合物的9倍,多糖含量为142.5±5.5 mg/g VSS,是活性污泥上清液的 3 倍,活性污泥胞外聚合物的3.5倍。通过对比蛋白质与多糖的含量,推测膜上的污染物主要来源于活性污泥上清液。可能是由于高温条件下微生物维持生命活动产生或细胞壁破裂释放出的多糖和蛋白质吸附在了膜表面上,从而产生膜污染[18]。
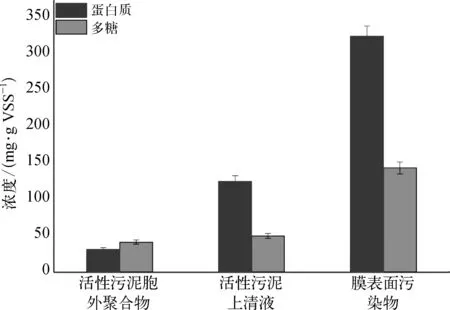
图5 蛋白质与多糖的浓度Fig.5 Concentrations of Protein and Polysaccharide
三维荧光法是一种较灵敏的分析溶解性有机物的方法,已被应用于分析微生物的代谢产物[19]。一般把微生物代谢产物三维荧光分为四个区域[20-21],即 Peak A(Ex/Em=220~230/360~380 nm)类蛋白酰胺 I带,Peak B(Ex/Em=280~300/350~380 nm)类蛋白酰胺 II带,Peak C(Ex/Em=320~330/380~400 nm)类腐植酸,Peak D(Ex/Em=220~235/400~430 nm)类富里酸。图6是采用三维荧光对活性污泥胞外聚合物、活性污泥上清液和膜表面污染物的分析结果。可以看出活性污泥胞外聚合物、活性污泥上清液和膜表面污染物的荧光图谱基本都存在A、B、C和D四个区域,但主要物质明显存在差异。其中活性污泥胞外聚合物的主要物质是蛋白质酰胺I带,还有少量富里酸。而活性污泥上清液的主要物质是蛋白酰胺II带,还有少量腐植酸、富里酸和酰胺I带。由膜表面污染物荧光图可知,其主要成分是蛋白酰胺II带,还有少量的蛋白酰胺I带物质。由于多糖物质不会产生荧光,所以三维荧光图主要反映了蛋白质类和腐植酸类物质的变化。由图6可知,膜表面污染物的组分与活性污泥上清液最为相似,而且出峰位置主要集中在蛋白质的特征区域。这进一步证实了膜表面污染物主要来源于活性污泥上清液。分析原因可能是由于热侧温度较高影响了反应器中微生物的活性,使得上清液中部分溶解性污染物不能分解,进而吸附在膜表面。

图6 污染物的三维荧光图(a)活性污泥胞外聚合物;(b)活性污泥上清液;(c)膜表面污染物Fig.6 EEM of the Contaminants (a)EPS of Activated Sludge;(b)Supernatant of Activated Sludge;(c)Pollutants on Membrane Surface
3 结论
(1)通过膜通量和膜阻力的分析,发现在反应器运行初期膜污染层阻力增大较快,逐渐成为影响膜通量的主要因素。随着时间延长,膜表面形成稳定的污染层,这时膜通量基本趋于稳定。
(2)膜污染层的结构和成分分析表明污染层主要由有机物构成,同时存在少量的无机盐离子。这些有机物以蛋白质、多糖和腐植酸类为主。
(3)通过对活性污泥胞外聚合物、活性污泥上清液和膜表面污染物中的蛋白质、多糖含量进行测定以及EEM分析,发现膜表面污染物中多糖、蛋白质的含量比例与活性污泥上清液最为接近,表明膜表面污染物主要来源于活性污泥上清液。
[1]Phattaranawik J,Fane A G,Pasquier A C S,et al.A novel membrane bioreactor based on membrane distillation[J].Desalination,2008,223(1-3):386-395.
[2]Zhao W,Huang X,Lee D.Enhanced treatment of coke plant wastewater using an anaerobic-anoxic-oxic membrane bioreactor system[J].Separation and Purification Technology,2009,66(2):279-286.
[3]Lay W C,Liu Y,Fane A G.Impacts of salinity on the performance of high retention membrane bioreactors for water reclamation:A review[J].Water Research,2010,44(1):21-40.
[4]Phattaranawik J,Fane A,Pasquier A,et al.Experimental study and design of a submerged membrane sistillation bioreactor[J].Chemical Engineering & Technology,2009,32(1):38-44.
[5]Khaing T H,Li J,Li Y,et al.Feasibility study on petrochemical wastewater treatment and reuse using a novel submerged membrane distillation bioreactor[J].Separation & Purification Technology,2010,74(1):138-143.
[6]国家环保总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[7]Liu H,Fang H H P.Extraction of extracellular polymeric substances (EPS)of sludges[J].Journal of Biotechnology,2002,95(3):249-256.
[8]李红兵,李宗让,王志玲,等.微量Lowry法测定蛋白质含量[J].生物化学与生物物理进展,1993,20(5):402-403.
[9]Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[10]马方伟,万家峰,李红,等.减压膜蒸馏过程中膜污染及膜阻力分析研究[J].水处理技术,2010,36(5):54-57.
[11]游文婷,董哲勤,张觅,等.高浓度NaCl溶液真空膜蒸馏传递阻力分布的研究[J].膜科学与技术,2014,34(6):1-5.
[12]姚萌,罗红元,谢小青,等.城市污水厂活性污泥胞外聚合物的三维荧光特性分析[J].中国环境科学,2012,32(1):94-99.
[13]欧阳二明,王伟,龙能,等.污泥内层和外层胞外聚合物的三维荧光光谱特性研究[J].光谱学与光谱分析,2009,29(5):1313-1318.
[14]Zhang S,Yang F,Liu Y,et al.Performance of a metallic membrane bioreactor treating simulated distillery wastewater at temperatures of 30 to 45 ℃[J].Desalination,2006,194(1-3):146-155.
[15]Kumar M,Adham S S,Pearce W R.Investigation of seawater reverse osmosis fouling and its relationship to pretreatment type[J].Environmental Science & Technology,2006,40(6):2037-2044.
[16]Maruyama T,Katoh S,Nakajima M,et al.FT-IR analysis of BSA fouled on ultrafiltration and microfiltration membranes[J].Journal of Membrane Science,2001,192(1-2):201-207.
[17]Croué J P,Benedetti M F,Violleau D,et al.Characterization and copper binding of humic and nonhumic organic matter isolated from the South Platte River:Evidence for the presence of nitrogenous binding site[J].Environmental Science & Technology,2003,37(2):328.
[18]Abeynayaka A, Visvanathan C. Performance comparison of mesophilic and thermophilic aerobic sidestream membrane bioreactors treating high strength wastewater[J].Bioresource Technology,2011,102(9):5345-5352.
[19]Ou H S,Wei C H,Mo C H,et al.Novel insights into anoxic/aerobic1/aerobic2biological fluidized-bed system for coke wastewater treatment by fluorescence excitation-emission matrix spectra coupled with parallel factor analysis[J].Chemosphere,2014,113:158-164.
[20]Ramesh A,Lee D J,Hong S G.Soluble microbial products(SMP)and soluble extracellular polymeric substances(EPS)from wastewater sludge[J].Applied Microbiology & Biotechnology,2006,73(1):219-225.
[21]Zhu L,Qi H,Lv M,et al.Component analysis of extracellular polymeric substances(EPS)during aerobic sludge granulation using FTIR and 3D-EEM technologies[J].Bioresource Technology,2012,124(3):455-459.
