不同生物量苦草残体腐解对水体水质的影响
2018-01-23付贤钟崔康平汤海燕
付贤钟,崔康平,藕 翔,汤海燕,韦 钊
(合肥工业大学资源与环境工程学院,安徽合肥 230009)
水生植物是水生生态系统的重要组成部分,能通过其生长过程中的吸收、过滤、截留等作用,主动并有效地吸收水体中的氮、磷、重金属、有机物等污染物质,对污水起到一定的净化作用[1]。水生植物通过促进微生物的生长代谢,可降解水中大部分可生物降解有机物;通过抑制低等藻类的生长,控制富营养化的表现形式[2]。因此,培育水生植物已经成为水体污染治理和生态修复的重要途径[3]。
沉水植物作为水生生态系统的初级生产者,是水体食物链的基础,对水体理化环境有重要的作用,同时在维持水生态系统的结构和功能以及生物多样性方面也起到关键作用[4-5]。研究沉水植物腐解过程以及此过程中释放的物质对水体水质的影响,有助于充分利用沉水植物对水体的净化功能,还能有效预防沉水植物残体向水中释放的营养物质造成水体的二次污染[6]。同时,研究沉水植物腐解过程对水质影响的差异及其成因,对沉水植物管理和水质保护具有重要的现实意义[7]。此外,若沉水植物自然死亡后在水体中大量腐解,会对水体造成严重的二次污染,从而进一步恶化水体环境[8-9]。因此,在用沉水植物恢复被污染水体的过程中,需对其生物量进行合理的调控,才能达到较为理想的效果[10]。
沉水植物腐解过程及其水质效应可能因植物残体总量而不同,例如张来甲等[11]通过研究发现,不同生物量苦草在生命周期的不同阶段对水体水质的影响有较大的差异。因此本文以沉水植物苦草(Vallisneria natans)为例,通过定期对各项水质指标进行测定,进一步探索不同生物量的苦草残体在腐解过程中对水体水质的影响,以期为水生生态修复中苦草的种植密度及其残体的管理提供科学参考依据。
1 材料与方法
1.1 试验材料
试验所用沉水植物苦草取自合肥工业大学校园内斛兵塘,收集的苦草残体用高纯水漂洗去除残体表面的杂质后,将残体置于烘箱中于65℃烘干至恒重,然后再将其剪成约1 cm长的碎片,混合均匀后置于密封袋中,并置于干燥器内以备使用。试验用水均为试验室高纯水设备制取的高纯水,其pH值在7左右,ρ(余 氯)≤ 0.05 mg/L,ρ(TDS)≤ 300 mg/L,ρ(COD)≤1.5 mg/L,ρ(TOC)≤2.0 mg/L。
1.2 试验设计
在室温条件下,用尼龙网将不同质量的苦草残体碎片包裹后,置于容量为1 L的烧杯中进行腐解试验。试验分为A、B、C三个工况,分别为:0.1 g/L苦草残体+高纯水、0.2 g/L 苦草残体+高纯水、0.4 g/L残体+高纯水,每个工况设3个平行样。整个试验在避光条件下进行,于第 0、2、4、6、8、10、17、24、31、38、52、66 d 进行采样监测,每次取 20 mL 水样测定 COD、TN、NH3-N、TP、pH、DO 等指标。试验期间每次取完水样后,应补充适量的高纯水以保持整体水量,直至试验结束。
1.3 水质指标测定方法
1.4 数据处理
试验所测数据作为原始数据,作图分析时各指标最终数据均取三个平行工况所得数据的平均值,使用Origin 9.1对数据进行分析作图。
2 结果与分析
2.1 不同生物量苦草残体腐解对水体pH值的影响
水体中pH值随时间的变化情况如图1所示,在试验初期各工况水体pH均呈现先下降再上升而后又下降的趋势,并在下降到最低值后于第17 d达到最大值,而且在试验末期水体的pH均高于试验初始值,但是试验组三种工况的pH差距并不是很大。这说明苦草残体的腐解对水体的pH变化有一定的影响,但是不同生物量的苦草残体腐解对水体的pH影响不大。

图1 水体pH值随时间的变化Fig.1 Variation with Time of pH Value in Water Body
试验初期水体pH值下降是由于在沉水植物腐烂初期,一方面植物大量衰亡,导致水体内有机物迅速增加,在微生物作用下分解并释放出CO2,导致水体中pH值下降[13];另一方面,苦草中蛋白质含量较高,植物体中的蛋白质被微生物分解后产生大量的氨基酸,苦草中氨基酸不仅种类齐全,而且含量丰富[14],这也导致了水体pH值的下降。随后由于氨基酸的分解导致水体酸度降低,同时苦草残体中的含氮有机物被逐步降解释放到水体,微生物在代谢过程中产生的和胺类物质又引起 pH值上升[15]。随着试验的进行,水体中和胺类物质等经硝化反硝化等过程被消耗,pH值又逐渐降低。
2.2 不同生物量苦草残体腐解对水体ρ(DO)的影响
如图2所示,水体中DO在试验初期迅速下降,在试验第6 d时降至最小值,而后又缓慢上升,而且在不同工况中投加的苦草残体生物量越大,DO的值越小,这说明投加的生物量越大,水体中的溶解氧被消耗的越多。

图2 水体DO浓度随时间的变化Fig.2 Variation with Time of DO Concentration in Water Body
在试验前期,由于苦草的腐烂分解是在微生物的作用下完成的,微生物迅速的降解过程消耗了水体中大量的溶解氧,因此水体中的DO浓度在试验初期迅速降低[7];而在试验中、后期,植物腐解程度逐渐减弱,DO消耗量降低[13],而且试验水体与空气直接接触发生复氧作用,导致水体中DO浓度又逐渐上升。在整个试验过程中,沉水植物的腐解都在进行,因此水体中的溶解氧也一直被消耗,在试验末期各工况的DO浓度均低于试验初始值。
2.3 不同生物量苦草残体腐解对水体ρ(COD)的影响
由图3可知,投加苦草残体腐解的各工况水体中COD浓度均呈缓慢上升趋势,而且在试验末期水体中的COD浓度远高于试验初始值。由不同生物量之间的比较可知,随着生物量的增加,整个试验进程中水体中COD浓度也在不断增加,而且在试验末期,生物量高的工况水体COD浓度明显高于生物量低的。由此可知,苦草的残体腐解会增加水体的COD值,而且生物量越高,对水体COD浓度影响越大。

图3 水体CODCr浓度随时间的变化Fig.3 Variation with Time of CODCrConcentration in Water Body
相关文献表明沉水植物腐解对水体COD产生影响的变化趋势一般为先上升后下降[6-7],而本试验结果却显示苦草的残体腐解使得水体COD浓度不断升高,原因可能是本试验用水为高纯水,其中的微生物种类和数量较少,这对于硝化菌的生长繁殖而言需时较长,导致在试验中后期苦草残体腐解产生有机物的速率要远大于微生物利用有机碳源进行自身反硝化作用的速率。
2.4 不同生物量苦草残体腐解对水体氮含量的影响

图4 水体浓度随时间的变化Fig.4 Variation with Time of Concentration in Water Body
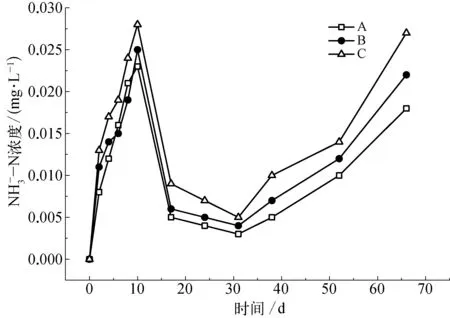
图5 水体浓度随时间的变化Fig.5 Variation with Time ofConcentration in Water Body
2.4.3 水体中 ρ(TN)的变化
图6为水体TN浓度随时间的变化。由图6可知,各工况水体中TN浓度均呈先上升再下降的趋势,且在试验第10 d上升至峰值。其中C工况的变化趋势尤为明显,在整个试验过程中该工况水体中TN浓度均明显高于其他两组,这说明随着生物量的增加,水体中TN浓度也在逐渐增加。
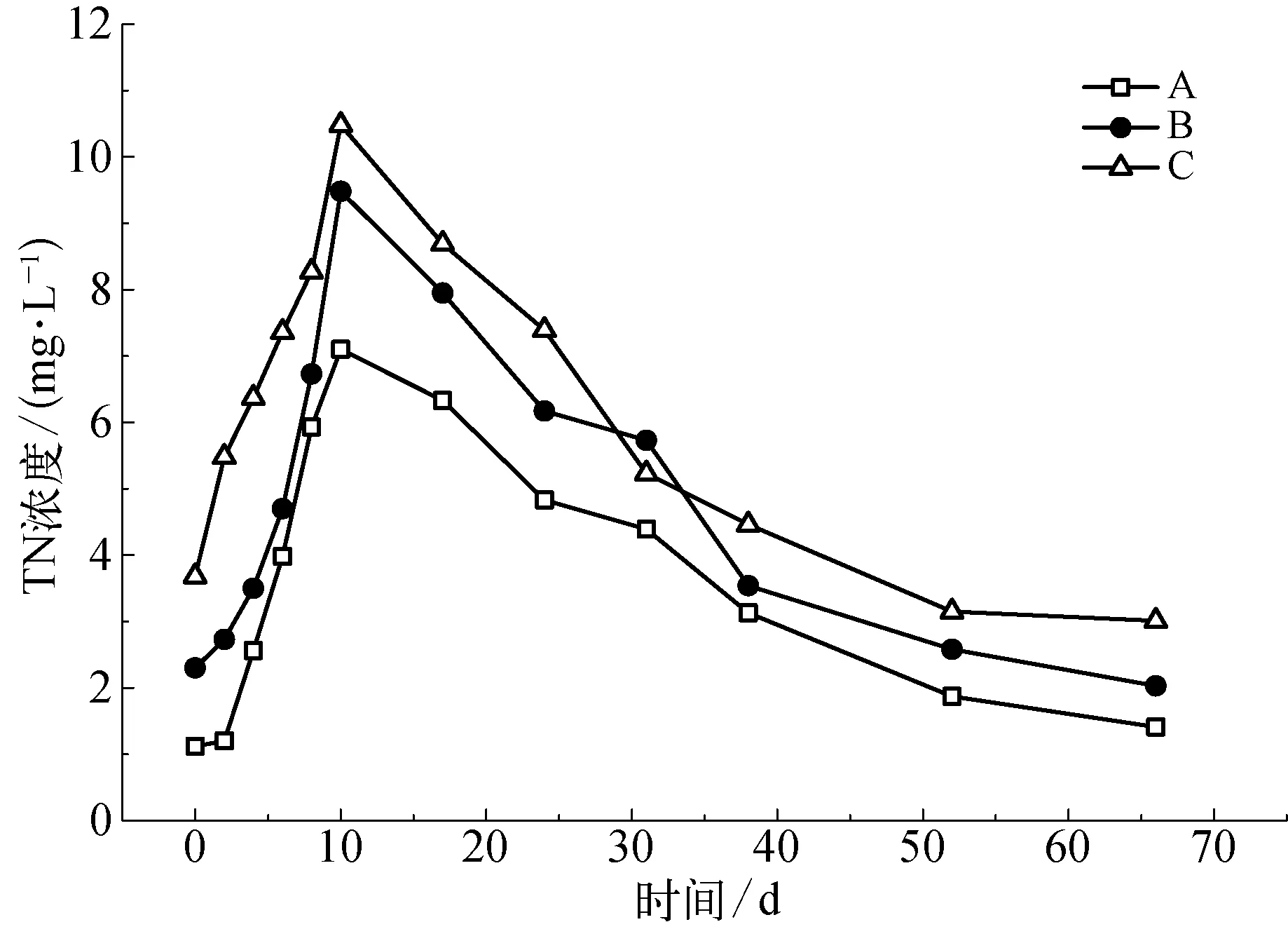
图6 水体TN浓度随时间的变化Fig.6 Variation with Time of TN Concentration in Water Body
试验各工况水体中TN浓度呈先上升再下降的趋势,这主要是由于在试验前期随着苦草的腐烂释放出大量的营养盐,苦草体内所含的氮也不断地被释放出来,致使水体中的TN浓度变高。同时由于水体中溶解氧充足,苦草残体的生物量越高,微生物作用越明显,因腐解释放到水体中的TN浓度也越高,TN浓度得以迅速达到一个峰值。随着时间推移,由于植物腐烂耗氧致使水体溶解氧浓度维持在较低的水平,使无机氮浓度变化趋于平缓。同时水体中的氮在先后经过氨化、硝化和反硝化作用下转化成氧化亚氮和氮气进入大气,致使各工况水体中的TN浓度均有所降低[6]。
2.5 不同生物量苦草残体腐解对水体ρ(TP)的影响
水体中TP浓度随时间的变化如图7所示。由图7可知,各工况水体中的TP浓度在试验初期迅速上升,在第6 d达到峰值,然后呈下降趋势,在试验末期水体中TP的浓度均高于初始值,说明苦草残体的腐解使得水体中TP的含量有所上升。对于不同生物量的工况而言,在整个试验过程中,水体中TP的浓度随着生物量的增加而逐渐升高,且在试验结束时C工况水体中TP的浓度明显高于其他两组。

图7 水体TP浓度随时间的变化Fig.7 Variation with Time of TP Concentration in Water Body
试验前期水体中的TP浓度迅速上升,这是由于在腐解前期苦草残体体内部分不稳定有机物释放至水体,迅速向水体释放出磷[16-17];而在中后期由于残体腐解处在难溶性物质分解阶段,腐解负荷相对前期较低,所以TP的浓度逐渐下降。当水体中残留的生物量很大时,极易造成水体缺氧,促使植物体厌氧分解,向水体释放大量的磷[9],因此随着生物量的增加,苦草残体腐解后释放到水体中的磷浓度也有所升高。
3 结论
(1)随着不同生物量苦草残体的腐解,水体pH值均呈现先下降再上升而后又下降的趋势,且在试验完成时均高于试验初始值,但不同生物量苦草残体腐解对水体pH值影响不明显;水体中的DO随残体的腐解而迅速降低,而后又逐渐升高,且生物量越大,水体中DO越小。
(2)苦草残体腐解过程对水体中有机物的影响是长期的,即水体中COD浓度随苦草残体腐解一直呈现上升趋势,在试验末期远高于试验初始值,这可能与试验中后期苦草残体腐解产生有机物的速率要远大于微生物利用有机碳源进行自身反硝化作用的速率有关。而且生物量越大,水体中COD浓度越高。
(4)沉水植物苦草进入衰亡期后,在一定生物量范围内,残体的腐解不会对水质造成恶劣的影响,但是仍要控制其残留生物量,以避免过多的苦草残体腐解对水体造成二次污染。
[1]曹培培,刘茂松,唐金艳,等.几种水生植物腐解过程的比较研究[J].生态学报,2014,34(14):3848-3858.
[2]种云霄,胡洪营,钱易.大型水生植物在水污染治理中的应用研究进展[J].环境污染治理技术与设备,2003,4(2):36-40.
[3]颜昌宙,许秋瑾,赵景柱,等.五里湖生态重建影响因素及其对策探讨[J].环境科学研究,2004,17(3):44-47.
[4]马凯,蔡庆华,谢志才,等.沉水植物分布格局对湖泊水环境N、P 因子影响[J].水生生物学报,2003,27(3):232-236.
[5]李文朝,陈开宁,吴庆龙,等.东太湖水生植物生物质腐烂分解试验[J].湖泊科学,2001,13(4):331-336.
[6]周林飞,邹飞,李颖卓.沉水植物腐解对人工湿地水质的持续影响研究[J].水土保持学报,2013,27(6):119-123.
[7]唐金艳,曹培培,徐驰,等.水生植物腐烂分解对水质的影响[J].应用生态学报,2013,24(1):83-89.
[8]Hopkinson Jr C S,Vallino J J,Nolin A.Decomposition of dissolved organic matter from the continental margin[J].Deep Sea Research Part II:Topical Studies in Oceanography,2002,49(20):4461-4478.
[9]潘慧云,徐小花,高士祥.沉水植物衰亡过程中营养盐的释放过程及规律[J].环境科学研究,2008,21(1):64-68.
[10]尚士友,申庆泰,杜健民,等.内蒙古乌梁素海沉水植物的收割工程技术[J].湖泊科学,2004,16(2):170-176.
[11]张来甲,叶春,李春,等.不同生物量苦草在生命周期的不同阶段对水体水质的影响[J].中国环境科学,2013,33(11):2053-2061.
[12]国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[13]王博,叶春,李春华,等.初春苦草腐解过程中营养盐释放过程及规律[J].生态与农村环境学报,2012,28(2):171-175.
[14]王艳丽,肖瑜,潘慧云,等.沉水植物苦草的营养成分分析与综合利用[J].生态与农村环境学报 .2006,22(4):45-47,70.
[15]Wang Chao, WangCun, WangZe. Effects of submerged macrophytes on sediment suspension and NH4N release under hydrodynamic conditions[J].Journal of Hydrodynamics,2010,22(6):810-815.
[16]武海涛,吕宪国,杨青,等.三江平原典型湿地枯落物早期分解过程及影响因素[J].生态学报,2007,27(10):331-336.
[17]叶春,王博,李春华,等.沉水植物黑藻腐解过程中营养盐释放过程[J].中国环境科学,2014,34(10):2653-2659.
