诺丽果粉增强免疫力功能实验研究
2018-01-22,,,,
,, ,,
(云南省热带作物科学研究所,云南景洪 666100)
诺丽(MorindacitrigoliaL.)是茜草科巴戟天属热带常绿多年生阔叶灌木或小乔木。现代科学研究表明,诺丽果中含有多糖、黄酮、皂甙、环烯醚萜类、蒽醌类、木脂素类、氨基酸和矿质元素等多种生理活性成分[1-2]。多糖是诺丽果的主要活性成分,国内外研究表明多种生物多糖均具有一定的免疫调节作用[3-5],日本一个研究团队研究得出诺丽果具有免疫调节特性,其多糖物质能够激发TNF-α、IL-1β、IL-10、TFN-γ、NO等炎症细胞因子的分泌释放,能促使宿主的免疫系统能力提升[6-7]。另外,黄酮、皂甙、环烯醚萜类等成分也具有免疫调节的作用[8-10]。早在2000多年前诺丽果就被波利尼西亚人用于治疗多种疾病,被人们誉为“千年圣果”,波利尼西亚传统药典记录称诺丽能预防和治疗一些疾病,其药理主要是通过刺激免疫系统从而抵抗细菌、病毒、寄生虫和真菌感染[11-12]。
诺丽果是典型的呼吸跃变型果实,采后不易贮存,且果实种子含量多,气味独特,难以鲜食。为了解决这一问题,可以将诺丽果加工为果汁饮料、果粉和片剂等产品[13]。目前,诺丽果汁已通过安全性人体实验[14],马德禄等研究了诺丽果汁对正常小鼠免疫功能的影响,结果表明诺丽对正常小鼠具有很好的免疫调节和促进免疫应答的功效[15]。诺丽果粉也被证实其食用是安全可靠的[16],能够显著提高小鼠的缺氧耐受力[17]和运动耐力[18],并具有明显的抗氧化作用[19]。但目前对于诺丽果粉提高免疫力的研究还未见报道。本实验通过30 d喂养实验经口给予小鼠诺丽果粉后,对其细胞免疫功能、体液免疫功能、单核-巨噬细胞吞噬能力及NK细胞活性四个方面免疫指标的检测,探讨诺丽果粉的免疫调节作用,以期为诺丽保健食品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
诺丽果粉 采摘于云南省热带作物科学研究所科研实验基地的诺丽鲜果,经分选、清洗、切片后,45 ℃鼓风干燥至水分含量低于8%,粉碎,过100目筛,为棕黄色粉末,成人每日推荐量为5 g/60 kg BW;昆明小鼠 生产许可证号为SCXK(川)2013-19,160只,SPF级,雌性,体重为18~22 g,四川省中医药科学院实验动物中心;饲料 四川省医学科学院四川省人民医院实验动物研究所;RPMI1640细胞培养液 美国Gibco公司;Giemsa染液、Hank’s液、伴刀豆球蛋白A(ConA) 美国Sigma公司;印度墨汁 北京化学试剂公司;SA缓冲液、补体(豚鼠血清) 实验室自行制备。
CO2培养箱 美国Thermo Forma公司;离心机 上海安亭科学仪器有限公司;电子分析天平 瑞士梅特勒-托利多公司;723分光光度仪 上海精密科学仪器有限公司;2010型酶标仪 奥地利Anthos公司。
1.2 实验方法
1.2.1 动物与分组 将动物分为四个大组,每个大组40只动物。免疫一组进行小鼠腹腔巨噬细胞吞噬鸡红细胞实验;免疫二组进行NK细胞活性测定及淋巴细胞转化实验;免疫三组进行抗体生成细胞实验、血清溶血素测定和迟发型变态反应实验;免疫四组进行小鼠碳廓清实验。每大组又随机分为阴性对照组、低、中、高剂量组,每组10只小鼠。实验环境为屏蔽系统,温度20~25 ℃,相对湿度40%~70%。
1.2.2 剂量选择及给予方式 实验分别设计诺丽果粉低、中、高剂量分别为0.833、1.667、2.500 g/kg BW(分别为成人推荐剂量的10、20、30倍)[20]。分别称取10.42、20.83、31.25 g诺丽果粉,加蒸馏水至250 mL混匀,另设阴性对照组给予等体积蒸馏水。小鼠按20 mL/kg BW体积给小鼠灌胃,每天1次,连续30 d。
1.2.3 检验项目与方法 根据卫生部《保健食品检验与评价技术规范》中增强免疫力功能的检验项目与方法进行检测[21]。
1.2.3.1 脏器/体重比值测定 实验结束后,称体重,脱臼处死小鼠,称取脾脏和胸腺,并计算脏/体比值。
1.2.3.2 细胞免疫功能 迟发型变态反应(DTH)(足跖增厚法):给小鼠腹腔注射2%(v/v)SRBC(0.2 mL/每鼠)致敏4 d后,测量左后足跖厚度,然后在测量部位皮下注射20%(v/v)SRBC(20 μL/每鼠),于注射后24 h测量左后足跖厚度,同一部位测量三次,取平均值,以攻击前后足跖厚度差值(足跖肿胀度)来表示DTH的程度。
ConA诱导的小鼠淋巴细胞转化实验(MTT法):首先进行脾细胞悬液制备,小鼠颈椎脱臼处死,无菌条件下取脾,放在装有适量无菌Hank’s液的平皿内,轻轻将脾磨碎,制成细胞悬液,经200目筛网过滤。用Hank’s液洗涤2次,每次1000 r/min离心10 min。然后取沉淀悬浮于1 mL的完全培养液中,台酚兰染色计数活细胞数(应在95%以上),调整细胞浓度为3×106个/mL。然后将制备好的每份细胞悬液分2孔加入24孔培养板中,每孔1 mL,在其中一孔加75 μL ConA液(相当于7.5 μL/mL),另一孔作为对照,装入5% CO2、37 ℃的二氧化碳孵箱中培养72 h。培养结束前4 h,每孔轻轻吸去上清液0.7 mL,加入0.7 mL不含小牛血清的RPMI1640培养液,同时加入MTT(5 mg/mL)50 μL/孔,继续培养4 h,培养结束后,每孔加入1 mL酸性异丙醇,混匀,使紫色结晶完全溶解,然后分装到96孔培养板,每孔做3个平行孔,用酶标仪,以570 nm波长测定光密度值。淋巴细胞的增殖能力用加ConA孔的光密度值减去不加ConA孔的光密度值表示。
1.2.3.3 体液免疫功能 抗体生成细胞检测(Jerne改良玻片法):每只小鼠腹腔注射0.2 mL将压积SRBC用生理盐水配成2%(v/v)的细胞悬液,将免疫5 d后的小鼠颈椎脱臼处死,取脾,放在装有Hank’s液的平皿内,轻轻将脾磨碎,制成细胞悬液,经200目筛网过滤,1000 r/min离心10 min、用Hank’s液洗涤2次,最后将细胞悬浮在5 mL RPMI1640培养液中,台酚兰染色计数(应在95%以上),并将细胞浓度调整为5×106个/mL,制成脾细胞悬液。将琼脂糖用双蒸水配制成1%的水溶液,水浴保温,与等量的pH7.4双倍浓度Hank’s液混合,分装小试管,每管0.5 mL,再向管内加用SA缓冲液配制的10%压积SRBC 50 μL,20 μL脾细胞悬液,迅速混匀后,倾倒于琼脂糖薄层的玻片上,做两个平行样,待琼脂凝固后,将玻片水平扣放在片架上,放入二氧化碳培养箱中孵育1.5 h,然后用SA液稀释的补体加入到玻片架凹槽内,继续温育1.5 h,计数溶血空斑数。
血清溶血素测定(血凝法):每只小鼠腹腔注射用生理盐水配制的2%(v/v)压积SRBC 0.2 mL进行免疫,5 d后,摘除小鼠的眼球,取血于离心管内,放置1 h,2000 r/min离心10 min,分离,收集血清。用生理盐水将血清作倍比稀释,每份稀释12孔,将不同稀释度的血清置于微量血凝板中,每孔100 μL,再加入100 μL 0.5%(v/v)的SRBC悬液,混匀,装入湿盒中37 ℃孵育3 h后,观察每孔的血球凝集程度,并计算抗体积数。
抗体水平=(S1+2S2+3S3……nSn)
式中:1、2、3……n代表对倍稀释的指数,S代表凝集程度的级别,抗体积数越大,表示血清抗体越高。
1.2.3.4 单核-巨噬细胞功能 小鼠碳廓清实验:小鼠尾静脉注射用5倍生理盐水稀释的印度墨汁,按每10 g体重注射0.1 mL,墨汁注入后立即计时,于注入后第2、10 min,分别从内眦静脉丛取血20 μL,加到2 mL 0.1% Na2CO3溶液中,以0.1% Na2CO3溶液作空白对照,用723分光光度计在600 nm处测定光密度值(OD)。取血后将小鼠处死,称取肝、脾质量,按下式计算吞噬指数α。

式中:OD1、OD2分别为2、10 min时样品的吸光度;t1、t2分别为2、10 min。

表1 诺丽果粉对免疫一组小鼠体重的影响Table 1 Effects of Morinda citrigolia fruit powder on immunized mice body weight from group 1
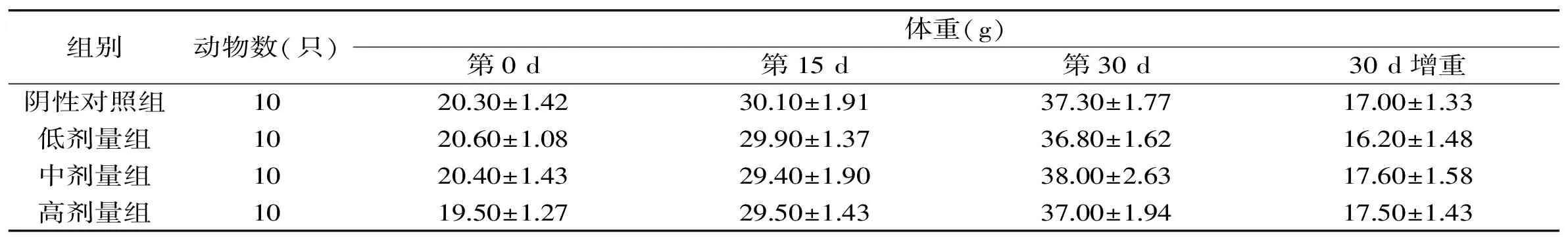
表2 诺丽果粉对免疫二组小鼠体重的影响Table 2 Effects of Morinda citrigolia fruit powder on immunized mice body weight from group 2
小鼠腹腔巨噬细胞吞噬鸡红细胞实验(半体内法):给小鼠腹腔注射用生理盐水洗涤3次后的20%鸡红细胞(1500 r/min,10 min)悬液,每只1 mL,30 min后,颈椎脱臼处死。再向小鼠腹腔注入生理盐水2 mL,转动鼠板1 min,吸取腹腔洗液1 mL,滴于洁净的载玻片上,置于37 ℃湿盒内30 min,孵毕,取出用生理盐水漂洗,晾干后以甲醇/丙酮(1∶1)固定,4% Giemsa PBS染色3 min,再用蒸馏水漂洗后晾干,镜检。按下式计算小鼠腹腔吞噬百分率和吞噬指数。


1.2.3.5 NK细胞活性测定(乳酸脱氢酶LDH测定法) 小鼠颈椎脱臼处死,无菌取脾,磨碎,制成脾细胞悬液,过200目筛网后,用Hank’s液洗3次,每次1000 r/min离心10 min。弃上清,将细胞浆弹起,加入0.5 mL灭菌水裂解红细胞,台酚兰染色计数(活细胞数应在95%以上),最后用RPM1640完全培养液将细胞浓度调整为2×107个/mL,此为效应细胞。在实验前24 h将靶细胞进行传代培养,用Hank’s液洗3次,用RPM1640完全培养液将细胞浓度调整为4×105个/mL,此为靶细胞。取靶细胞和效应细胞各100 μL(效靶比50∶1),置于U型96孔培养板中各3个平行孔,同时做靶细胞自然释放孔加靶细胞和培养液各100 μL及最大释放孔加靶细胞100 μL和2.5% Triton 100 μL各3个平行孔,置5% CO2、37 ℃二氧化碳孵箱中培养4 h,然后以1500 r/min离心5 min,每孔吸取上清液100 μL置于另一96孔培养板中,同时每孔再加入LDH基质液100 μL,反应10 min,每孔加入1 mol/L的HCl 30 μL终止反应,在酶标仪490 nm处测定OD值,按下式计算NK细胞活性。
NK细胞活性(%)=(反应孔OD-自然释放孔OD)/(最大释放孔OD-自然释放孔OD)×100
1.2.3.6 结果判定 在细胞免疫功能、体液免疫功能、单核-巨噬细胞功能、NK细胞活性四个方面任两个方面结果阳性(其中细胞免疫功能、体液免疫功能、单核-巨噬细胞功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定其结果阳性;NK细胞活性测定实验的一个以上剂量组结果阳性,可判定其结果阳性),可判定诺丽果粉具有增强免疫力功能作用。
1.3 数据统计分析

2 结果与分析
2.1 诺丽果粉对小鼠体重的影响
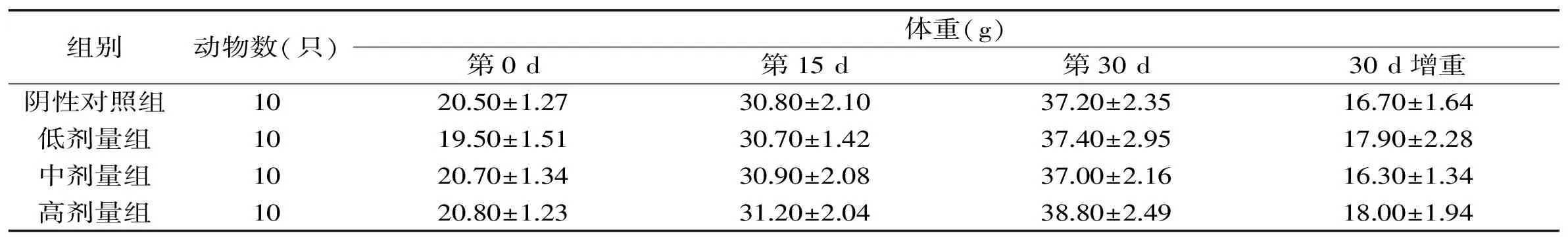
表3 诺丽果粉对免疫三组小鼠体重的影响Table 3 Effects of Morinda citrigolia fruit powder on immunized mice body weight from group 3

表4 诺丽果粉对免疫四组小鼠体重的影响Table 4 Effects of Morinda citrigolia fruit powder on immunized mice body weight from group 4
由表1~表4可见,诺丽果粉四个免疫组小鼠的初始(0 d)体重与阴性对照组相比,经方差齐性检验,方差齐(p>0.05),且方差分析结果,说明小鼠的初始体重在各组间是均衡的。四个免疫组中各剂量组小鼠实验中期(15 d)、末期(30 d)的体重以及实验期间小鼠体重的增长(30 d增重)与阴性对照组相比,差异均无统计学意义(p>0.05),说明诺丽果粉对小鼠的体重增长无明显影响。
2.2 诺丽果粉对小鼠免疫器官脏器/体重比值的影响
胸腺与脾脏是动物体内主要的免疫器官,是免疫细胞分化、成熟、定居增殖和产生免疫应答反应的场所。免疫器官的质量是反映机体非特异性免疫功能状况的重要而直观的指标,胸腺、脾脏与体重的比值能反映免疫器官发育和免疫细胞的功能状况,并能比较客观的反映机体的非特异性免疫能力[22]。由表5可见,连续灌胃30 d后,诺丽果粉各受试组小鼠的脾脏/体重比值、胸腺/体重比值均高于阴性对照组,但与阴性对照组相比,差异均无统计学意义(p>0.05),表明诺丽果粉对小鼠的免疫器官重量无明显影响,对免疫器官无刺激作用。

表5 诺丽果粉对小鼠免疫器官脏器/体重比值的影响Table 5 Effects of Morinda citrigolia fruit powder on ratio of immune organ to body weight of mice
2.3 诺丽果粉对小鼠细胞免疫功能的影响
2.3.1 诺丽果粉对小鼠迟发型变态反应(DTH)的影响 DTH是一种由T细胞介导的炎症免疫反应,DTH的变化可反映机体细胞免疫功能的状况[23]。由表6可见,连续灌胃30 d后,诺丽果粉受试组中的三个剂量组小鼠的足跖肿胀均高于阴性对照组,且中、高剂量组小鼠与阴性对照组比较具有显著性差异(p<0.05),表明诺丽果粉具有促进小鼠迟发型变态反应的作用,能明显提高小鼠细胞免疫功能。

表6 诺丽果粉对小鼠迟发型变态反应(DTH)的影响Table 6 Effects of Morinda citrigolia fruit powder on delayed type hypersensitivity of mice
注:*表示与阴性对照组比较,差异显著(p<0.05);**表示与阴性对照组比较,差异极显著(p<0.01);表8同。
2.3.2 诺丽果粉对ConA诱导的小鼠淋巴细胞转化实验的影响 当T淋巴细胞受ConA刺激后发生母细胞增殖反应,最后分化成为效应性T细胞,具备细胞免疫功能。淋巴细胞增殖能力可以反映小鼠的特异性细胞免疫功能[24]。由表7可见,连续灌胃小鼠30 d后,诺丽果粉各受试组小鼠的淋巴细胞增殖能力均高于阴性对照组,但与阴性对照组相比,差异均无统计学意义(p>0.05),表明诺丽果粉对小鼠淋巴细胞增殖能力无明显的促进作用。

表7 诺丽果粉对ConA诱导的小鼠淋巴细胞转化实验的影响Table 7 Effects of Morinda citrigolia fruit powder on lymphocyte transformation test of mice induced by ConA
综上,根据1.2.3.6判定标准可得出诺丽果粉对小鼠细胞免疫实验结果为阳性。
2.4 诺丽果粉对小鼠体液免疫的影响
2.4.1 诺丽果粉对抗体生成细胞的影响 经过SRBC免疫的小鼠脾细胞悬液与一定量的SRBC混合,借助补体使分泌抗体的脾细胞周围的SRBC溶解,形成肉眼可见的空斑,计算形成空斑数目,通过抗体细胞形成空斑数目的多少,反映抗体形成细胞产生抗体的能力[25]。由表8可见,连续灌胃30 d后,诺丽果粉受试组中的三个剂量组小鼠的溶血空斑数均高于阴性对照组,且中、高剂量组小鼠均显著高于阴性对照组(p<0.05),表明诺丽果粉具有促进小鼠的抗体生成细胞增殖的作用。

表8 诺丽果粉对小鼠抗体生成细胞的影响Table 8 Effects of Morinda citrigolia fruit powder on antibody forming cells of mice
2.4.2 诺丽果粉对小鼠血清溶血素的影响 用SRBC免疫小鼠后,由B淋巴细胞产生抗SRBC抗体(溶血素),这些抗体可以在培养孔导致绵羊血凝集,利用其凝集程度(以抗体积数计)来检测溶血素的水平,抗体积数可作为B细胞免疫功能强弱的反映[26]。由表9可见,连续灌胃30 d后,诺丽果粉各受试组小鼠的抗体积数均高于阴性对照组,但与阴性对照组相比,差异均无统计学意义(p>0.05),表明诺丽果粉对小鼠的血清溶血素无明显提高作用。

表9 诺丽果粉对小鼠血清溶血素的影响Table 9 Effects of Morinda citrigolia fruit powder on serum hemolysin of mice
综上,根据1.2.3.6判定标准可得出诺丽果粉对小鼠体液免疫实验结果阳性。
2.5 诺丽果粉对小鼠单核-巨噬细胞吞噬功能的影响
2.5.1 诺丽果粉对小鼠单核-巨噬细胞碳廓清功能的影响 巨噬细胞具有吞噬异物、处理抗原等功能,当颗粒状异物(碳粒)被静脉注射进入血液循环后,即可被单核巨噬细胞迅速吞噬而从血液中廓清,其中主要被肝脏和脾脏内的巨噬细胞所吞噬,因此单核巨噬细胞的吞噬能力是反映机体非特异性免疫功能的重要指标之一[27]。由表10可见,连续灌胃30 d后,诺丽果粉各受试组小鼠的吞噬指数均高于阴性对照组,但与阴性对照组相比,差异均无统计学意义(p>0.05),表明诺丽果粉对小鼠的单核-巨噬细胞碳廓清功能无明显促进作用。

表10 诺丽果粉对小鼠单核-巨噬细胞碳廓清功能的影响Table 10 Effects of Morinda citrigolia fruit powder on mononuclear macrophage carbon clearance of mice
2.5.2 诺丽果粉对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响 巨噬细胞是主要的免疫调节和免疫应答细胞,在体内参与免疫防御,能有效清除病原体,小鼠腹腔注射鸡红细胞后,通过记录被吞噬的鸡红细胞总数,判断巨噬细胞的吞噬功能[28]。由表11可见,连续灌胃30 d后,诺丽果粉各受试组小鼠的吞噬率和吞噬指数均高于阴性对照组,但与阴性对照组相比,差异均无统计学意义(p>0.05),表明诺丽果粉对小鼠腹腔巨噬细胞的吞噬能力无明显提高作用。

表11 诺丽果粉对小鼠巨噬细胞吞噬鸡红细胞能力的影响Table 11 Effects of Morinda citrigolia fruit powder on ability of chicken-red cells phagocytosis of mice
综上,根据1.2.3.6判定标准可得出诺丽果粉对小鼠单核-巨噬细胞吞噬功能实验结果阴性。
2.6 诺丽果粉对小鼠NK细胞活性的影响
NK细胞是机体免疫监视功能的重要执行者,其先于T细胞发挥作用,可杀伤某些肿瘤细胞、病毒感染细胞、某些自身组织细胞(如血细胞)、寄生虫等,因此NK细胞是机体抗肿瘤、抗感染的一种重要免疫细胞[29]。由表12可见,连续灌胃30 d后,诺丽果粉各受试组小鼠的NK细胞活性与阴性对照组相比,差异均无统计学意义(p>0.05),表明诺丽果粉对小鼠的NK细胞活性无明显促进作用。因此,可判定诺丽果粉对小鼠NK细胞活性实验结果阴性。

表12 诺丽果粉对小鼠NK细胞活性的影响Table 12 Effects of Morinda citrigolia fruit powder on NK cell activity of mice
3 结论
本实验研究结果显示,经口给予小鼠低、中、高三个剂量组的诺丽果粉30 d后,对小鼠体重增长、脾脏/体重比值、胸腺/体重比值、ConA诱导小鼠淋巴细胞转化能力、小鼠血清溶血素、单核-巨噬细胞碳廓清功能、小鼠巨噬细胞吞噬鸡红细胞能力和NK细胞活性无明显影响。诺丽果粉中、高剂量组能提高小鼠的迟发型变态反应,并促进小鼠的抗体生成细胞增殖,具有提高机体细胞免疫功能和体液免疫功能的作用,从而可以判定诺丽果粉具有增强免疫力的作用。
[1]张伟敏,符文英,施瑞城,等.诺丽果实和叶中主要功能性物质的分布与营养评价[J]. 食品科学,2008,29(10):575-577.
[2]陈新璐,狄志彪,孙稚颖,等. 中药海巴戟的现代研究进展[J]. 环球中医药,2016,9(10):1280-1284.
[3]徐贤柱,饶华,蔡险峰,等. 杜仲叶多糖提取及对小鼠免疫功能影响研究[J]. 时珍国医国药,2013,24(3):541-542.
[4]王丽娟,张彦青,王勇,等. 姬松茸多糖增强免疫作用及急性毒性研究[J]. 食品科学,2014,35(13):258-261.
[5]SUN W J,MENG K,Qi C H,et al. Immune-enhancing activity of polysaccharides isolated fromAtractylodismacrocephalaeKoidz[J]. Carbohydrate Polymers,2015,126:91-96.
[6]Hirazumi A,Furusawa E,Chou S C,et al. Immuno-modulation contributes to the anticancer activity ofMorindacitrifolia(Noni)fruit juice[J]. Proceedings of the Western Pharmacological Society,1996,39:7-9.
[7]Hirazumi A,Furusawa E. An immunomodulatory polysacchar-ide-rich substance from the fruit juice ofMorindacitrifolia(Noni)with antitumor activity[J]. Phytotherapic Research,1999,13(5):380-387.
[8]马锐,吴胜. 中药黄酮类化合物药理作用及作用机制研究进展[J]. 中国药物警戒,2013,10(5):286-290.
[9]张海燕. 5种皂甙对小鼠免疫功能的影响对比实验[J]. 山西农业科学,2013,41(5):458-459.
[10]郑礼胜,刘向前. 环烯醚萜类研究进展[J]. 天然产物研究与开发,2009,21(4):702-711.
[11]Dixon A R,Mcmillen H,ETKIN N L. Ferment this:the transformation of Noni,a traditional Polynesian medicine(Morindacitrifolia,Rubiaceae)[J]. Ecological Botony,1999,53(1):51-68.
[12]Earle J E. Plantas Medicinales en el Tropico Hu medo[M].San Jose:Editorial Guayacan,2001.
[13]杨焱,刘昌芬,李海泉,等. 海巴戟研究进展及开发应用建议[J]. 热带农业科技,2009,32(4):23-29.
[14]West B J,Jensen C J,Westendorf J,et al. A safety review of noni fruit juice[J]. J Food Sci,2006,71(8):100-106.
[15]马德禄,张骏,谢文利,等.大溪地诺丽果汁对正常小鼠免疫功能的影响[C]. 第十届全国抗炎免疫药理学学术会议论文集. 2010,22-23.
[16]林卫华,郑定仙,冯丁山,等. 诺丽果粉食用安全性研究[J]. 中国热带医学,2011,11(12):1509-1511.
[17]林卫华,郑定仙,王湛,等. 诺丽果粉对小鼠缺氧耐受力的影响[J]. 时珍国医国药,2012,23(12):3009-3010.
[18]林卫华,郑定仙,王湛,等. 诺丽果粉对小鼠运动耐力的影响[J]. 中国热带医学,2012,12(6):773-774.
[19]李明,符文英,赵帅,等. 海巴戟冻干粉抗氧化活性的研究[J]. 黑龙江畜牧兽医,2016(12):171-172,177.
[20]王毅虎,张兵,王富荣,等. 胶原蛋白增强免疫力功能研究[J]. 明胶科学与技术,2015,35(3):137-143.
[21]中华人民共和国卫生部. 保健食品检验和评价技术规范(2003年版)[M]. 北京:中华人民共和国卫生部,2003.
[22]李俊,黄艳,廖日权,等. 罗汉果多糖对小鼠免疫功能的影响[J]. 中国药理学通报,2008,24(9):1237-1240.
[23]方笋,王萌,赵晓娟,等. 芍芪多苷对迟发型变态反应小鼠细胞免疫功能的影响[J]. 中国药理学通报,2008,24(4):444-448.
[24]李敬双,刘英姿,唐雨顺,等. 苜蓿多糖对小鼠淋巴细胞增殖和NK细胞活性影响的研究[J]. 中国农学通报,2012,28(32):89-93.
[25]蒋建江,潘翔,钱锐,等. 微量溶血分光光度法测定气管炎疫苗的免疫活性[J]. 中国生物制品学杂志,2014,27(9):1217-1219.
[26]彭亮,王彦武,傅伟忠,等. 纳豆粉对小鼠免疫调节作用的实验研究[J]. 中国食品卫生杂志,2014,26(4):336-339.
[27]杨莲,段小花,李松梅,等. 普洱茶对免疫低下小鼠单核-巨噬细胞系统碳粒廓清功能的影响[J]. 云南中医中药杂志,2008,29(10):43-44.
[28]张淑莉,张琪,景晓红. 小鼠腹腔巨噬细胞的提取与鉴定[J]. 国际检验医学杂志,2015,36(2):174-175.
[29]刘英姿,罗有梁,周铁忠. 碎米花杜鹃原花青素A-1对小鼠免疫细胞的影响[J]. 中药药理与临床,2012(2):45-48.
